三株鸡源大肠杆菌iss基因的检测
樊琛++徐旺烨++曾庆华++王会++李燕++王雷++郭兴峰

摘要:采用鸡胚致死对HL11、HL32、SD27鸡源大肠杆菌(Escherichia coli)的致病性进行测定,并检测其血清抗性及iss基因序列。结果表明,3株大肠杆菌为致病性、血清补体敏感菌株,iss基因序列与已知禽大肠杆菌iss基因序列同源性为99.0%~99.7%。
关键词:鸡源大肠杆菌(Escherichia coli);iss基因;致病性;血清抗性
中图分类号:S831 文献标识码:A 文章编号:0439-8114(2016)22-5969-03
DOI:10.14088/j.cnki.issn0439-8114.2016.22.060
Detection of iss Gene of Three Avian E.coli Strains
FAN Chen1,XU Wang-ye2,ZENG Qing-hua1,WANG Hui1,LI Yan1,WANG Lei1,GUO Xing-feng1
(1.Agricultural School,LiaoCheng University,Liaocheng 252059,Shandong,China;
2.College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
Abstract:The virulence of avian E.coli strains HL11,HL32,SD27 were detected by embryo lethality assay. The presence of iss gene and complement resistance were tested. Results showed that three strains are pathogenic and complement sensitive. The iss sequences have 99.0%~99.7% identity with reference sequence.
Key words:avian E.coli; iss gene; virulence; complement resistance
大肠杆菌(Escherichia coli)是食品污染程度的重要指标,某些血清型的大肠杆菌对人类和动物具有致病性,对婴幼儿以及家禽尤为明显[1,2]。大肠杆菌病为人畜共患病,受到大肠杆菌污染的食物被食用后,可以导致食物中毒甚至是严重的败血症,并增加其他病原体感染机会,如痢疾、霍乱或者伤寒等肠道疾病,对食品安全有较大影响[2-4]。大肠杆菌的血清型繁多,但不同血清型的大肠杆菌有共同的致病物质基础[4,5]。研究发现,与大肠杆菌毒力相关的致病因子有1型菌毛、毒素、外膜蛋白、ColV质粒、补体抗性、铁转运系统等[6-9]。
在大肠杆菌诸多致病因子中,菌毛在致病性大肠杆菌侵入机体,并在体内定居、增殖、释放毒力因子的过程中起着重要的作用。但细菌进入机体血流后,将面对血液中的杀菌物质,如补体等。细菌抵抗血液中杀菌物质的能力,对细菌致病力有重要影响。研究表明,iss基因(Increased serum survival gene,iss gene)存在于ColV質粒上,iss基因编码的蛋白Iss属于外膜蛋白的一部分,与细菌抗补体作用有关,可增强大肠杆菌的血清抗性[10]。本试验对鸡源大肠杆菌HL11、HL32、SD27进行了致病性检测,并对iss基因进行序列测定,探讨iss基因序列与大肠埃希菌致病力的相互关系,为iss基因作为毒力标志基因在大肠杆菌毒力判定、食品安全检测中的应用等提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株 HL11、HL32为东北农业大学动物医学学院分离,30%甘油-20 ℃保存;SD27为聊城大学农学学院分离,30%甘油-20 ℃保存。
1.1.2 引物 参考GenBank中的禽大肠杆菌iss基因核苷酸序列(登入号:AF042279)设计两对引物。引物1上游:5agctatcgtttaattattatcac3;引物1下游5gtagggagcccagaagtat3;引物2上游:5cgcggatccag
gattctgccgttttta3;引物2下游:5cgcgtcgaccatatcgatggg
caacta3[11]。
1.1.3 试剂 伊红美蓝培养基、麦康凯培养基、营养肉汤培养基、生化试验鉴定管等购自青岛海博生物技术有限公司。蛋白酶K、RnaseA、rTaq酶、pMD18-T克隆载体及相关试剂均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 细菌的活化 无菌条件下将样本分别接种于伊红美蓝培养基置37 ℃恒温箱培养24 h后,挑取紫黑色带金属光泽的菌落于麦康凯琼脂平板,继续培养24 h。挑取麦康凯琼脂平板上桃红色典型菌落。进行革兰氏染色镜检,取另一半接种于LB普通营养斜面培养基恒温培养箱37 ℃培养24 h,用于生化鉴定。
1.2.2 生化鉴定 取细菌纯培养物分别接种于吲哚试验、MR试验、VP试验、枸橼酸盐试验管中,并进行三糖铁试验、尿素酶试验、触酶试验、半固体营养琼脂穿刺试验、淀粉试验,其中触酶试验立刻观察,其他试验分别置37 ℃温箱摇床培养。吲哚试验、MR试验、尿素酶试验、半固体营养琼脂穿刺试验、淀粉试验于24 h观察,VP试验于48 h滴加试剂观察,枸橼酸盐试验于96 h观察。取细菌纯培养物接种6种糖类微量发酵管(葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖、木糖发酵管),置37 ℃培养24~48 h后进行观察。
1.2.3 对鸡胚的致病性试验 将待测菌接种于LB液体培养基,37 ℃培养过夜。收集细菌用PBS溶液洗2次,并用PBS溶液倍比稀释。取0.1 mL稀释液经尿囊腔注射12日龄SPF鸡胚,大约100~300 CFU,每组10只。同时取0.1 mL稀释液涂板,做细菌计数。对照组分两组,一组注射PBS溶液,一组不注射。每日检蛋,记录每日死亡数,至第四天,计算胚胎致死率。
1.2.4 扩增模板制备 将待测菌划板,挑取平板上的单菌落,加入40 μL lysing Buffer(10 mmol/L Tris-Cl pH 7.5,1 mmol/L EDTA)和蛋白酶K(终浓度为50 μg/mL),混匀,置于55 ℃温育10 min后再置80 ℃温育10 min,最后加80 μL灭菌三蒸水,-20 ℃保存。
1.2.5 iss基因的PCR扩增 PCR扩增反应体系:10×PCR Buffer 5 μL,dNTPs 4 μL,上、下游引物(50 pmol/μL)各1 μL,DNA模板 5 μL,灭菌ddH2O 33.5 μL,rTaq酶 0.5 μL,共50 μL。PCR扩增反应程序:97 ℃预变性5 min;97 ℃变性1 min,47 ℃退火1 min,72 ℃ 延伸30 s,9个循环;再经95 ℃变性1 min, 48 ℃退火1 min,72 ℃延伸30 s,25个循环;72 ℃延伸10 min。然后再进行套式PCR扩增反应,套式PCR扩增反应体系同上,PCR扩增反应程序: 95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃退火30 s,28个循环;72 ℃延伸10 min。
1.2.6 iss基因鉴定 实验室常规方法纯化PCR产物,并进行序列测定。
1.2.7 血清抗性检测 细菌培养至对数期,OD600 nm=0.5,相应于10个细菌数/mL;于0.06 mmol/L NaCl中洗3次,重悬于0.9%NaCl至106个活菌数/mL;将细菌悬液与鸡血清相混合,使血清终浓度为80%;混合物于37 ℃温育,分别于0、2 h取样,用盐溶液稀释后涂板,37 ℃培养18 h,计活菌数。计算菌株2 h时活菌数与0 h时活菌数的对数差,判定菌株血清抗性强弱。
2 结果与分析
2.1 细菌生化鉴定结果
在伊红美蓝琼脂上形成紫黑色带金属光泽的菌落;在麦康凯琼脂上形成圆形、中等大小均一,表面光滑湿润中央轻微隆起、桃红色菌落;在营养琼脂上37 ℃培养24~48 h后,形成中等大小、圆形微凸起、表面光滑湿润、边缘整齐、半透明灰白色菌落;在SS琼脂上生长较差,呈粉红色。在肉汤中培养18~24 h,呈均匀混浊,管底有灰白色黏性沉淀。革兰氏染色可见两端钝圆、多数散在排列、革兰氏阴性短杆菌。葡萄糖、麦芽糖、乳糖、木糖、甘露醇发酵试验均产酸产气;MP、吲哚试验,淀粉试验、触酶试验、动力试验呈阳性;枸橼酸盐试验、尿酶试验、VP、蔗糖发酵试验呈阴性;三糖铁试验符合大肠杆菌特征,无H2S产生。
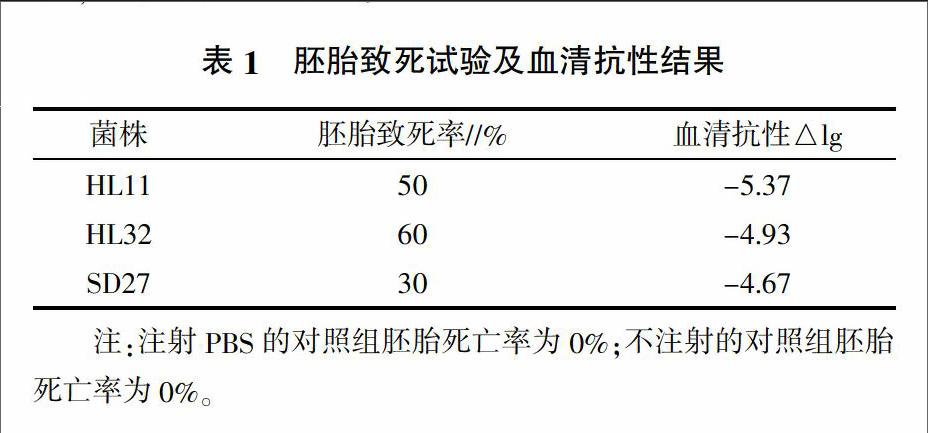
2.2 胚胎致死及血清抗性鉴定结果
鸡胚接种细菌后,各试验组在观察期内均有死亡,而对照组无死亡。菌株在终浓度为80%的含补体鸡血清中温育,2 h与0 h的活菌对数差为-5.37至-4.67,3株菌株为致病性大肠杆菌及补体敏感菌株,具体结果见表1。
2.3 iss基因序列鑒定结果
套式PCR特异性扩增产物大小为309 bp的核苷酸序列,如图1所示。3条序列由上至下分别为HL11、HL32、SD27菌株iss基因核苷酸序列。iss基因核酸序列用DNAStar软件进行比对,与参考序列比较,HL11的同源性为99.7%,HL32的同源性为99.4%,SD27的同源性为99.0%。3条序列预测编码Iss蛋白的氨基酸序列,HL11第35位由丙氨酸变为缬氨酸;HL32的82位亮氨酸变为苯丙氨酸、第88位苯丙氨酸变为亮氨酸;SD27氨基酸序列与参考序列一致。
3 小结与讨论
鸡大肠杆菌HL11、HL32、SD27鸡胚致死率分别为50%、60%、30%,鸡胚致死率低于15%判为无致病性/低致病性[9],因此3株菌株均判断为致病性菌株。但其血清抗性试验中,2 h与0 h的活菌对数差均低于-2.12[11],判定为血清敏感菌株。iss基因序列分析结果表明,HL11、HL32、SD27菌株iss基因序列与禽大肠杆菌iss基因参考序列同源性达99.0%~99.7%,个别位点存在核苷酸差异。HL11、HL32、SD27菌株为致病性菌株,血清补体敏感,且iss基因在核苷酸序列上与已知强毒株存在差异。3株菌株在血清抗性、致病性方面与参考序列菌株O2的差异,是否与iss基因的变异有关还需要更多菌株的iss基因检测进一步探讨。
正常机体具有抗病原微生物侵袭的能力。致病性大肠杆菌要发挥其致病作用,必须首先突破机体的天然屏障,即首先在局部吸附并定居繁殖,进而侵入体内,因此大多数研究基于大肠杆菌菌毛的研究。但细菌定居后不断增殖形成集落(局部增殖),在条件适合时侵入机体组织,并进入血流。大肠杆菌从肺泡毛细血管进入血循环,引起菌血症;在全身组织内增殖,当机体抵抗力降低时,大肠杆菌大量繁殖,引起败血症。补体在机体血液中发挥杀菌作用,细菌的补体抗性与毒力高度相关,是重要的致病因素[8,9]。对iss基因序列及基因拷贝水平的进一步研究可能揭示大肠埃希菌iss基因在致病力及血清补体抗性方面的作用。
参考文献:
[1] TIVENDALE K A,NOORMOHAMMADI A H,ALLEN J L,et al.The conserved portion of the putative virulence region contributes to virulence of avian pathogenic Escherichia coli[J].Microbiology,2009,155(2):450-460.
[2] OZAWA M,HARADA K,KOJIMA A,et al.Antimicrobial susceptibilities,serogroups,and molecular characterization of avian pathogenic Escherichia coli isolates in Japan[J].Avian Dis,2008, 52(3):392-397.
[3] SKYBERG J A,JOHNSON T J,JOHNSON J R,et al.Acquisition of avian pathogenic Escherichia coli plasmids by a commensal E. coli isolate enhances its abilities to kill chicken embryos,grow in uuman urine, and colonize the murine kidney[J].Infection and Immunity,2006,74(11):6287-6292.
[4] 樊 琛,王亞君,李一经. fimI基因与鸡大肠杆菌毒力相关性的测定[J].中国预防兽医学报,2006,28(1):70-72.
[5] JOHNSON T J,WANNEMUEHLER Y,DOETKOTT C,et al.Identification of minimal predictors of avian pathogenic Escherichia coli virulence for use as a rapid diagnostic tool[J].J Clin Microbiol,2008,46(12):3987-3996.
[6] LEFEBVRE B,GATTUSO M,MOISAN H,et al. Genotype comparison of sorbitol-negative Escherichia coli isolates from healthy broiler chickens from different commercial farms[J]. Poult Sci,2009,88(7):1474-1484.
[7] OGUTTU J W,VEARY C M,PICARD J A.Antimicrobial drug resistance of Escherichia coli isolated from poultry abattoir workers at risk and broilers on antimicrobials[J].J S Afr Vet Assoc,2008,79(4):161-166.
[8] CHUBA P J,LEON M A,BANERJEE A,et al. Cloning and DNA sequence of plasmid determinant iss,coding for increased serum survival and surface exclusion,which has homology with lambda DNA[J].Mol Gen Genet,1989,216(2-3):287-292.
[9] JOHNSON T J,GIDDINGS C W,HORNE S M,et al.Location of increased serum survival gene and selected virulence traits on a conjugative R plasmid in an avian Escherichia coli isolate[J].Avian Dis,2002,46(2):342-352.
[10] JOHNSON T J,WANNEMUEHLER Y M,NOLAN L K. Evolution of the iss gene in Escherichia coli[J].Appl Environ Microbiol,2008,74(8):2360-2369.
[11] 李贵萧,朱宗涛,康燕青,等.鸡大肠杆菌的血清抗性与致病性检验[J].江苏农业科学,2015,43(11):301-303.

