植物脂肪酸合成及其在基础抗性和生物固氮中的作用研究进展
徐瑞新++王洁++任国勇++卢一鹏++王昊++鲁玲++廖婷婷++朱凌清++黄磊++王俊
摘要:综述了植物脂肪酸合成、酰基载体蛋白在脂肪酸合成中的作用、脂肪酸在基础抗性和生物固氮中的作用,旨在为植物遗传育种及脂肪酸合成及功能相关分子机制研究提供参考。
关键词:酰基载体蛋白;脂肪酸合成;基础抗性;根瘤固氮
中图分类号:S184 文献标识码:A 文章编号:0439-8114(2016)22-5729-06
DOI:10.14088/j.cnki.issn0439-8114.2016.22.001
Research Progress on Plant Fatty Acid Synthesis and Its Role
in Basic Resistance and Nodulation
XU Rui-xin1,WANG Jie1,REN Guo-yong1,LU Yi-peng1,WANG Hao1,LU Ling1,
LIAO Ting-ting1,ZHU Lin-qing1,HUANG Lei1,WANG Jun1,2
(1.College of Agriculture, Yangtze University, Jingzhou 434025, Hubei, China;
2. Hubei Collaborative Innovation Center for Grain Industry, Jingzhou 434025, Hubei, China)
Abstract: This article reviewed recent progresses on fatty acid synthesis process, role of acyl carrier protein in fatty acid synthesis, role of fatty acid in basic resistance and nodulation, and aimed to provide reference for plant genetic breeding and molecular mechanism of fatty acid synthesis and function.
Key words: acyl carrier protein; fatty acid synthesis; basic resistance; nodule nitrogen fixation
脂類包括一大类天然分子,包括脂肪、蜡质、固醇、脂溶性维生素(如维生素A、维生素D、维生素E和维生素K)、单甘酯、双甘酯、甘油三酯、磷脂等。脂类在植物生长发育过程中起重要作用,主要生理功能包括能量贮藏、细胞膜结构成分、信号分子等[1,2]。脂肪酸是脂类物质的重要组成部分,其合成过程包含一系列酶学反应,是脂肪合成及调控的关键。酰基载体蛋白(Acyl carrier protein,ACP)是一类小分子酸性蛋白,广泛存在于所有的生物体当中,在脂类(lipid)合成、聚酮化合物(polyketide)合成、非核糖体肽(Non-ribosomal peptide)合成中扮演重要角色,负责传递酰基中间体。酰基载体蛋白(ACP)参与了上述三类物质的合成,但植物当中ACP主要参与了脂肪酸的合成。
脂肪酸在生物体内的主要功能为能量贮存,其氧化(α,β,ω等)为生物体提供大量乙酰辅酶A,作为中间产物通过三羧酸循环为机体提供必须能量。除此之外,脂肪酸还作为生物膜重要组成部分和信号分子参与了很多生物学过程,如植物基础防御和生物固氮等。
本研究对植物脂肪酸合成过程、酰基载体蛋白在脂肪酸合成中的作用、脂肪酸与植物防御、生物固氮的关系等方面内容进行了综述,并对今后植物脂肪酸参与基础抗性及根瘤固氮相关研究进行了展望。
1 植物脂肪酸合成过程
1.1 脂肪酸合成酶系统的分类
脂肪酸合成酶(FAS)可以分为两类:类型Ⅰ和类型Ⅱ(表1)。两种类型的主要区别在于编码脂肪酸合成的基因和蛋白的组织结构,在类型Ⅱ中,蛋白均为相互独立的多肽,均编码自一系列独立的基因[3]。该系统多数存在于细菌和专门的真核细胞器,如植物中的质体和线粒体中。相反,类型Ⅰ脂肪酸合成酶系统则是一个大的多酶复合体,由一条或两条多肽链组成,包含了所有脂肪酸合成所需的蛋白[4]。类型Ⅰ脂肪酸合成酶系统可以进一步被细分为两个亚组,类型Ⅰa和类型Ⅰb。类型Ⅰa存在于真菌及少数细菌物种中,由α6β6或者α6多聚体蛋白组成。类型Ⅰb存在于哺乳动物中,由α2二聚体组成,每一个单体均含有脂肪酸合成的所有蛋白[5]。
1.2 从头起始合成脂肪酸
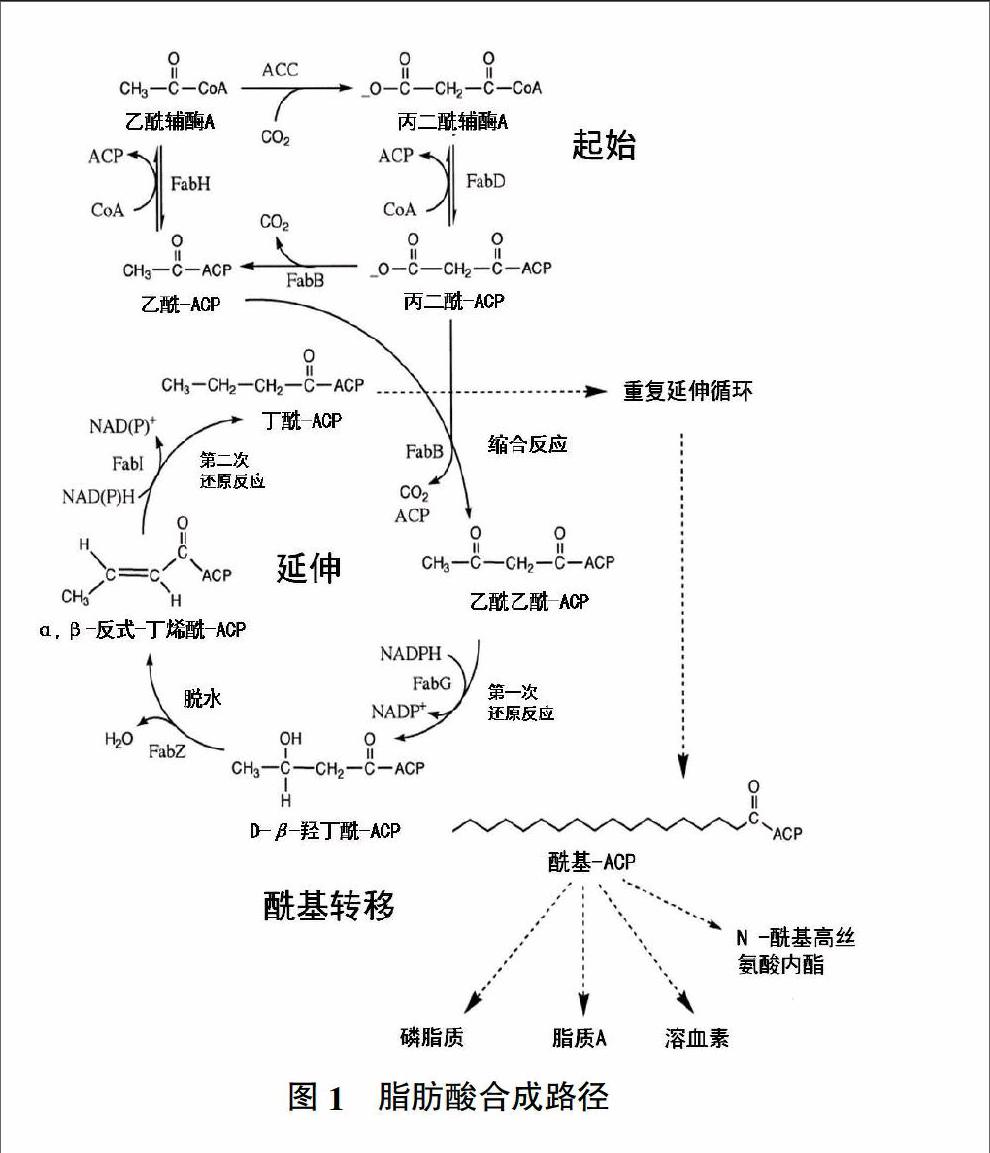
从头起始合成脂肪酸通过一系列保守的反应来实现,虽然不同生物体的脂肪酸合成系统结构上区别很大,但是每一个独立的酶学反应步骤本质上都是一样的。在接受酰基链之前,ACP必须先经过ACP合成酶的活化,该步骤将磷酸泛酰巯基乙胺基团从辅酶A(CoA)上转移到ACP中保守的天冬氨酸-丝氨酸-亮氨酸基序(DSL motif)的丝氨酸残基上[6]。磷酸泛酰巯基乙胺基团一端与ACP结合,另一端的-SH与酰基结合,形成硫酯键,将酯酰基从一个酶反应转到另一个酶反应。植物酰基载体蛋白由核基因编码,但是在藻类中(Cylindrotheca sp. Strain N1)依靠质体基因编码[7]。
脂肪酸合成起始时,乙酰-CoA在乙酰CoA:ACP转移酶(Acetyl-CoA-ACP-transferase)的作用下生成乙酰合酶,乙酰CoA羧化酶包含4个蛋白,由accABCD编码,同时需要生物素辅因子和ATP共同作用[8]。紧接着乙酰合酶与ACP在丙二酸单酰CoA-ACP转酰酶作用下生成丙+-二酸单酰ACP。随后乙酰合酶与丙二酸单酰ACP在β-酮酰-ACP合酶作用下发生缩合反应,生成乙酰乙酰ACP。接下来乙酰乙酰ACP以NADPH作为还原剂,在β-酮酰-ACP还原酶的作用下被还原成D-α,β-羟丁酰ACP。然后D-α,β-羟丁酰ACP在β-羟酰-ACP脱水酶的催化下脱去一个水分子生成α,β-反式-丁烯酰-ACP。最后α,β-反式-丁烯酰-ACP同样以NADPH作为还原剂,在烯酰-ACP还原酶作用下生成丁酰-ACP。丁酰ACP为第一轮循环的最后产物,随后进入脂肪酸合成的第二轮循环,如此循环往复,每一次循环增加两个碳原子单元,直到碳原子数目达到16或18个为止(图1)[9]。
最近的研究发现了完整ACP(Holo-ACP)被证明具有自酰基化和将其他完整ACP酰基化的功能[10,11]。该功能最初是在PKS系统中被报道,随后在FAS系统中也发现完整ACP具有自酰基化活性[10-13]。但是到目前为止,尚不清楚该活性的生理功能[11]。
1.3 脂肪酸合成后修饰
脂肪酸合成到C16和C18时,软脂酰-ACP和硬脂酰-ACP可以直接被Kornberg-Pricer通路中酰基转移酶催化生成磷脂。软脂酰-ACP和硬脂酰-ACP另外一种可能的命运是被硫酯酶水解,脱脂化的脂肪酸可以被运输出质体,在内质网中进行进一步的修饰,或者参与位于质体外空间的复杂的脂类合成。在质体外的修饰通常被称作真核途径(eukaryotic pathway),而在质体内进行的被称为原核途径(prokaryotic pathway)。在绝大多数高等植物中,磷脂酰甘油是原核途径的惟一产物,其他的类囊体脂质则由真核途径完成。但在一些植物,如菠菜和拟南芥中,类囊体脂质则同时由原核和真核途径完成[14]。
根据双键的个数,不饱和脂肪酸可被分为单不饱和脂肪酸和多不饱和脂肪酸。根据双键的位置及其功能,不饱和脂肪酸又可以被分为ω-3和ω-6系列。脂肪酸中双键的引入依赖于去饱和酶的活性。在植物中,去饱和酶通过有氧机制完成,氧被4个H+还原,其中两个来自于脂肪酸底物,另外两个来自于还原剂。
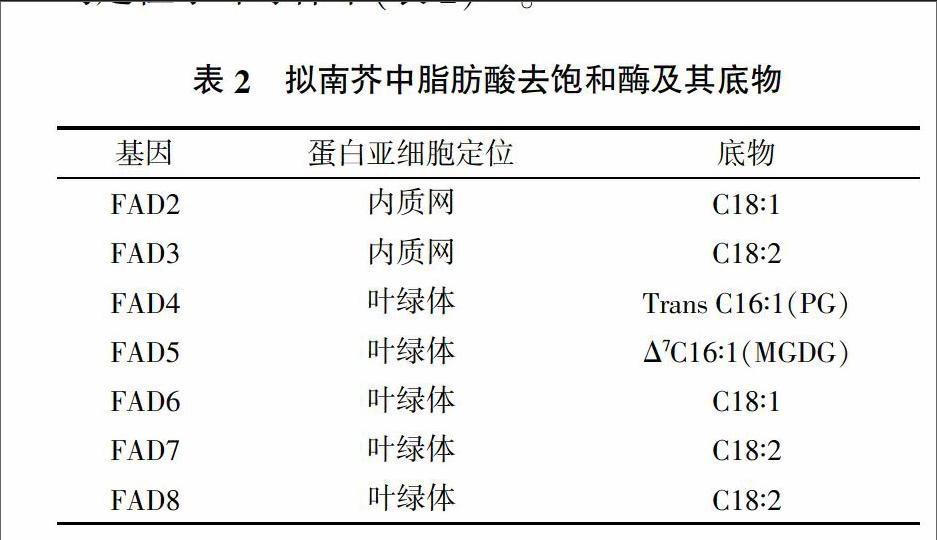
编码去饱和酶的基因为FAD(Fatty Acid Desaturase)或者fad(表2)。脂肪酸去饱和酶分为两大类:一类负责脂肪酸形成甘油脂之前引入第一个双键,另一类负责在形成甘油脂之后对脂肪酸进一步去饱和。前者为18:0-ACP去饱和酶,为可溶性酶。后者包括7个去饱和酶,分别是FAD2、FAD3、FAD4、FAD5、FAD6、FAD7和FAD8,均为膜整合蛋白。其中,FAD2和FAD3定位于内质网中,余下的均定位于叶绿体中(表2)[15]。
2 酰基载体蛋白
2.1 植物ACP同工酶的分化
通常,在多细胞植物中存在多个不同ACP同工酶。例如在单子叶植物燕麦(Arena sativa)和大麦(Hordeum vulgare)中,双子叶植物拟南芥(Arabidopsis thaliana)、萼距花属Wrightii(Cuphea wrightii)、甘蓝型油菜(Brassica napus)、菠菜(Spinacia oleraceae L)、大豆(Glycine max)中,低等维管植物包括石松卷柏(Selaginella krausseriana),裸子植物麻黄(Ephedra sp.)、双子铁(Dioon edule),蕨类植物(Davallia feejensis)、萍属(Marsilea sp.)中,以及现存最原始的维管植物松叶蕨(Psilotum nudum)中。甚至包括非维管植物,地钱(Lunularia sp.;Marchantia sp.)和苔藓(Polytrichum sp.)类也都存在多个ACP同工酶成员。相反,在单细胞植物中,如莱茵衣藻(Chlamydomonas reinhardtii)、杜氏藻(Dunaliella tertiolecta)、集胞藻属(Synechocystis strain 6803)等,只有一个ACP同工酶成员[16]。由此可见,植物中可能ACP同工酶的数目与组织复杂度有关。而在细菌中ACP基因数目差异较大,在E.coli中只有一个ACP,而在稍复杂的根瘤菌中,则存在多个ACP[17]。
所有的高等植物中,均具有多个ACP同工酶[18]。到目前为止,在拟南芥中共发现了3个ACP定位于线粒体和5个ACP定位于质体的ACP[19]。类似的情况也出现在大豆(Glycine max)[20,21]、大麦(Hordeumvulgare)[22,23]、蓖麻castor (Ricinuscommunis)、雪茄花(Cuphea lanceolata)[24]和油菜(Brassica napus)[25]中。但是不同ACP表达模式差别很大,呈现组织特异性或者组成型表达模式[20]。在菠菜(Spinach)中,ACPI存在于深色叶片当中,而ACPII仅能在菠菜种子和根中被检测到[20]。除此之外,不同的ACP对环境改变的反应也不一样。例如,拟南芥ACP4受光誘导,而ACP2和ACP3均对光不敏感[18]。于是人们提出假设:不同组织或物种中脂肪酸合成复合体亲睐不同的ACP,该假设得到越来越多的证据的支持。将来自雪茄花的ACP-1或者ACP-2加入到脂肪酸合成提取物中,导致中短链脂肪酸与长链脂肪酸的比值增加。而在油菜脂肪酸合成体外实验中,仅有ACP-2能提高中短链脂肪酸与长链脂肪酸的比值[26]。第一个体内实验的证据来自Branen的报道,在拟南芥叶片中过表达主要存在于种子中的ACP-1能显著提高叶片18∶3和降低16∶3的脂肪酸含量。
2.2 植物ACP的亚细胞区隔
在植物当中,ACP被定位于质体和线粒体。最初,在菠菜叶片原生质体中,ACP被发现定位于叶绿体中[27]。1986年,在粗糙脉孢菌(Neurospora crassa,又称红面包菌)线粒体中分离出一种与E.coli中ACP具有较高相似度的蛋白[28],并被证实为ACP[29]。随后,在土豆、豌豆叶片和酵母线粒体中也发现ACP的存在[30]。研究发现,绝大部分脂肪酸(C16∶0和C18∶0)合成发生在叶绿体中,只有少量有限的脂肪酸合成发生在线粒体中[31,32]。线粒体中主要合成辛酰-ACP、十六酰-ACP和十八酰-ACP,而辛酰-ACP主要用于合成硫辛酸(Lipoic acid)[33]。在拟南芥中,有5个位于叶绿体的ACP和3个位于线粒体的ACP[19]。
3 脂肪酸与植物防御
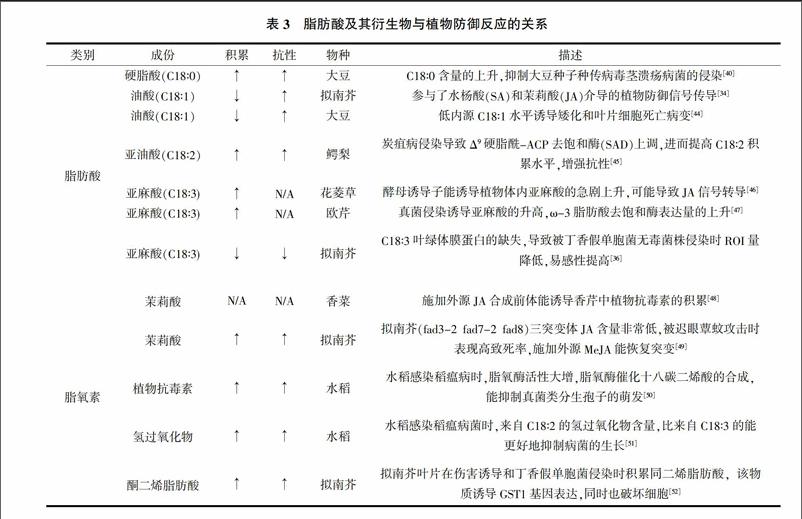
脂肪酸是所有生物中重要的能量貯存形式,也是膜脂的重要组成部分。传统上,脂肪酸在植物防御中的作用是以一种被动方式进行的,扮演的角色是表皮组分或者植物激素(茉莉酸)的生物合成前体。随着研究的深入,发现越来越多的脂肪酸或者其降解产物直接诱导了各种植物防御反应(表1)。研究表明,脂肪酸及其衍生物对植物基础免疫非常重要。C16脂肪酸水平影响植物对真菌和细菌的基础抗性。C18∶1含量的降低能提高植物对病虫害的抗性。据报道,拟南芥质体中C18∶1水平受甘油-3-磷酸酰基化调控,甘油三磷酸与C18∶1之间的平衡对水杨酸和茉莉酸介导的信号通路至关重要[34]。同时,C18∶1水平的降低还能通过诱导多种不同R基因,从而表现对活体营养病原体的广谱抗性[35]。C18∶2和C18∶3对于真菌的基础抗性非常重要。拟南芥fad7fad8突变体中,缺乏三烯脂肪酸(C18∶3),当植株被丁香假单胞菌无毒菌株侵染时,活性氧中间体(ROI)生成量降低,从而提高了对真菌的易感性[36]。脂肪酸代谢突变体增强细胞表皮渗透性,导致对细菌的易感性提高。但是对真菌侵染时的反应不一,对某些真菌表现出抗性提高,而对另一些真菌则表现易感性上升,这些结果暗示了存在另一条活跃但尚未被了解的植物表皮抗性信号通路。脂氧素(Oxylipin)是脂肪酸分解产物,参与了植物防御反应。据报道,茉莉酸、茉莉酸甲酯、植物抗毒素、C18∶2氢过氧化物、酮二烯脂肪酸等均参与了植物的防御反应(表3)。
4 脂肪酸与根瘤固氮
豆科作物结瘤固氮是一个复杂的过程,既包含了豆科植物对根瘤菌的抗性,也包含了根瘤菌突破植物抗性最终形成共生的过程。据报道,为了满足根瘤生长的需要,根瘤形成过程中膜的生物合成提高了35倍[37]。而生物膜主要是由蛋白、糖类和磷脂双分子层组成。植物通过脂肪酸的合成来满足膜生物合成的需要。研究表明,在大豆根瘤菌侵染过程中有6种脂肪酸含量发生显著变化[38]。根毛中十八碳烯酸的含量在根瘤菌侵染后12~48小时内显著上调。α-桐酸、α-亚麻酸、二十四烷酸在根瘤菌侵染后48小时时积累上调。这些脂肪酸既包括饱和脂肪酸,也包括不饱和脂肪酸,但其影响机制还不明确。
亚麻酸是植物膜上最丰富的脂肪酸非饱和脂肪酸,而膜上脂肪酸的释放影响膜的流动性,在植物对生物和非生物胁迫的抗性中起到一定的作用[39]。与此同时,亚麻酸在根瘤菌侵染后的大量积累,也可能参与改变膜流动性以助于细菌侵染。而游离α-亚麻酸具有抗真菌的活性。马铃薯叶片中游离α-亚麻酸含量受丁香假单胞菌侵染时上调[40]。在欧芹当中,当用真菌诱导剂诱导时,游离α-亚麻酸含量提高[41]。这些现象都表明游离α-亚麻酸的积累可能是植物抗性反应的一个信号。到目前为止,α-亚麻酸在结瘤过程中究竟是行使促进还是抑制作用还不得而知。除此之外,油酸作为十八碳烯酸的一种,在蒺藜苜蓿根组织遭到菌根真菌的侵染时显著积累[42,43]。研究发现,通过发根系统瞬时下调大豆GmACP在根中的表达水平,能显著降低大豆根中饱和脂肪酸:软脂酸(C16∶0)和硬脂酸(C18∶0)含量,同时结瘤效率受到显著影响。该研究首次在实验中证实脂肪酸代谢在根瘤固氮中的作用,但其具体机制尚不清楚,有待进一步深入研究。
5 结论
综上所述,脂肪酸在植物生长发育和基础抗性中具有重要作用,尤其参与了生物结瘤固氮相关过程。然而,抗性防御(对抗)和生物结瘤固氮(共生)在某种程度上是“对立”的,生物体如何通过脂肪酸种类和含量差异来协调和转换这种“对立”关系,是今后研究的重要方向。
参考文献:
[1] FAHY E,SUBRAMANIAM S, MURPHY R C, et al. Update of the LIPID MAPS comprehensive classification system for lipids[J].Journal of Lipid Research,2009,50 Suppl:S9-S14.
[2] SUBRAMANIAM S,FAHY E,GUPTA S,et al. Bioinformatics and systems biology of the lipidome[J].Chemical Reviews,2011, 111(10):6452-6490.
[3] WHITE S W,ZHENG J,ZHANG Y M,et al.The structural biology of type II fatty acid biosynthesis[J].Annual Review of Biochemistry,2005,74:791-831.
[4] LEIBUNDGUT M,MAIER T,JENNI S,et al. The multienzyme architecture of eukaryotic fattyacid synthases[J].Current Opinion in Structural Biology,2008,18(6):714-725.
[5] SCHWEIZER E,HOFMANN J.Microbial type I fatty acid synthases(FAS):Major players in a network of cellular FAS systems[J].Microbiology and Molecular Biology Reviews,2004,68(3):501-517.
[6] THOMAS J,CRONAN J E.The enigmatic acyl carrier protein phosphodiesterase of Escherichia coli:Genetic and enzymological characterization[J].The Journal of Biological Chemistry,2005, 280(41):34675-34683.
[7] HWANG S R,TABITA F R.Acyl carrier protein-derived sequence encoded by the chloroplast genome in the marine diatom Cylindrotheca sp. strain N1[J]. The Journal of Biological Chemistry,1991,266(21):13492-13494.
[8] JR CJ, WALDROP G L. Multi-subunit acetyl-CoA carboxylases[J]. Progress in Lipid Research,2002,41(5):407-435.
[9] GEIGER O, L?譫PEZ-LARA I M. Rhizobial acyl carrier proteins and their roles in the formationof bacterial cell-surface components that are required for the development of nitrogen-fixing root nodules on legume hosts[J].FEMS Microbiology Letters,2002,208(2):153-162.
[10] MISRA A, SHARMA S K, SUROLIA N, et al. Self-acylation properties of type II fatty acid biosynthesis acyl carrier protein[J]. Chemistry & Biology,2007,14(7):775-783.
[11] MISRA A, SUROLIA N, SUROLIA A. Catalysis and mechanism of malonyl transferase activity in type II fatty acid biosynthesis acyl carrier proteins[J].Molecular Bio Systems,2009,5(6):651-659.
[12] ARTHUR C J, SZAFRANSKA A, EVANS S E, et al. Self-malonylation is an intrinsic property of a chemically synthesized type II polyketide synthase acyl carrier protein[J].Biochemistry,2005,44(46):15414-15421.
[13] ARTHUR C J,SZAFRANSKA A E,LONG J,et al. The malonyl transferase activity of type II polyketide synthase acyl carrier proteins[J].Chemistry & Biology,2006,13(6):587-596.
[14] WALLIS J G,BROWSE J.Mutants of Arabidopsis reveal many roles for membrane lipids[J].Progress in Lipid Research,2002,41(3):254-278.
[15] OHLROGGE J, BROWSE J. Lipid biosynthesis[J].The Plant Cell,1995,7(7):957-970.
[16] BATTEY J F, OHLROGGE J B. Evolutionary and tissue-specific control of expression of multipleacyl-carrier protein isoforms in plants and bacteria[J].Planta,1990,180(3):352-360.
[17] GEIGER O,L?魷PEZ-LARA I M. Rhizobial acyl carrier proteins and their roles in the formationof bacterial cell-surface components that are required for the development of nitrogen-fixing root nodules on legume hosts[J].FEMS Microbiology Letters,2002,208(2):153-162.
[18] BONAVENTURE G, OHLROGGE J B. Differential regulation of mRNA levels of acyl carrier protein isoforms in Arabidopsis[J].Plant Physiology,2002,128(1):223-235.
[19] MURPHY D J. Plant lipids: Biology, utilisation and manipulation[M]. Oxford:Blackwell Publishing,2005.
[20] OHLROGGE J B,KUO T M. Plants have isoforms for acyl carrier protein that are expressed differently in different tissues[J].Journal of Biological Chemistry,1985,260(13):8032-8037.
[21] HOEJ P B,SVENDSEN I.Barley chloroplasts contain two acyl carrier proteins coded for by different genes[J].Carlsberg Research Communications,1984,49(4):483-492.
[22] HANSEN L,KAUPPINEN S.Barley acyl carrier protein II:nucleotide sequence of cDNA clones and chromosomal location of the Acl2 gene[J].Plant Physiology,1991,91:472-474.
[23] KOPKA J,ROBERS M,SCHUCH R,et al.Acyl carrier proteins from developing seeds of Cuphea lanceolata Ait[J].Planta,1993,191(1):102-111.
[24] SAFFORD R, WINDUST J H, LUCAS C, et al. Plastid-localised seed acyl-carrier protein of Brassica napus is encoded by a distinct, nuclear multigene family[J].European Journal of Biochemistry,1988,174(2):287-295.
[25] SCH?譈TT B S,BRUMMEL M,SCHUCH R,et al. The role of acyl carrier protein isoforms from Cuphea lanceolata seeds in the de-novo biosynthesis of medium-chain fatty acids[J]. Planta,1998,205(2):263-268.
[26] OHLROGGE J B,KUHN D N,STUMPF P K. Subcellular localization of acyl carrier protein in leaf protoplasts of Spinacia oleracea[J].Proceedings of the National Academy of Sciences, 1979,76(3):1194-1198.
[27] LAKIN-THOMAS P L,BRODY S.Neurospora crassa mitochondria contains two forms of a 4'-phosphopantetheine-modified protein[J].The Journal of Biological Chemistry,1986,261(11):4785-4788.
[28] BRODY S,MIKOLAJCZYK S.Neurospora mitochondria contain an acyl-carrier protein[J].European Journal of Biochemistry,1988,173(2):353-359.
[29] CHUMAN L, BRODY S. Acyl carrier protein is present in the mitochondria of plants and eucaryotic micro-organisms[J]. European Journal of Biochemistry,1989,184(3):643-649.
[30] WADA H, SHINTANI D, OHLROGGE J. Why do mitochondria synthesize fatty acids Evidence for involvement in lipoic acid production[J].Proceedings of the National Academy of Sciences,1997,94:1591-1596.
[31] HILTUNEN J K, SCHONAUER M S, AUTIO K J, et al. Mitochondrial fatty acid synthesis Type II: More than just fatty acids[J].Journal of Biological Chemistry,2009,284(14): 9011-9015.
[32] GUEGUEN V,MACHEREL D,JAQUINOD M,et al.Fatty acid and lipoic acid biosynthesis in higher plant mitochondria[J].The Journal of Biological Chemistry,2000,275(7):5016-5025.
[33] KACHROO A,VENUGOPAL S C, LAPCHYK L, et al. Oleic acid levels regulated by glycerolipid metabolism modulate defense gene expression in Arabidopsis[J]. Proceedings of the National Academy of Sciences,2004,101(14):5152-5157.
[34] CHANDRA-SHEKARA A C,VENUGOPAL S C,BARMAN S R, et al. Plastidial fatty acid levels regulate resistance gene-dependent defense signaling in Arabidopsis[J].Proceedings of the National Academy of Sciences,2007,104(17):7277-7282.
[35] YAENO T,MATSUDA O, IBA K. Role of chloroplast trienoic fatty acids in plant disease defense responses[J]. The Plant Journal,2004,40(6):931-941.
[36] ROTH L,STACEY G. Cytoplasmic membrane systems involved in bacterium release into soybean nodule cells as studied with two Bradyrhizobium japonicum mutant strains[J]. European Journal of Cell Biology,1989,49(1):24-32.
[37] BRECHENMACHER L,LEI Z, LIBAULT M, et al. Soybean metabolites regulated in root hairs inresponse to the symbiotic bacterium Bradyrhizobium japonicum[J].Plant Physiology,2010, 153(4):1808-1822.
[38] UPCHURCH R G. Fatty acid unsaturation, mobilization, and regulation in the response of plants to stress[J].Biotechnology Letters,2008,30(6):967-977.
[39] GOBEL C,FEUSSNER I,HAMBERG M,et al. Oxylipin profiling in pathogen-infected potato leaves[J].Biochim Biophys Acta,2002,1584(1):55-64.
[40] KIRSCH C,TAKAMIYA-WIK M, REINOLD S, et al. Rapid, transient, and highly localized induction of plastidial omega-3 fatty acid desaturase mRNA at fungal infection sites in Petroselinum crispum[J].Proceedings of the National Academy of Sciences,1997,94(5):2079-2084.
[41] STUMPE M,CARSJENS J G,STENZEL I,et al.Lipid metabolism in arbuscular mycorrhizal roots of Medicago truncatula[J].Phytochemistry,2005,66(7):781-791.
[42] SCHLIEMANN W,AMMER C, STRACK D. Metabolite profiling of mycorrhizal roots of Medicago truncatula[J].Phytochemistry,2008,69(1):112-146.
[43] XUE H Q, UPCHURCH R G, KWANYUEN P. Ergosterol as a Quantifiable biomass marker for Diaporthe haseolorum andCercospora kikuchi[J].Plant Disease,2006,90(11):1395-1398.
[44] KACHROO A, FU D Q, HAVENS W, et al. An oleic acid-mediated pathway induces constitutive defense signaling and enhanced resistance to multiple pathogens in soybean[J]. Molecular Plant-Microbe Interaction,2008,21(5):564-575.
[45] MADI L,WANG X,KOBILER I,et al. Stress on avocado fruits regulates Δ9-stearoyl ACPdesaturase expression, fatty acid composition,antifungal diene level and resistance to Colletotrichum gleosporiodes attack[J].Physiological and Molecular Plant Pathology,2003,62:277-283.
[46] MARTIN J M,WILHELM B,EVA S,et al. Signaling in the elicitation process is mediated through the octadecanoid pathway leading to jasmonic acid[J]. Proceedings of the National Academy of Sciences,1993,90:7490-7494.
[47] CHRISTOPH K,MONICA T,SUSANNE R,et al. Rapid, transient, and highly localized induction of plastidial ω-3 fatty acid desaturase mRNA at fungal infection sites in Petroselinum crispum[J]. Proceedings of the National Academy of Sciences,1997,94:2079-2084.
[48] DITTRICH H, KUTCHAN T M, ZENK M H. The jasmonate precursor, 12-oxo-phytodienoic acid, induces phytoalexin synthesis in Petroselinum crispum cell cultures[J]. FEBS Letters, 1992,309(1):33-36.
[49] MICHELE M,ROBERT A C,ERIN B,et al. Jasmonate is essential for insect defense in Arabidopsis[J]. Proceedings of the National Academy of Sciences,1997,94:5473-5477.
[50] OHTA H,SHIDA K,PENG Y L,et al.A lipoxygenase pathway is activated in rice after infection with the rice blast fungus Magnaporthe grisea[J].Plant Physiology,1991,97:94-98.
[51] YARA A,YAENO T,MONTILLET J L,et al. Enhancement of disease resistance to Magnaporthe grisea in rice by accumulation of hydroxy linoleic acid[J]. Biochemical biophysical research communications,2008,370(2):344-347.
[52] VOLLENWEIDER S,WEBER H,STOLZ S,et al. Fatty acid ketodienes and fatty acid ketotrienes:Michael addition acceptors that accumulate in wounded and diseased Arabidopsis leaves[J]. The Plant Journal,2000,24(4):467-476.

