发酵工艺条件对黑曲霉产黄曲霉毒素B1降解酶的影响
雷娇,宋宏新,李鹏娟,薛海燕,肖瑜,徐丹,*
(1.陕西科技大学食品与生物工程学院,陕西西安710021;2.宝鸡市食品药品检验检测中心,陕西宝鸡721013)
发酵工艺条件对黑曲霉产黄曲霉毒素B1降解酶的影响
雷娇1,宋宏新1,李鹏娟1,薛海燕1,肖瑜2,徐丹1,*
(1.陕西科技大学食品与生物工程学院,陕西西安710021;2.宝鸡市食品药品检验检测中心,陕西宝鸡721013)
为研究黑曲霉产黄曲霉毒素B1(AFB1)降解酶的影响因素,试验以AFB1降解率作为评价指标,考察不同培养基成分和不同发酵条件对黑曲霉产AFB1降解酶的影响。结果显示,碳源、氮源、金属离子、AFB1类似物等对黑曲霉生长影响不大,但对降解酶合成有显著影响,且该酶是一种诱导酶;发酵温度、时间、初始pH等对降解酶合成也有显著影响,当发酵温度为30℃时AFB1降解率达87.5%,初始pH为7.0时AFB1降解率达89.3%,发酵时间与AFB1降解率呈正相关性,培养4 d时降解率达83.5%。研究结果可为AFB1降解酶的发酵工艺条件优化及工业化生产提供理论指导。
黑曲霉;黄曲霉毒素B1;降解;发酵工艺
黄曲霉毒素B1(AFB1)是由黄曲霉产生的具有强致癌性的次级代谢产物,1993年被世界卫生组织(WHO)定为Ι类致癌物[1-3]。其在粮食作物中的污染最为严重,2011年~2012年,由于奶牛饲料被AFB1污染,使得我国蒙牛、南山等乳制品中AFM1超标,不仅危害公众健康,同时给企业及社会造成巨大的经济损失,成为影响社会稳定的食品安全事件。因此,控制食品中真菌毒素的污染成为一个亟待解决问题。
传统的物理和化学方法在一定程度上能降低AFB1的污染[4-6],但通常这两种方法都存在去毒不完全、易降低食品的营养价值、应用性差等缺点[7-8]。因此,寻找一种安全、高效脱除AFB1的方法就显得尤为重要,而微生物降解AFB1具备上述优势,其代表了真菌毒素防治的新方向[9-10]。Alberts[11-12]发现红串红球菌发酵液对AFB1有降解效果,孵育48h后,降解率达83%,且与AFB1相比,降解产物的致突变性明显减弱;Guan[13]研究发现嗜麦芽窄食单胞菌发酵液经蛋白酶K、SDS和加热处理后,降解效果明显下降,其最适酶解温度为37℃、pH为8,且Mg2+、Cu2+对AFB1降解有激活作用,Zn2+则有抑制作用。
国内学者李冰等[14]从黑曲霉中提取了对AFB1有降解效果的胞外粗提液,其降解率达93.28%;本试验室前期研究发现从酱醅中分离出的黑曲霉具有降解AFB1的作用,且该作用属于胞外酶的酶促降解,为探究发酵条件对黑曲霉产黄曲霉毒素B1降解酶的影响,本试验在前期试验基础上以AFB1降解率及菌体干重作为评价指标,研究培养基成分及发酵条件对黑曲霉产AFB1降解酶的影响,为后期大规模发酵试验提供理论基础。
1材料与方法
1.1材料与试剂
1.1.1菌株
黑曲霉(Aspergillusniger),分离于酱醅中,PDA培养基4℃保存。
1.1.2培养基
马铃薯固体培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 L,自然pH,121℃高压灭菌20min。
马铃薯液体培养基(PDB):马铃薯200 g、葡萄糖20 g、蒸馏水1 L、自然pH、121℃高压灭菌20min。
1.1.3试剂
AFB1标准品:Sigma公司;甲醇(色谱纯)、乙腈(色谱纯):Fisher公司;三氯甲烷(分析纯)、正己烷(分析纯)、三氟乙酸(化学纯):阿拉丁试剂有限公司。
1.1.4仪器与设备
SW-CJ-1D型洁净工作台:苏州净化设备厂;MJ-180B型霉菌培养箱:上海跃进医疗器械厂;Agilent1200高效液相色谱仪:美国安捷伦公司;LDZM-40KCS-Ⅱ立式压力蒸汽灭菌锅:上海申安医疗器械厂;HZQ-F160恒温震荡培养箱:常州诺基仪器有限公司;MD 200氮吹仪:杭州奥盛仪器有限公司。
1.2方法
1.2.1黑曲霉孢子悬浮液的制备
将黑曲霉菌种接种于PDA斜面培养基中,30℃培养7 d,用生理盐水洗脱并收集孢子,调整浓度为105CFU/mL,备用。
1.2.2培养基成分对黑曲霉产AFB1降解酶的影响
1.2.2.1碳源
将PDB中葡萄糖分别用蔗糖、麦芽糖,乳糖代替,添加量为2%,向含有不同碳源的培养基中接种黑曲霉孢子悬浮液(培养基为50mL,接种量为2%),30℃、150 r/min培养72 h后过滤,收集滤液和菌丝体,分别测定菌体干重及AFB1的降解率,分析碳源对黑曲霉产AFB1降解酶的影响。
1.2.2.2氮源
向PDB中分别添加硝酸钠、氯化铵、酵母膏和蛋白胨,添加量为0.2%,并向含有不同氮源的培养基中接种黑曲霉孢子悬浮液(培养基为50 mL,接种量为2%),30℃、150 r/min培养72 h后过滤,收集滤液和菌丝体,分别测定菌体干重及AFB1的降解率,分析氮源对黑曲霉产AFB1降解酶的影响。
1.2.2.3金属离子
向PDB中分别添加Fe3+,Ca2+,Mn2+,Zn2+,添加量为5mmol/L,并向含有不同金属离子的培养基中接种黑曲霉孢子悬浮液(培养基为50mL,接种量为2%),30℃、150 r/min培养72 h后过滤,收集滤液和菌丝体,分别测定菌体干重及AFB1的降解率,分析金属离子对黑曲霉产AFB1降解酶的影响。
1.2.2.4结构类似物
向PDB中分别添加香豆酸和香豆素,添加量为0.05%,并向含有不同结构类似物的培养基中接种黑曲霉孢子悬浮液(培养基为50mL,接种量为2%),30℃、150 r/min培养72 h后过滤,收集滤液和菌丝体,分别测定菌体干重及AFB1的降解率,分析结构类似物对黑曲霉产AFB1降解酶的影响。
1.2.3发酵条件对黑曲霉产AFB1降解酶的影响
1.2.3.1温度
将黑曲霉孢子悬浮液接种于50mLPDB(接种量为2%),分别于20、25、30、35、40℃,150 r/min培养72 h后过滤,收集滤液和菌丝体,分别测定菌体干重及AFB1的降解率,分析温度对黑曲霉产AFB1降解酶的影响。
1.2.3.2 pH值
调节PDB初始pH为4.0、5.0、6.0、7.0、8.0,并向不同初始pH的培养基中接种黑曲霉孢子悬浮液(培养基为50mL,接种量为2%),30℃,150 r/min培养72 h后过滤,收集滤液和菌丝体,分别测定菌体干重及AFB1的降解率,分析pH对黑曲霉产AFB1降解酶的影响。
1.2.3.3培养时间
将黑曲霉孢子悬浮液接种于50mLPDB(接种量为2%),30℃,150 r/min,分别培养1、2、3、4、5、6、7 d后过滤,收集滤液和菌丝体,分别测定菌体干重及AFB1的降解率,分析发酵时间对黑曲霉产AFB1降解酶的影响。
1.2.4测定方法
菌体干重测定先用纱布过滤菌丝体,用无菌水将收集到的菌丝体冲洗两次,80℃下烘干至恒重。降解率的测定采用柱前衍生HPLC-FLD检测方法测定样品中毒素的含量,计算降解率。
2结果与讨论
2.1培养基成分对黑曲霉产AFB1降解酶的影响
2.1.1碳源
菌体生长和代谢产物的积累均需要一定的碳源,尤其是以产酶为目的的发酵过程中,一些碳源物质成分对促进产酶有重要的影响。碳源对菌体干重的影响如图1所示,碳源对黑曲霉产AFB1降解酶的影响如图2所示。
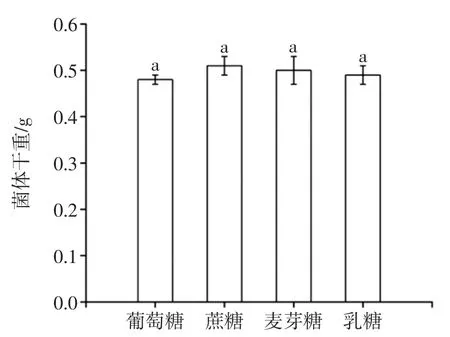
图1 碳源对菌体干重的影响Fig.1 Effectofcarbon sourceson thedryweightof Aspergillusniger
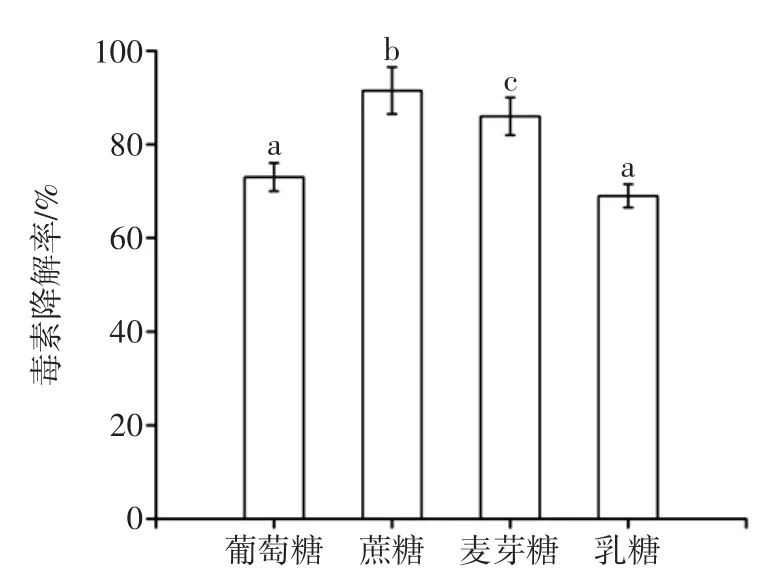
图2 碳源对黑曲霉产AFB1降解酶的影响Fig.2 Effectof carbon sourceson degradation enzymeof AFB1produced by Aspergillusniger
由图1、图2可知不同碳源对黑曲霉生长无显著影响(P>0.05),但对AFB1降解酶的合成影响显著(P<0.05),其中添加蔗糖的效果最好,毒素降解率达91.5%,可能因为黑曲霉分泌的β-呋喃果糖苷酶能分解蔗糖产生葡萄糖和果糖,而果糖更容易被黑曲霉利用产酶[15]。
2.1.2氮源
氮源是微生物细胞生长和代谢的主要营养物质,其功能是为生物细胞合成含氮代谢产物,也是构成酶的主要成分[16]。氮源对菌体干重的影响如图3所示,氮源对黑曲霉产AFB1降解酶的影响如图4所示。
由图3~图4所示,只有酵母膏能促进黑曲霉生长,而当额外添加氮源时能将AFB1降解率从61%提高到73.5%,黑曲霉对氯化铵和酵母膏的利用率较高,且酵母膏中含有的必需氨基酸及B族维生素、核苷酸、微量元素等促进了黑曲霉的新陈代谢和产酶,使得它比其他氮源表现出更好的促进效果。

图3 氮源对菌体干重的影响Fig.3 Effectof nitrogen sourceon the dryweightof Aspergillus niger

图4 氮源对黑曲霉产AFB1降解酶的影响Fig.4 Effectofnitrogen sourceson degradation enzymeof AFB1produced by Aspergillusniger
2.1.3金属离子
金属离子对菌体干重的影响如图5所示,金属离子对黑曲霉产AFB1降解酶的影响如图6所示。
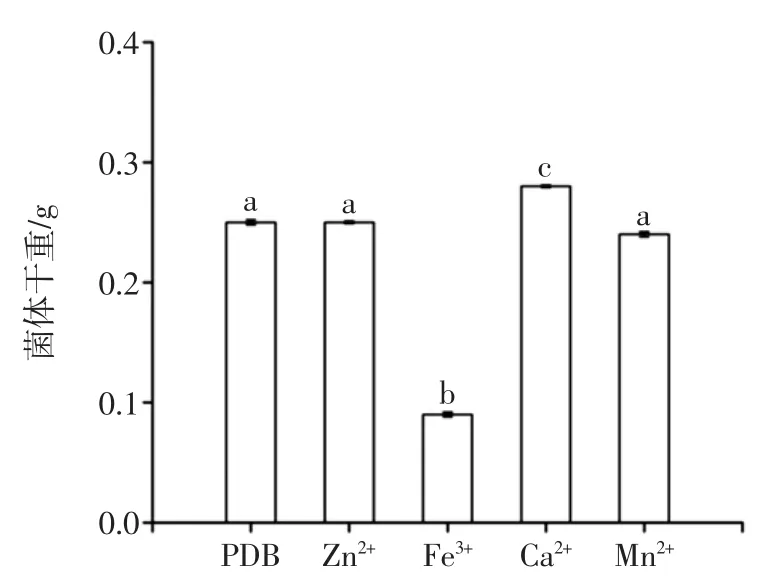
图5 金属离子对菌体干重的影响Fig.5 Effectofmetal ionson the dryweightof Aspergillusniger
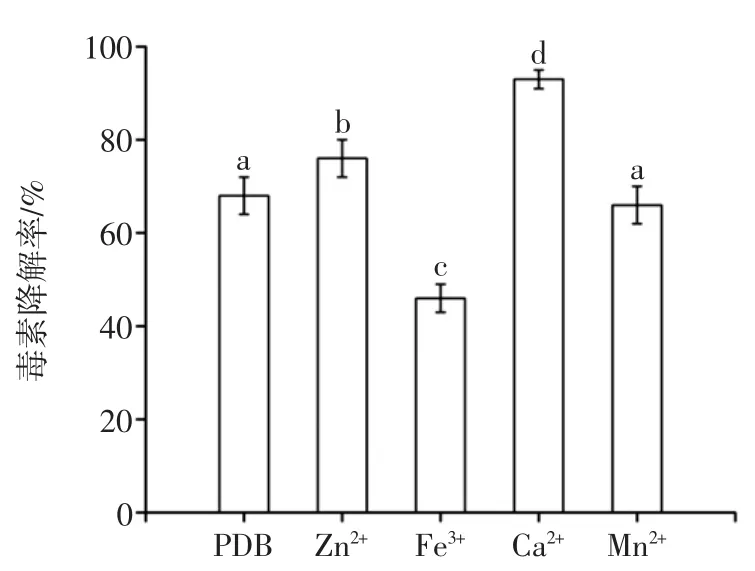
图6 金属离子对黑曲霉产AFB1降解酶的影响Fig.6 Effectofmetal ionson degradation enzym eof AFB1produced by Aspergillusniger
如图5~图6所示,Fe3+能显著抑制黑曲霉生长,进而降低AFB1降解酶的产量,孙启红[17]等研究发现高浓度Fe3+对细菌的生长有明显的抑制作用,推测Fe3+对细菌的抑制作用是通过Fe3+催化羟自由基的形成抑制细菌生长;Zn2+、Ca2+、Mn2+对黑曲霉生长影响不大,但Zn2+、Ca2+对降解酶合成有明显促进作用,将AFB1降解率分别提高至76%、93%,可能由于Zn2+、Ca2+与AFB1降解酶结合,从而提高了酶活。
2.1.4结构类似物
结构类似物对菌体干重的影响如图7所示,结构类似物对黑曲霉产AFB1降解酶的影响如图8所示。
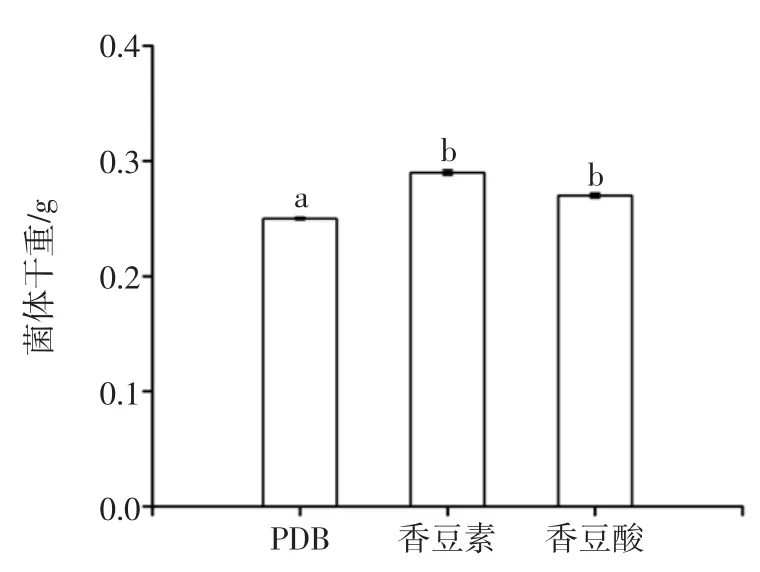
图7 结构类似物对菌体干重的影响Fig.7 Effectof AFB1analogueson thed ry weightof Aspergillusniger
如图7~图8所示,香豆素和香豆酸对黑曲霉生长的促进作用较小,但能显著增强降解酶的合成,尤其添加香豆酸的黑曲霉发酵液降解效果好,降解率达到89.5%,说明该降解酶很可能是一种诱导酶,AFB1的结构类似物作为诱导物诱导酶的合成。
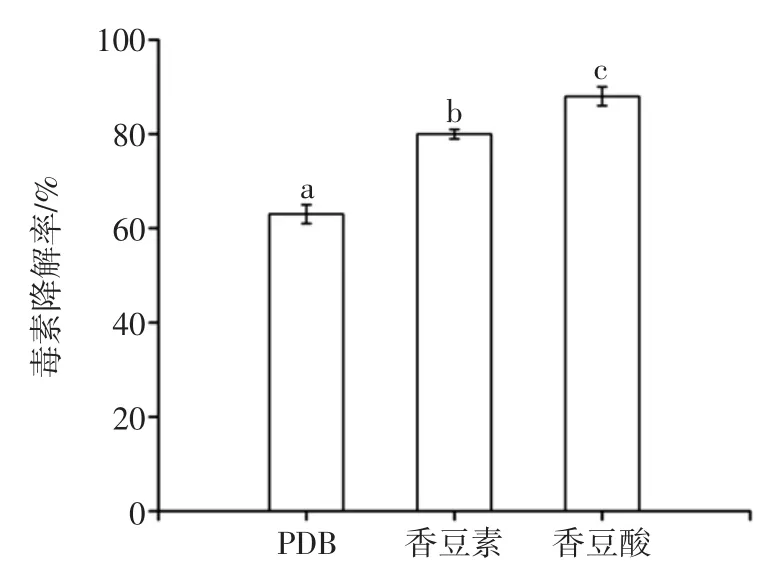
图8 结构类似物对黑曲霉产AFB1降解酶的影响Fig.8 Effectof AFB1analogueson degradation enzymeof AFB1produced by Aspergillusniger
2.2发酵条件对黑曲霉产AFB1降解酶的影响
2.2.1发酵温度
温度对黑曲霉产AFB1降解酶的影响如图9所示。

图9 温度对黑曲霉产AFB1降解酶的影响Fig.9 Effectof tem peratureon degradation enzymeof AFB1produced by Aspergillusniger
如图9所示,在20℃~30℃之间,温度的增加有助于黑曲霉对AFB1的降解,在30℃时毒素降解率达到最大值87.5%,当温度大于40℃后,黑曲霉产AFB1降解酶的能力明显下降,这说明温度对黑曲霉生长有较大的影响,黑曲霉所产酶系的最适温度一般都在30℃左右,如黑曲霉液态发酵生产果胶酶时,当发酵温度控制在30℃时酶活达到最大值[18]。
2.2.2初始pH值
初始pH对黑曲霉产AFB1降解酶的影响如图10所示。
如图10所示,pH在4~7之间时,黑曲霉对AFB1的降解率逐渐增加,在pH 7.0时降解率达到最高值89.3%,当pH大于7后,降解效果逐渐减弱,说明pH值在4~7时有利于黑曲霉生长产酶,从而促进了对AFB1的降解作用。
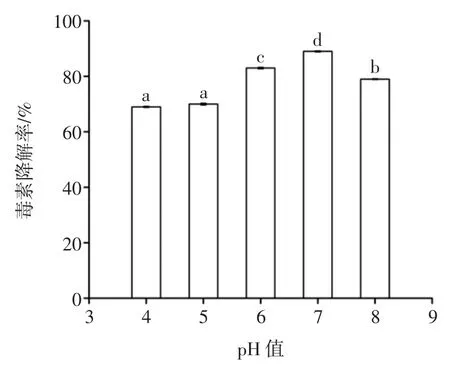
图10 初始pH对黑曲霉产AFB1降解酶的影响Fig.10 Effectof initialpH on degradation enzym eof AFB1produced by Aspergillusniger
2.2.3培养时间
时间对黑曲霉产AFB1降解酶的影响如图11所示。

图11 时间对黑曲霉产AFB1降解酶的影响Fig.11 Effectof tim eon degradation enzymeof AFB1produced by Aspergillusniger
如图11所示,随着时间的延长黑曲霉发酵液降解毒素的能力逐渐增强,在培养第3天到第4天时黑曲霉降解率有显著增加,从57%增加到83.5%,随着培养时间的增加,黑曲霉解毒酶对AFB1的降解率趋于稳定,说明培养到第6天时黑曲霉所产AFB1降解酶达到稳定。
3结论
碳源、氮源、金属离子、AFB1类似物等对黑曲霉生长影响不大,但对降解酶合成有显著影响,且该酶是一种诱导酶;发酵温度、时间、初始pH等对降解酶合成也有显著影响。而微生物在发酵过程中受到的影响因素众多,代谢产物的调控及其复杂,为进一步优化AFB1降解酶的发酵工艺条件,提高发酵产物的产量,还要考虑各因素之间的交叉影响,并利用数学模型预测和优化各影响因素,指导工业化大生产。
[1]Do JH,Choi D K.Aflatoxins:Detection,Toxicity,and Biosynthesis [J].Biotechnologyand Bioprocess Engineering,2007,12(6):585-593
[2]Sheikh A S,Ahmad A,Mohd SH,et al.The Potential Hazards of Aspergillus sp.in Foods and Feeds,and the Role of Biological Treatment A Review[J].Journal ofMicrobiology,2014,52(10):807-818
[3]IARC.Some naturally occurring substances:food items and constituents,heterocyclic aromatic amines and mycotoxins[J].IARC monographson theevaluation of carcinogenic risks tohumans,1993, 56:489-521
[4]Grace D,Mahuku G,Hoffmann V,etal.Internationalagricultural research to reduce food risks:casestudieson aflatoxins[J].Food Security,2015,7(3):569-582
[5]Turcotte A M,Scott PM,Tague B.Analysis of cocoa products for ochratoxin A and aflatoxins[J].Mycotoxin Research,2013,29(3): 193-201
[6]关舒,胡新旭,马秋刚,等.黄曲霉毒素的传统去毒方法和生物降解研究进展[J].饲料工业,2008,29(24):57-59
[7]肖军霞,张岩,黄国清,等.黄曲霉毒素脱除方法研究进展[J].食品安全质量检测学报,2012,3(5):395-399
[8]Xu D,Wang H,Zhang Y,et al.Inhibition of non-toxigenic Aspergillus niger FS10 isolated from Chinese fermented soybean on growth and aflatoxin B1production by Aspergillus flavus[J].Food Control,2013,32(2):359-365
[9]Gao X,Ma Q,Zhao L,etal.Isolation of Bacillus subtilis:screening for aflatoxins B1,M1,and G1 detoxification[J].European Food Research and Technology,2011,232(6):957-962
[10]Farzaneh M,Shi ZQ,Ghassempour A,et al.Aflatoxin B1degradation by BacillussubtilisUTBSP1 isolated from pistachionutsof Iran [J].Food Control,2012,23(1):100-106
[11]Alberts JF,Engelbrecht Y,Steyn PS,etal.Biological degradation ofaflatoxin B1by Rhodococcus erythropolis cultures[J].International Journalof Food Microbiology,2006,109(1/2):121-126
[12]Teniola OD,Addo PA,Brost IM,etal.Degradation ofaflatoxin B1by cell-free extracts of Rhodococcuserythropolis and Mycobacterium fluoranthenivoranssp.nov.DSM44556(T)[J].International Journalof Food Microbiology,2005,105(2):111-117
[13]Guan S,JiC,Zhou T,etal.Aflatoxin B1degradation by Stenotrophomonas maltophilia and other microbes selected using coumarin medium[J].International Journal ofMolecular Sciences,2008,9(8): 1489-1503
[14]李冰,董征英,常维山.黑曲霉对黄曲霉毒素B1的降解与应用研究[J].试验研究,2012(11):6-10
[15]Dorta C,Cruz R,Olivaneto PD,et al.Sugarcanemolassesand yeast powder used in the Fructooligosaccharides production by Aspergillus japonicus-FCL 119T and Aspergillus niger ATCC 20611 [J].Journal of Industrial Microbiology&Biotechnology,2006,33 (12):1003-1009
[16]曾庆华,陈利梅,李德茂.黑曲霉液体发酵产α-半乳糖苷酶发酵条件优化[J].安徽农业科学,2010,38(1):339-341
[17]Sun H Z,HangW C,Lu X,etal.Siderophore production from 27 filamentous fungal strainsand a novel siderophorewith potential biocontrol applications from Aspergillusniger An76[J].Journal of Life Science,2008,3(1):19-26
[18]卫春会,杨辉.黑曲霉液态发酵生产果胶酶的工艺条件初探[J].食品研究与开发,2005,26(2):62-64
Effects of Fermentation Conditions on the Production of A flatoxin B1Degradation Enzyme from Aspergillus niger
LEIJiao1,SONGHong-xin1,LIPeng-juan1,XUEHai-yan1,XIAOYu2,XUDan1,*
(1.Schoolof Food and BiologicalEngineering,ShaanxiUniversity ofScienceand Technology,Xi'an 710021,Shaanxi,China;2.BaojiTesting Centerof Food and Drug Inspection,Baoji721013,Shaanxi,China)
To study the effectof different factors on the production of aflatoxin B1(AFB1)degradation enzyme from Aspergillus niger.Experiment with AFB1degradation rate as the evaluation index,inspected different culturemedium and different fermentation conditions.The results showed that the carbon and nitrogen sources,metal ionsand AFB1analogshad little effecton the growth of Aspergillusniger,buthad significanteffecton the synthesisofdegradation enzyme,and the enzymewasan inducible enzyme.Furthermore,fermentation temperature,time and initial pH had significanteffects on the degradation ofenzyme synthesis.When the temperature(30℃)and the initial pH 7,the degradation rate of AFB1reached 87.5%and 89.3%,respectively.The re-search also found that fermentation time and the degradation rate of AFB1waspositively correlated.On the days 4,degradation rate of AFB1was83.5%.The research results can provide theoreticalguidance for the optimization of fermentation conditionsand industrialproduction of AFB1degradingenzyme.
Aspergillusniger;aflatoxin B1;degradation;fermentation condition
10.3969/j.issn.1005-6521.2017.05.041
2016-12-09
陕西省科技厅自然基金项目(2013JQ3019);陕西省农业科技创新与攻关项目(2015NY002)
雷娇(1991—),女(汉),在读研究生,研究方向:食品安全与质量控制。
*通信作者:徐丹(1981—),女,讲师,博士,研究方向:食品营养与安全。

