京尼平苷调控大鼠胰岛素分泌的机制研究
刘云峰,丁亚琴,钟向琴,任乐乐,白 涛,,刘萌萌,章 毅
京尼平苷调控大鼠胰岛素分泌的机制研究
刘云峰1,丁亚琴2,钟向琴2,任乐乐2,白 涛1,2,刘萌萌2,章 毅2
目的 探讨京尼平苷在大鼠胰岛素分泌中的作用及其机制,为糖尿病的治疗提供依据。方法 将胶原酶P经胆总管注入雄性Wistar大鼠的胰腺,消化11 min,histopaque 1077 梯度离心得到分离纯化的胰岛。用放射免疫分析法检测胰岛素分泌功能,采用ELISA方法检测环鳞酸腺苷(cAMP)含量,通过膜片钳技术记录电压依赖性钾通道(Kv)电流和Ca2+电流。结果 在8.3 mmol/L的葡萄糖下,京尼平苷可促进胰岛素分泌,给予exendin(9-39)、SQ22536和H89,可明显减弱京尼平苷的胰岛素分泌量以及环磷酸腺苷的含量,且在电压依赖性钾电流中也有相同的抑制作用。此外,京尼平苷调控胰岛素分泌作用还受到钙电流的影响。结论 京尼平苷通过、cAMP信号通路及其下游受体PKA来发挥调控胰岛素分泌的作用。
京尼平苷;胰岛素分泌;胰高血糖素样肽-1;环磷酸腺苷;电压依赖性钾通道
糖尿病在我国已成为一个日益严重的公共卫生问题,其中绝大部分(95%)是2型糖尿病,发病原因包括胰岛素分泌的缺陷和胰岛素敏感性的增加。胰岛素分泌缺陷有很多种,包括胰岛素的不应答[1]、葡萄糖刺激后胰岛素早期阶段的分泌缺失[2]、血浆中基础胰岛素及刺激后胰岛素浓度的降低[3]以及进行性降低的胰岛素分泌能力[4]等。因此,调节胰腺β细胞的胰岛素分泌能力对预防和治疗2型糖尿病非常重要。
近年来,越来越多的数据表明胰高血糖素样肽-1(GLP-1)可通过其受体来调节胰岛素分泌和葡萄糖代谢,然而,GLP-1的半衰期非常短,在循环系统中迅速被二肽基肽酶-4(DPP Ⅳ)降解,存在时长不超过2 min[5],因此研究能够激动GLP-1的小分子类化合物具有重要价值。其中京尼平苷(GP)作为GLP-1受体(GLP-1R)的激动剂备受关注,有报道称京尼平苷具有抗糖尿病作用[6],并且通过激活GLP-1R促进了胰岛细胞瘤细胞(INS-1)系的胰岛素分泌[7-8]。本研究旨在阐明京尼平苷在急性分离大鼠胰岛组织及原代胰岛β细胞中的作用及其潜在机制。
1 材料与方法
1.1 材料
1.1.1 动物 雄性Wistar大鼠,由北京中国人民解放军军事医学科学院实验动物中心提供,体重220 g~260 g。饲养环境:温度23 ℃±3 ℃,湿度(50±5)%。
1.1.2 试剂 胶原酶P(Roche,Indianapolis,USA),Dispase II(Roche,Indianapolis,USA),1640培养基(Hyclone Beijing,China),Histopaque 1077(Sigma,USA),京尼平苷(Marker Inc,China),exendin(9-39)(Abgent,San Diego,CA),SQ22536(Cayman Chemical,Ann Arbor,Mich USA),H89(Cayman Chemical,Ann Arbor,Mich,USA),胰岛素检测试剂盒(北方生物技术公司,北京),Elisa检测试剂盒(北方生物技术公司,北京)。
1.1.3 主要仪器 EPC10全自动膜片钳(HEKA,Germany);细胞培养箱(北京博奥恒信生物科技有限公司);台式离心机(长沙湘仪仪器有限公司);Narishige MODEL PP830 电极拉制仪、MIROFORGE MF830抛光仪(日本 Narishige)。
1.2 方法
1.2.1 胰岛、胰岛细胞的分离及培养 将Wistar大鼠的腹部剪开,充分暴露胰腺,将1 mg/mL胶原酶P经胆总管注入胰腺内,水浴消化11 min后,加入histopaque 1077进行梯度离心,在显微镜下挑选胰岛。将胰岛置于含10%胎牛血清,100 U/mL 青霉素及100 μg/mL 链霉素的1640培养基中,并在37 ℃、5%CO2的细胞培养箱中培养。单个胰岛细胞由胰岛经dispaseⅡ消化所得。
1.2.2 胰岛素分泌实验 配制KRBH孵育液,分组,每组7个Ep管,分别编号,于体视显微镜下挑取状态良好、大小均匀的胰岛,放入含 800 μL 2.8 mmol/L葡萄糖的 KRBH 缓冲液,每管5个胰岛,37 ℃预孵育半小时后弃上清。然后每管分别加入含不同浓度的葡萄糖和药物的KRBH 缓冲液 ,37 ℃孵育半小时,各自收集上清后进行标号,-20 ℃保存,待测。收集上清的过程中避免将胰岛吸出,加入酸乙醇裂解液,超声粉碎胰岛,-20 ℃保存待测。用放射免疫试剂盒检测上述各待测样品,测得的胰岛素含量均使用胰岛素总量标化后进行分析。
1.2.3 膜片钳技术 胰岛细胞种在盖玻片上,在室温(22 ℃~25 ℃)下采用EPC-10放大器和PULSE软件,并在全细胞模式下进行电流记录。电压依赖性钾(Kv)电流的记录需要将细胞与电极形成稳定GΩ封接,在-70 mV的钳制电压下给予细胞-70 mV~80 mV的电压刺激,破膜后记录400 ms内的电流变化。细胞电容大于7pF被认为是β细胞[9]。细胞外液:141.9 mmol/L NaCl,5.6 mmol/L KCl,1.2 mmol/L MgCl2,11.1 mmol/L 葡萄糖,5 mmol/L HEPES,用NaOH 调节PH为7.4。 细胞内液:10 mmol/L NaCl,1 mmol/L MgCl2,0.05 mmol/L EGTA,140 mmol/L KCl,10 mmol/L HEPES,用KOH将pH调为7.3。
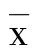
2 结 果
2.1 exendin(9-39)在京尼平苷调控胰岛功能中发挥的作用 与2.8 mmol/L的糖浓度(2.8G)相比,8.3 mmol/L的葡萄糖(8.3G)可促进胰岛素分泌,在此条件下,京尼平苷促胰岛素分泌量明显增加。我们的前期工作已证实,京尼平苷在10 μmol/L的浓度达最佳促分泌效应,故本实验所用京尼平苷浓度均为10 μmol/L。应用GLP-1R阻断剂exendin(9-39)后,可明显减弱京尼平苷的促胰岛素分泌作用。环磷酸腺苷(cAMP)含量测定发现,在8.3 mmol/L的糖浓度条件下,京尼平苷显著增加了胰岛cAMP的含量,exendin(9-39)明显减弱了此作用。通过电生理膜片钳实验发现,exendin(9-39)可逆转京尼平苷对Kv电流的抑制作用。因此,认为京尼平苷通过GLP-1R发挥调控胰岛各功能的作用。详见表1。
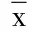
表1 Exendin(9-39)在京尼平苷调控胰岛功能中发挥的作用(±s)
2.2 cAMP信号通路参与京尼平苷调控胰岛素分泌过程 腺苷酸环化酶(AC)抑制剂SQ22536减弱了京尼平苷促胰岛素分泌的作用,应用AC 激动剂Forsklin则明显促进了胰岛素分泌,与京尼平苷组相比差异有统计学意义(P<0.01)。为了进一步验证,本研究采用Elisa方法检测cAMP含量,结果显示,京尼平苷诱导的cAMP含量在SQ22536作用下显著降低,且Forsklin明显增加了相同胰岛组织的cAMP含量。这些数据充分说明京尼平苷通过AC/cAMP信号途径发挥作用。详见表2。
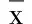
表2 SQ22536对京尼平苷诱导的胰岛素分泌及cAMP含量的影响(±s)
2.3 依赖性蛋白激酶A(PKA)信号途径在京尼平苷调控胰岛功能中发挥的作用 应用PKA抑制剂H89观察其对京尼平苷作用的影响,结果显示:H89减弱了京尼平苷对胰岛素的促分泌效应和对Kv电流的抑制作用,与对照组相比差异有统计学意义(P<0.05)。详见表3。
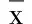
表3 H89对京尼平苷诱导的胰岛素分泌及Kv电流的影响(±s)
2.4 京尼平苷对钙通道的影响 应用膜片钳技术来检测钙离子通道在京尼平苷调控胰岛素分泌中所发挥的作用,与对照组相比,京尼平苷可明显增加钙离子电流密度。详见表4。
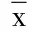
表4 京尼平苷对钙离子电流的影响(±s)
3 讨 论
有研究表明:京尼平苷在动物中具有抗糖尿病作用[10],在INS-1细胞系的研究中发现可通过GLP-1R调控胰岛素分泌[8],然而在原代胰岛β细胞中京尼平苷是如何发挥作用以及其作用机制尚缺乏足够研究。
本研究中发现京尼平苷在高糖(8.3 mmol/L)浓度下可促进胰岛素分泌,同样条件下,应用exendin(9-39)可明显减弱这一促分泌效应,且排除exendin(9-39)本身对胰岛功能的影响。因此可说明京尼平苷确实是通过GLP-1R发挥作用。
有报道称,cAMP信号途径在GLP-1R调控胰岛素分泌中发挥重要作用[11]。本实验通过应用腺苷酸环化酶的拮抗剂SQ22536和激动剂Forsklin来验证cAMP信号通路所发挥的作用。实验结果表明:SQ22536可明显减弱京尼平苷的作用,Forsklin作为阳性对照可明显的促进胰岛素分泌,SQ22536本身与对照组相比差异无统计学意义。
在胰岛β细胞中,大多数GLP-1需要激活细胞内cAMP PKA信号通路发挥作用[12];也有学者认为存在第二种机制,即GLP-1增强了cAMP调节的鸟嘌呤核苷酸交换因子(cAMP-GEF)Epac2的作用,而此作用是不依赖PKA的[13]。总的来说,PKA活性在刺激肠促胰岛素进行胞外分泌过程中发挥重要作用[14]。本研究结果也证实,在排除PKA抑制剂H89本身影响之外,应用H89明显削弱了京尼平苷的促分泌作用。
cAMP含量的检测结果也表明,exendin(9-39)、SQ22536和H89可逆转京尼平苷对cAMP含量的影响。我们的前期实验已证实,京尼平苷可抑制电压依赖性钾通道发挥调控胰岛素分泌的作用,本研究中我们采用膜片钳技术检测exendin(9-39)和H89对京尼平苷抑制Kv作用的影响,结果证实二者均可减弱京尼平苷对Kv的抑制效应。
此外,胰岛素分泌活动还受到钙离子的调控,即胰岛素分泌的钙依赖性[15],膜片钳实验结果表明,与对照组相比,钙电流密度在京尼平苷的干预下显著增加(P<0.001),证明钙离子参与了京尼平苷调控胰岛素分泌的过程。
综上所述,京尼平苷作为GLP-1R的小分子激动剂,通过GLP-1R/cAMP/PKA信号通路发挥其促胰岛素分泌作用,且只在高糖情况下发挥作用,是一种具有葡萄糖浓度依赖性的新型胰岛素促泌剂,避免了临床常见的低血糖反应,极大地扩充了糖尿病药物的范畴,对预防和治疗糖尿病具有重要的意义。
[1] Bergsten P.Pathophysiology of impaired pulsatile insulin release[J].Diabetes Metab Res Rev,2000,16:179-191.
[2] Kano Y,Kanatsuna T,Nakamura N,et al. Defect of the first-phase insulin secretion to glucose stimulation in the perfused pancreas of the nonobese diabetic (NOD) mouse[J]. Diabetes,1986,35:486-490.
[3] Hartter E,Svoboda T,Ludvik B,et al. Basal and stimulated plasma levels of pancreatic amylin indicate its co-secretion with insulin in humans[J].Diabetologia,1991,34:52-54.
[4] Guillausseau PJ,Meas T,Virally M,et al. Abnormalities in insulin secretion in type 2 diabetes mellitus[J].Diabetes Metab,2008,34(Suppl 2):S43-S48.
[5] Ahren B,Winzell MS,Wierup N,et al. DPP- 4 inhibition improves glucose tolerance and increases insulin and GLP-1 responses to gastric glucose in association with normalized islet topography in mice with beta-cell-specific overexpression of human islet amyloid polypeptide[J]. Regul Pept,2007,143:97-103.
[6] Kimura Y,Okuda H,Arichi S. Effects of geniposide isolated from Gardeniajasminoides on metabolic alterations in high sugar diet-fed rats[J]. Chem Pharm Bull,1982,30:4444-4447.
[7] Liu J,Guo L,Yin F,et al. Geniposide regulates glucose stimulated insulin secretion possibly through controlling glucose metabolism in INS-1 cells[J]. PLos One,2013,8 :e78315.
[8] Guo LX,Xia ZN,Gao X,et al. Glucagon-like peptide 1 receptor plays a critical role in geniposide-regulated insulin secretion in INS-1 cells[J]. Acta Pharmacol,2012,33: 237-241.
[9] Gopel S,Kanno T,Barg S,et al. Voltage-gated and resting membrane currents recorded from B-cells in intact mouse pancreaticislets[J]. J Physiol,1999,521: 717-728.
[10] Wu SY,Wang GF,Liu ZQ,et al. Effect of geniposide,a hypoglycemic glucoside,on hepatic regulating enzymes in diabetic mice induced by a high-fat diet and streptozotocin[J]. Acta Pharmacol Sin,2009,30:202-208.
[11] Ramos LS,Zippin JH,Kamenetsky M,et al. Glucose and GLP-1 stimulate cAMP production via distinct adenylyl cyclases in INS-1E in sulinoma cells[J]. J Gen Physiol,2008,132:329-338.
[12] Drucker DJ,Nauck MA. The incretin system:glucagon-likepeptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors in type 2 diabetes[J].Lancet,2006,368:1696-1705.
[13] Seino S,Shibasaki T.PKA-dependent and PKA-independentpathways for cAMP-regulated exocytosis[J]. Physiol Rev,2005,85:1303-1342.
[14] Chepurny OG,Kelley GG,Dzhura I,et al. PKA-dependent potentiation of glucose-stimulated insulin secretion by Epac activator 8-pCPT-20-O-Me-cAMP-AM in human islets of Langerhans[J].Am J Physiol Endocrinol Metab,2010,298:E622-E633.
[15] Henquin JC. Triggering and amplifying pathways of regulation of insulin secretion by glucose[J]. Diabetes,2000,49:1751-1760.
(本文编辑郭怀印)
国家自然科学基金(No.81273564,81373464,81670710);山西省留学回国人员科技活动项目择优资助(No.2016-97);山西医科大学第一医院青年创新基金(No.YC1422)
1.山西医科大学第一医院(太原 030001),E-mail:nectarliu@163.com;2.山西医科大学
引用信息:刘云峰,丁亚琴,钟向琴,等.京尼平苷调控大鼠胰岛素分泌的机制研究[J].中西医结合心脑血管病杂志,2017,15(4):425-427.
R541.7 R256.2
A
10.3969/j.issn.1672-1349.2017.04.010
1672-1349(2017)04-0425-03
2016-10-19)

