高速逆流色谱在快速筛选中药天然产物活性成分中的应用*
汪永玲,张宝军,付文卫**
(1.上海中医药大学中药学院上海201203;2.中药创新药物研发上海高校工程研究中心上海201203)
高速逆流色谱在快速筛选中药天然产物活性成分中的应用*
汪永玲1,2,张宝军1,2,付文卫1,2**
(1.上海中医药大学中药学院上海201203;2.中药创新药物研发上海高校工程研究中心上海201203)
高速逆流色谱结合快速生物活性检测方法,特别适合从中药和天然产物中筛选活性成分。结合本课题组的研究和近年研究进展,本文综述了高速逆流色谱在中药和天然产物中快速筛选活性成分的应用进展。
高速逆流色谱活性成分快速筛选
活性成分的筛选是发现先导化合物的重要途径,也是阐明中药药效物质基础的关键步骤。由于中药和天然药物成分复杂多样、含量参差不齐、活性成分多不明确,采用色谱技术分离纯化后再进行活性评价的传统方法往往费时、费力,成本高昂。因此,从中药天然产物中快速筛选活性成分成为一种发展趋势。
高速逆流色谱(High-Speed Counter CurrentChromatography,HSCCC)利用被分离物质在两相中的分配差异实现物质的高效分离,最大优点是无固体支撑相,避免样品的不可逆吸附、失活等问题,结合快速的生物活性检测方法,特别适合从中药天然产物中快速筛选活性成分[1]。本课题组也在这方面做了一些工作,比如在抗肿瘤、抗病毒活性筛选中的应用[2,3]。结合本课题组的研究和近年来的研究报道,本文综述了HSCCC在中药和天然产物中快速筛选活性成分的应用进展。
1 HSCCC在筛选活性化合物中的应用
1.1 HSCCC方法的开发
在中药及天然药物活性成分快速筛选过程中,HSCCC作为一项分离手段,其方法开发主要包括溶剂系统的筛选和运行方式的选择。溶剂系统筛选是HSCCC方法开发中花费时间最多的程序,准确快速的筛选合适的溶剂体系对于分离活性成分至关重要。在中药及天然产物活性成分分离过程中,针对不同的化学成分,常采用不同的溶剂系统,常用的溶剂系统可参考Ito Y等[4-6]的综述文献。在中药及天然产物活性筛选中,通常活性成分的性质并不清楚,常常应用梯度洗脱模式以实现不同极性化合物的分离,如Ying H等[7]以正己烷-乙酸乙酯-正丁醇(1:4:0,1:2:0,0:1:0,0:4:1,0:4:2,0:2:2)梯度洗脱模式,从秋葵(Okra)提取物中分离得到抗肿瘤活性化合物;或采用双向洗脱及洗脱-推出模式以扩展HSCCC的应用,如Li L等[8]应用双向洗脱方式筛选可可豆提取物中抗氧化活性成分。
1.2 HSCCC联用技术
在中药及天然产物快速活性筛选中用到的HSCCC联用技术,主要包括以下几种:
1.2.1 HSCCC与传统色谱联用
HSCCC与多种色谱技术(薄层色谱、硅胶柱色谱、大孔树脂吸附柱色谱、凝胶柱色谱、超滤、超临界流体萃取、固相萃取等)的联合使用,可以提高分离效率。采用薄层色谱结合HSCCC,还可对分离流份进行快速的初步分析。Yang C等[9]采用HSCCC结合硅胶柱色谱,从黄芪Astragalusaltaicus粗提物中逐级分离得到抗氧化活性的化合物isorhamnetin-3-gentiobioside、rutin以及narcissin。Li L等[10]采用HSCCC结合大孔树脂吸附柱色谱、凝胶柱色谱,从红花Carthamus tinctorius L.粗提物中分离得到羟基红花黄色素等具有抗氧化活性的化合物。LiS等[11]采用HSCCC结合超临界流体萃取从Chaenomelessinensis得到delphinidin-3-O-glucoside、cyanidin-3-O-glucoside、peonidin-3-O-glucoside、delphinidin、peonidin和malvidin。Liu Q等[12]采用固相萃取结合HSCCC从Rhizoma Chuanxiong中分离得到ferulicacid、protocatechuicacid和senkyunolide A等共11个化合物。
1.2.2 HSCCC与HPLC联用
HPLC尤其是HPLC-MS作为一种强大的分析检测和结构鉴定手段,可以弥补HSCCC分离方法的不足,为HSCCC提供许多其他检测技术所不能提供的被分离物质的结构信息。HSCCC结合LC/MS是一种分离分析复杂有机混合物的有效手段。LiS等[13]采用HSCCC结合超滤-LC-MS从Panax japlcusvar筛选得到具有抑制黄嘌呤氧化酶活性的24(R)-majoroside R1、chikusetsusaponin Iva、oleanolic acid-28-O-beta-D-glucopyranoside、notoginsenoside Fe、ginsenoside Rb2和ginsenoside Rd。Thakur M等[14]从肥皂草Saponaria officinalis粗皂苷混合物中筛选得到靶向增强抗肿瘤毒素的HSCCC流分,结合ESI-IT-MS导向分离得到活性成分bisdesmodic saponins。Wang Q等[15]利用HSCCC结合HPLC-ESI-QTOF-MS,从粉葛花Puerariae thomsonii Flos中筛选得到抗前列腺癌细胞活性成分tectorigenin,IC50为0.08mM。
1.2.3 结合活性筛选的多维HSCCC的应用
HSCCC筛选活性化合物通常选用离线二维模式,经过HSCCC分离的流份分别用于活性筛选和后续研究,如Zeng H等[16]建立离线二维筛选模式应用于Semen cassia筛选得到抗氧化活性成分;Zhang Y Q等[17]运用类似方法从广线金钱草Desmodium styracifolium中分离得到抑制血管紧张素转化酶的活性成分C-glycosylflavone;Liu Q等[18]采用牛血清蛋白结合Fe3O4的磁性纳米颗粒用于活性成分的筛选,离线二维HSCCC从Fructuspolygoniorientalis分离得到结合牛血清蛋白的活性成分。离线二维模式可以达到较理想的效果,这种模式在活性筛选时,通常将一维的流份进行收集,回收溶剂后,再以适当的溶剂溶解后进行各种活性的筛选。这种方式可以方便进行多种活性的检测,但操作相对复杂,且流份的干燥、转移过程可能导致活性成分损失或降解。
为达到快速筛选的目的,近年来不少研究者发展了在线的活性筛选模式,通过切换阀、分流器和其他接口技术等的巧妙应用,将HSCCC分离流份进行在线的活性检测、纯度分析、结构快速分析鉴定等,大大地拓展了HSCCC的应用范围。如ShiS等[19]建立HSCCC与抗氧化活性检测在线联用的方法筛选Selaginella moellendorffii中抗氧化活性的成分,将HSCCC分离的流份柱后分流,一部分在线与DPPH·溶液进行反应,进行抗氧化活性的检测,实现了逆流色谱的分离与生物活性分离的同步,从而达到活性成分快速筛选和分离的目的,是HSCCC联用技术未来发展的一个重要方向。
2 HSCCC在抗肿瘤活性成分快速筛选中的应用
抗肿瘤活性成分常表现为细胞毒活性、抑制肿瘤细胞增殖和分化,诱导细胞凋亡等,因此通过细胞毒性测试等可以快速筛选中药天然产物中的抗肿瘤活性成分,常用MTT法,XTT法和CKK法也有应用,近年来,研究人员常运用HSCCC分离所得抗肿瘤活性成分(表1)。
本课题组Han Q B等[3]利用HSCCC结合HPLC/ ESI/Q-TOF/MS,从藤黄树脂(Gamboge)中筛选得到2个诱导凋亡的活性流份,成功建立了HSCCC筛选凋亡活性化合物的方法。
Ying H等[7]通过梯度洗脱从秋葵(Okra)提取物中得到carolignan,抑制细胞增殖的活性最强,对A594、HL-60、MCF-7和HO8910共4种细胞系IC50均小于10 μM。Thakur等[14]以HSCCC-MS结合实时细胞细胞毒性检测,从肥皂草Saponaria officinali粗皂苷混合物中筛选得到增强抗肿瘤毒素毒性的活性成分bisdesmodic saponins。LiS等[20]采用HSCCC结合MTT法从石上柏Selaginella doederleinii Hieron提取物筛选得到amentoflavone和robustaflavone等活性化合物。Cho N等[21]从白桦皮Betula platyphylla中分离得到platyphylloside,IC50小于20μM。LiY等[23]使用反向胶束溶剂系统,经HSCCC分离,从苦瓜Momordica charantia中分离得到1个具有抗肿瘤活性的蛋白质。Jin J[25]将HSCCC-pre-HPLC结合成骨靶细胞提取技术成功应用于淫羊藿Herba Epimedii中活性成分的分离。ZhaoW等[26]通过HSCCC梯度洗脱从石榴Punica granatum L.中筛选得到urolithin A和urolithin B,可以降低ROS和丙二醛水平,提高SOD活性,降低结肠癌的氧化应激状态。
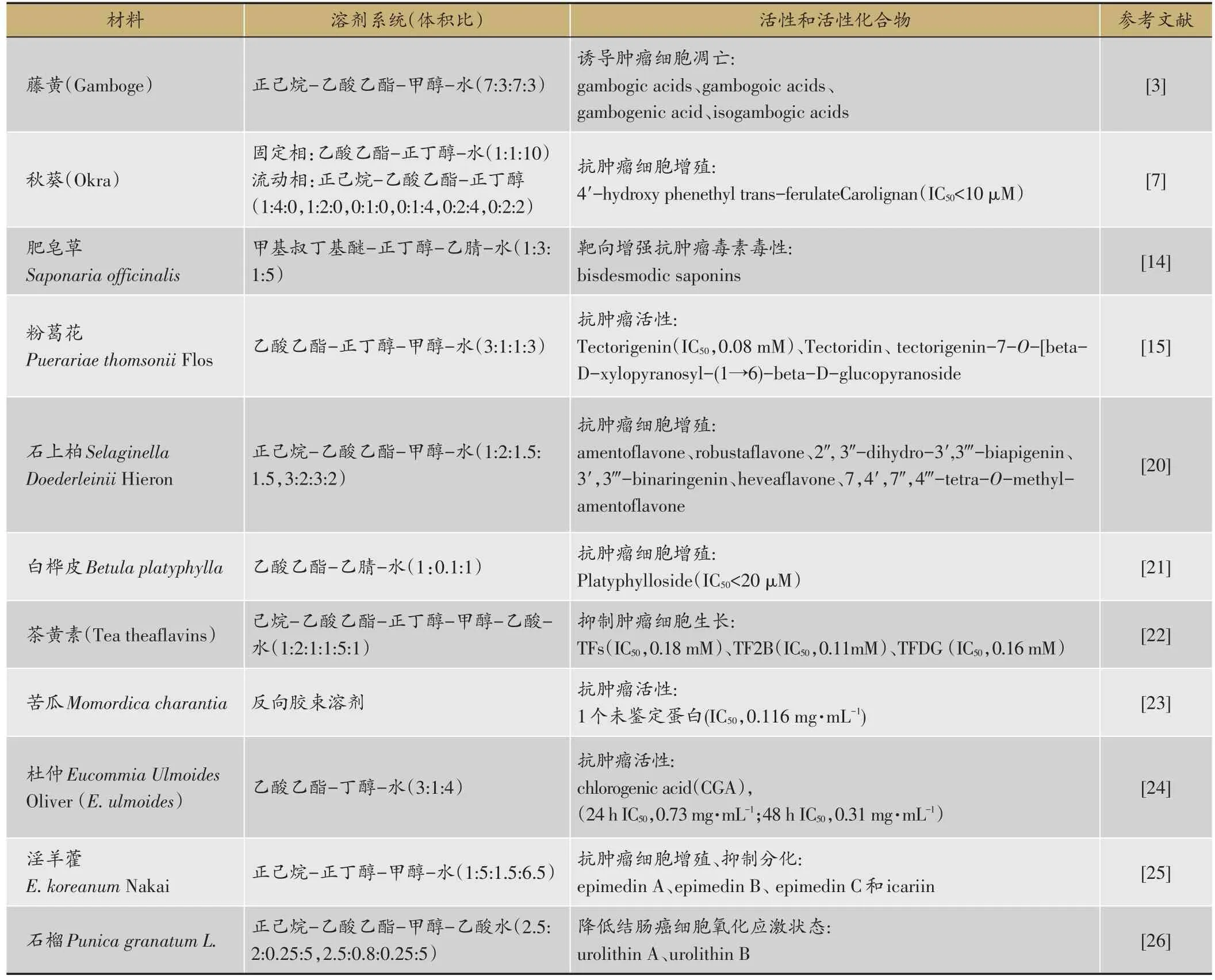
表1 应用HSCCC筛选得到的抗肿瘤活性化合物
3 HSCCC在抗氧化、免疫调节和抗炎活性成分快速筛选中的应用
HSCCC在抗氧化、免疫调节和抗炎活性成分快速筛选中的应用也较广泛,分离所得的抗氧化、免疫和抗炎活性成分见表2。
3.1 抗氧化活性
根据天然产物对自由基的清除能力或对脂类物质氧化的抑制能力,评价天然产物的抗氧化活性,常用ABTS自由基阳离子清除能力法(ABTS法)、DPPH自由基清除能力法(DPPH法)、氧自由基吸收量测定法(ORAC法)、铁离子抗氧化剂能力测定(FRAP法),DPPH-HPLC和HPLC-ABTS的应用缩短活性检测时间,提高了灵敏度和分辨率。
Yang C等[9]采用ABTS法,以HSCCC结合硅胶柱色谱从黄芪Astragalusaltaicus Bunge粗提物中逐级筛选得到活性化合物isorhamnetin-3-gentiobioside,rutin和narcissin,其中rutin SC50值为22.15mg·mL-1。Li L等[10]采用ABTS法,以HSCCC结合凝胶柱色谱从红花Carthamus tinctorius L.中筛选得到羟基红花黄色素等活性化合物,SC50值范围是20-80mg·mL-1。Lim SS等[27]采用HSCCC结合HPLC-ABTS在线自由基清除活性从日本桤木Alnus japonica.粗提物中筛选得到抗氧化活
性成分hirsutanonol 5-O-beta-D-glucopyranoside,3-deoxohirsutenonol5-O-beta-D-glucopyranoside和hirsutenone。Zhou X等[28]采用HSCCC结合DPPH法,从玉竹Polygonatum odoratum提取物筛选得到3个活性化合物,IC50值范围3.2-5.2mg·mL-1。Xiao G等[29]采用TLC自显影法检测抗氧化活性,以HSCCC从补骨脂果(Psoralea corylifolia fruits)中筛选得到5个黄酮类和3个香豆素类化合物,其中最强活性成分psoralidin IC50为44.7mM。Zhang Y等[30]利用DPPH-HPLC分析抗氧化活性组分,以HSCCC从卷柏Selaginella sinensis活性导向分离得到共8个活性化合物,其中最强活性成分quercetin IC50为3.2mM。Zhang S等[31]采用DPPH法、ABTS法,以HSCCC从葡萄籽提取物筛选得到不同聚合程度的抗氧化活性成分原花青素,发现活性与花青素的聚合程度相关。Ma R等[32]采用DPPH-HPLC法,应用HSCCC-Sephadex LH-20柱从藤茶(Vine tea)中筛选得到比抗坏血酸抗氧化活性更强的高纯度活性化合物,建立了HSCCC-DPPH-HPLC法筛选抗氧化活性成分的方法。

表2 应用HSCCC筛选得到的抗氧化、免疫和抗炎活性化合物
3.2 免疫调节
Wang J等[33]通过高速逆流色谱对参芪扶正注射液提取物进行初步的分离,运用指纹图谱-动物模型生物活性相关分析,对参芪扶正注射液中调节免疫功能的化合物进行分析,通过脾脏指数、外周白细胞计数、骨髓细胞计数、淋巴细胞增殖、脾自然杀伤细胞、巨噬细胞吞噬作用和白介素-2水平评价免疫活性,从中筛选得到黄芪甲苷等5种糖苷类活性组分,具有提高动物的脾脏指数、外周白细胞计数等作用,同时还发现可能的副作用成分5-羟甲基-2糠醛(5-hydroxymethylfuraldehyde)和党参炔苷(lobetyolin)。
Li LF等[34]采用促分裂素原活化的外周血单核细胞(mitogen-activated PBMCs)模型筛选牛肝菌Rubinoboletusballouii中的免疫调节剂,以HSCCC分离得到具有免疫抑制活性的成分:1-ribofuranosyl-striazin-2(1H)-one和pistillarin。
3.3 抗炎活性
Fan Y等[35]发现菝葜Smilax china L.提取物对慢性盆腔炎(Chronic Pelvic Inflammatory Disease,CPID)的动物模型有效,运用HSCCC从中分离得到两个化合物:Epicatechin和catechin-[8,7-e]-4-beta-(3,4-dihydroxyphenyl)-dihydro-2(3H)-pyranone,以人脐静脉内皮细胞模型证实catechin-[8,7-e]-4β-(3,4-dihydroxyphenyl)-dihydro-2(3H)-pyranone是其主要抗炎活性成分。
4 HSCCC在抑制酶活性成分快速筛选中的应用
以抑制酶活性如α糖苷酶、血管紧张素转化酶(Angiotension Converting Enzyme,ACE)、乙酰胆碱酯酶、脂肪酸合成酶活性为导向的活性化合物筛选为HSCCC拓展了应用范围,运用HSCCC分离所得抑制酶活性成分见表3。
4.1 抑制血管紧张素酶活性
Zhang YQ等[17]以ACE酶抑制活性[42]为导向,对广金钱草Desmodium styracifolium一维HSCCC流份进行活性检测,二维循环HSCCC以硫酸铜作为螯合剂加入流动相,对活性流份进行分离,得到5个C型黄酮苷活性化合物。
4.2 抑制α糖苷酶活性
LiS等[36]建立快速筛选α糖苷酶抑制剂的方法,通过超滤,LC-MS结合从竹节参Panax japonicus C.A. Meyer提取物中筛选得到抑制α糖苷酶活性的6个皂苷类活性化合物,该方法也可作为预防和治疗糖尿病活性化合物筛选。Zhou X等[37]使用超滤-HPLC用于抑制α糖苷酶活性检测,通过HSCCC以石油醚-乙酸乙酯-甲醇-水(1:4:0.8:4.2,1:4:1.8:3.2,1:4:2.3:2.7)梯度洗脱结合Sephadex LH-20柱对活性组分进行靶向分离,从玉竹Polygonatum odoratum提取物得到活性化合物N-trans-p-coumaroyloctopamine和N-trans-p-coumaroyltyramine,抑制α糖苷酶活性的化合物IC50值为2.3、2.7 mM,该方法可从复杂组分中快速筛选和制备活性化合物和组分。
4.3 抑制蛋白络氨酸磷酸化酶活性
Wang M等[38]以分子对接技术检测活性,结合HSCCC从羊栖菜Sargassum fusiforme中筛选得到抑制蛋白络氨酸磷酸化酶活性的邻苯二甲酸二丁酯(dibutylphthalate)。
4.4 抑制脂肪酸合成酶活性
Chen Q等[39]利用HSCCC,氯仿-乙醇-水-乙酸(4:3:2:0.01)溶剂系统,从山茶果壳(Camellia fruithull)乙醇提取物中分离得到ellagic acid,具有抑制脂肪酸合成酶活性,IC50为2.5mg·mL-1。
4.5 抑制磷酸二酯酶活性
ShiSY等[40]采用HSCCC结合超滤-HPLC-DADMS的配体筛选方法,用同位素两步分析法测磷酸二酯酶活性,从杜仲皮Eucommia ulmoides bark中筛选得到5个活性成分,其中(+)-pinoresinol-4,4′-di-O-β-D-glucopyranoside和(+)-medioresinol-4,4′-di-O-β-D-glucopyranoside,IC50分别为63.5、42.1μM。
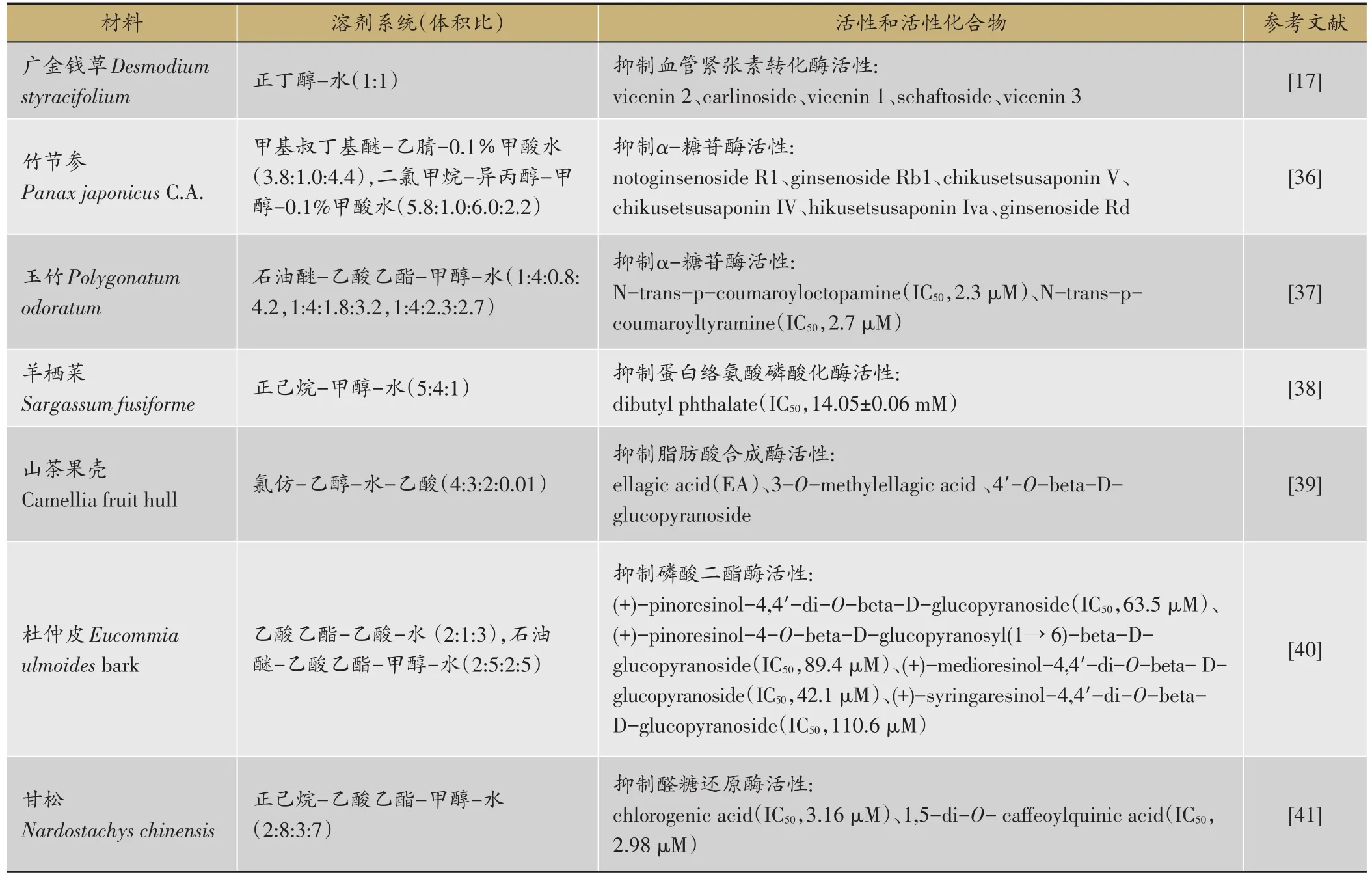
表3 应用HSCCC筛选得到的酶抑制活性化合物
4.6 抑制醛糖还原酶活性
Paek JH等[41]以抑制醛糖还原酶活性为导向,HPLC-超滤对比前后色谱峰变化定位活性流份,洗脱-推出模式运行HSCCC从甘松Nardostachyschinensis分离得到活性化合物chlorogenic acid和1,5-di-O-caffeoylquinic acid,IC50分别为3.16、2.98μM。
5 HSCCC在抗细菌和抗病毒活性成分快速筛选中的应用
运用HSCCC分离所得抗菌抗病毒活性成分见表4。
5.1 抗菌活性
Chan BC等[43]采用XTT法[47]进行抗菌活性筛选,应用HSCCC以正己烷-乙酸乙酯-甲醇-水(1:1:1:1)为溶剂系统从苦参Sophora flavescens中筛选得到具有抗MRSA的活性化合物kuraridin和sophoraflavanoneG,抗菌活性在6种MRSA菌株中测试,后者MIC在2-4μg·mL-1之间,活性强于黄芩苷,kuraridin对于人外周血单核细胞没有毒性。Walasek M等[44]采用肉汤稀释法进行抗菌活性筛选,应用HSCCC从巨型猪草Heracleum mantegazzianum Sommier&Levier(Apiaceae)分离得到活性化合物xanthotoxin,IC50范围在0.03-1mg·mL-1之间。SiW等[48]采用抗菌活性筛选,应用HSCCC从中国绿茶提取物筛选分离得到抑菌活性化合物epicatechin gallate(ECG)、epigallocatechin gallate(EGCG)、epicatechin(EC)和咖啡因(CN),ECG和EGCG较其他两个化合物活性好,EGCG抗S.aureus(MSSA)和methicilin-resistant S.aureus(MRSA)的MIC90值分别为58、37 mg·mL-1。Chan BC等[49]从马齿苋Portulaca oleracea L.筛选得到与红霉素协同抗菌(MRSA)活性的linoleic和oleic acids。
5.2 抗病毒活性
本课题组Liu M等[2]应用“折扇”模式优化分离条件,结合抗病毒活性筛选,采用HSCCC从知母Anemarrhena asphodeloides中分离得到活性化合物timosaponin B-II,其选择指数是阳性对照利巴韦林的40倍。Shia S等[45]研究发现翼齿六棱菊Laggera pterodonta的水提物具有显著的抑制病毒复制的活性,以乙酸乙酯-正丁醇-水(3:2:5)为溶剂系统,采用HSCCC分离得到3个dicaffeoylquinic acids活性成分。ShiSY等[46]采用HSCCC,以抗病毒活性为导向,从刚毛橐吾Ligularia atroviolacea乙酸乙酯部位筛选得到8 beta-hydroxyeremophil-3,7(11)-dien-12,8 alpha,15,6 alpha-diolide和8 beta-methoxyeremophil-3,7(11)-dien-12,8 alpha,15,6 alpha-diolide,均对HepG2.2.15细胞HBsAg表达具有抑制作用。它们成功建立了HSCCC快速筛选抗病毒活性成分的方法。

表4 应用HSCCC筛选得到的抗菌和抗病毒活性化合物
6 HSCCC在其他活性筛选中的应用
运用HSCCC还分离得到抗骨质疏松、雌激素活性、舒张血管、抗高血糖等活性成分见表5。
6.1 抗骨质疏松
Li J等[50]采用CCK法、ALP酶活性测定、矿物质含量测定,应用HSCCC从野菊花FlosChrysanthemi Indici乙醇提取物的乙酸乙酯部位分离得到活性化合物acacetin、apigenin、luteolin和linarin,可以提高成骨细胞增殖和分化,具有潜在的抗骨质疏松作用,建立的该方法可以快速筛选抗骨质疏松的活性成分。
6.2 雌激素活性
Ying H等[51]采用荧光素酶法(Luciferase assay),HSCCC以正丁醇和乙酸乙酯饱和的水为固定相,流动相选择正己烷-乙酸乙酯-正丁醇(1:1:0,1:2:0,1:4:0,0:1:1,0:4:1,0:2:1,0:1:1)梯度洗脱,从砂仁Fructusamomi中筛选得到8个具有雌激素活性的化合物,建立的荧光素酶法结合梯度HSCCC可以快速筛选中药天然产物中具有雌激素活性的化合物。
6.3 舒张血管作用
Feng ZF等[52]采用动物模型筛选,应用HSCCC-大孔树脂吸附色谱,HSCCC溶剂系统氯仿-甲醇-乙酸-水(2:1:1:1),从黄芪Radix Astragali提取物筛选得到引起血管舒张的活性化合物calycosin-7-O-beta-D-glycoside、formononetin-7-O-beta-D-glycoside、calycosin和formononetin等4个黄酮类化合物。
6.4 抗高血糖
Chen H Y等[53]使用HSCCC结合传统色谱从黄连Rhizoma Coptis的乙醇和氯仿提取物中共分离得到13个化合物,对HSCCC流分及所有化合物进行细胞毒性评价和葡萄糖消耗作用,所有化合物均有不同程度的细胞毒性,同时发现多组分组合减低毒性并有助于黄连提取物在HepG2细胞中发挥抗高血糖作用。

表5 应用HSCCC筛选得到的其他活性化合物
7 结语与展望
HSCCC在快速筛选活性成分的应用中展现了独特的优势:①无固体固定相支撑可避免样品不可逆吸附,理论回收率可达100%,避免样品失活变性,最大限度保留活性成分,保证快速活性筛选的物质基础,为活性筛选提供无损失的样品制备方法;②HSCCC与活性成分快速筛选的在线联用技术也有所发展。我们有理由相信,随着HSCCC与在线筛选联用技术的不断发展,HSCCC在快速筛选活性成分的应用中会有更广阔的发展空间。然而,与其他分离技术相比,HSCCC也存在着一些不足:在溶剂系统的筛选上要消耗的时间较多,HSCCC与活性成分快速筛选技术的联用方面也有待进一步发展和完善。
1 Lu Y,Berthod A,Hu R,et al.Screening of complex natural extracts by countercurrent chromatography using a parallel protocol.Anal Chem, 2009,81(10):4048-4059.
2 Liu M,Tao L,Chau S L,et al.Folding fan mode counter-current chromatography offers fast blind screening for drug discovery.Case study:finding anti-enterovirus 71 agents from Anemarrhena asphodeloides.JChromatogrA,2014,1368:116-124.
3 Han Q B,Zhou Y,Feng C,etal.Bioassay guided discovery of apoptosis inducers from gamboge by high-speed counter-current chromatography and high-pressure liquid chromatography/electrospray ionization quadrupole time-of-flightmass spectrometry.J Chromatogr B Analyt TechnolBiomed LifeSci,2009,877(4):401-407.
4 Ito Y.Golden rulesand pitfalls in selecting optimum conditions for highspeed counter-current chromatography.JChromatogr A,2005,1065(2):145-168.
5 Ren D B,Qin Y H,Yun Y H,etal.Using nonrandom two-liquidmodel for solvent system selection in counter-current chromatography.J ChromatogrA,2014,1355:80-85.
6 Liang J,Meng J,Wu D,etal.A novel 9×9map-based solvent selection strategy for targeted counter-current chromatography isolation of natural products.JChromatogrA,2015,1400:27-39.
7 Ying H,Jiang H,Liu H,et al.Ethyl acetate-n-butanol gradient solvent system for high-speed countercurrent chromatography to screen bioactive substances in okra.JChromatogrA,2014,1359:117-123.
8 Li L,Zhang S,Cui Y,et al.Preparative separation of cacao bean procyanidins by high-speed counter-current chromatography.JChromatogrBAnalytTechnol Biomed LifeSci,2016,1036-1037:10-19.
9 Yang C,Yang Y,Aisa H A,et al.Bioassay-guided isolation of antioxidants from Astragalus altaicus by combination of chromatographic techniques.JSep Sci,2012,35(8):977-983.
10 Li L,Yang Y,Hou X,etal.Bioassay-guided separation and purification of water-soluble antioxidants from Carthamus tinctorius L.by combination of chromatographic techniques.Sep Purif Technol,2013, 104:200-207.
11 Li S,Guo L,Liu C,et al.Combination of supercritical fluid extraction with counter-current chromatography to isolate anthocyanidins from the petals of Chaenomeles sinensis based on mathematical calculations.J Sep Sci,2013,36(21-22):3517-3526.
12 Liu Q,Zhou J,Yu J,et al.Systematic and efficient separation of 11 compounds from Rhizoma Chuanxiong via counter-currentchromatographysolid phase extraction-counter-current chromatography hyphenation.J ChromatogrA,2014,1364:204-213.
13 Li S,Tang Y,Liu C,et al.Development of a method to screen and isolate potential xanthine oxidase inhibitors from Panax japlcus var via ultrafiltration liquid chromatography combined with counter-current chromatography.Talanta,2015,134:665-673.
14 Thakur M,Jerz G,Tuwalska D,et al.High-speed countercurrent chromatographic recovery and off-line electrospray ionization mass spectrometry profiling of bisdesmodic saponins from Saponaria officinalis possessing synergistic toxicity enhancing properties on targeted antitumor toxins.JChromatogr B Analyt Technol Biomed Life Sci,2014,955-956:1-9.
15 Wang Q,Cheng X-L,LiH,etal.Application of an efficient strategy for discovery and purification of bioactive compounds from Chinese herbal medicines,a case study on the Puerariae thomsonii Flos.J Pharm Biomed Anal,2013,75:25-32.
16 Zeng H,Liu Q,WangM,etal.Target-guided separation ofantioxidants from Semen cassia via off-line two-dimensional high-speed countercurrent chromatography combined with complexation and extrusion elution mode.J Chromatogr B Analyt Technol Biomed Life Sci,2015, 1001:58-65.
17 Zhang Y Q,Luo J G,Han C,et al.Bioassay-guided preparative separation of angiotensin-converting enzyme inhibitory C-flavone glycosides from Desmodium styracifolium by recycling complexation high-speed counter-current chromatography.J Pharm Biomed Anal, 2015,102:276-281.
18 Liu Q,Shi S,Liu L,et al.Separation and purification of bovine serum albumin binders from Fructus polygoni orientalis using off-line twodimensional complexation high-speed counter-current chromatography target-guided by ligand fishing.JChromatogrA,2013,1304:183-193.
19 Shi S,Zhou H,Zhang Y,etal.Hyphenated HSCCC-DPPH·for Rapid Preparative Isolation and Screening of Antioxidants from S elaginella moellendorffii.Chromatographia,2008,68(3):173-178.
20 Li S,Zhao M,Li Y,et al.Preparative Isolation of six Anti-Tumour Biflavonoids from Selaginella Doederleinii Hieron by High-Speed Counter-Current Chromatography.Phytochem Anal,2014,25(2):127-133.
21 Cho N,Kim H W,Kim T B,et al.Preparative Purification of Anti-Proliferative Diarylheptanoids from B etula platyphylla by High-Speed Counter-CurrentChromatography.Molecules,2016,21(6).pii:E700.
22 Tu Y Y,Tang A B,Watanabe N.The theaflavin monomers inhibit the cancer cellsgrowth in vitro.Acta Biochim Biophys Sin(Shanghai),2004, 36(7):508-512.
23 Li Y,Yin L,Zheng L,etal.Application of high-speed counter-current chromatography coupled with a reverse micelle solvent system to separate three proteins from Momordica charantia.J Chromatogr B Analyt Technol Biomed Life Sci,2012,895-896:77-82.
24 Shao P,Zhang JF,Chen X X,etal.Microwave-assisted extraction and purification of chlorogenic acid from by-products of Eucommia Ulmoides Oliver and its potential anti-tumor activity.J Food Sci Technol,2015,52(8):4925-4934.
25 Jin J,LiY,Kipletting TanuiE,etal.Fishing and knockoutof bioactive compounds using a combination of high-speed counter-current chromatography(HSCCC)and preparative HPLC for evaluating the holistic efficacy and interaction of the components of Herba Epimedii.J Ethnopharmacol,2013,147(2):357-365.
26 ZhaoW,Wang Y,HaoW,etal.Preparative isolation and purification of urolithins from the intestinalmetabolites of pomegranate ellagitannins by high-speed counter-current chromatography.JChromatogrB Analyt TechnolBiomed Life Sci,2015,990:111-117.
27 Lim SS,LeeM Y,Ahn H R,etal.Preparative isolation and purification ofantioxidative diarylheptanoid derivatives from Alnusjaponica by highspeed counter-current chromatography.JSep Sci,2011,34(23):3344-3352.
28 Zhou X,Zhang Y,Zhao H,et al.Antioxidant homoisoflavonoids from Polygonatum odoratum.Food Chem,2015,186:63-68.
29 Xiao G,Li G,Chen L,et al.Isolation of antioxidants from Psoralea corylifolia fruits using high-speed counter-current chromatography guided by thin layer chromatography-antioxidant autographic assay.J ChromatogrA,2010,1217(34):5470-5476.
30 Zhang Y,Shi S,Wang Y,etal.Target-guided isolation and purification of antioxidants from Selaginella sinensis by offline coupling of DPPHHPLC and HSCCC experiments.J Chromatogr B Analyt Technol Biomed Life Sci,2011,879(2):191-196.
31 Zhang S,Li L,Cui Y,et al.Preparative high-speed counter-current chromatography separation of grape seed proanthocyanidins according to degreeofpolymerization.Food Chem,2017,219:399-407.
32 Ma R,Zhou R,Tong R,et al.At-line hyphenation of high-speed countercurrent chromatography with Sephadex LH-20 column chromatography for bioassay-guided separation of antioxidants from vine tea(Ampelopsis grossedentata).J Chromatogr B Analyt Technol Biomed LifeSci,2017,1040:112-117.
33 Wang J,Tong X,Li P,et al.Bioactive components on immunoenhancement effects in the traditional Chinese medicine Shenqi Fuzheng Injection based on relevance analysis between chemical HPLC fingerprints and in vivo biological effects.JEthnopharmacol,2014,155(1):405-415.
34 Li L F,Chan B C,Yue G G,et al.Two immunosuppressive compounds from themushroom Rubinoboletusballouii using human peripheral blood mononuclear cells by bioactivity-guided fractionation.Phytomedicine, 2013,20(13):1196-1202.
35 Fan Y,DuanW,Luo Y,etal.Preparative separation and purification of two flavanols from Smilax china L.using high-speed counter-current chromatography.Eur Food ResTechnol,2015,240(1):33-39.
36 Li S,Tang Y,Liu C,et al.Development of a method to screen and isolate potential alpha-glucosidase inhibitors from Panax japonicus C. A.Meyer by ultrafiltration,liquid chromatography,and counter-current chromatography.JSep Sci,2015,38(12):2014-2023.
37 Zhou X,Liang J,Zhang Y,et al.Separation and purification of alphaglucosidase inhibitors from Polygonatum odoratum by stepwise highspeed counter-currentchromatography combined with Sephadex LH-20 chromatography target-guided by ultrafiltration-HPLC screening.J ChromatogrBAnalytTechnolBiomed Life Sci,2015,985:149-154.
38 Wang M,Gu D,Guo X,et al.Bioassay-guided isolation of an active compound with protein tyrosine phosphatase 1B inhibitory activity from S argassum fusiforme by high-speed counter-current chromatography.J Sep Sci,2016,39(22):4408-4414.
39 Chen Q,Luo X,Ma X,et al.Fatty acid synthase inhibitors separated from oiltea camellia by high-speed counter-current chromatography.J Food Sci,2011,76(5):C750-754.
40 Shi SY,Peng M J,Zhang Y P,etal.Combination of preparative HPLC and HSCCC methods to separate phosphodiesterase inhibitors from Eucommia ulmoides bark guided by ultrafiltration-based ligand screening.AnalBioanalChem,2013,405(12):4213-4223.
41 Paek J H and Lim S S.Preparative isolation of aldose reductase inhibitory compounds from Nardostachys chinensis by elution-extrusion counter-current chromatography.Arch Pharm Res,2014,37(10):1271-1279.
42 Schwager S L,Carmona A K,and Sturrock E D.A high-throughput fluorimetric assay for angiotensin I-converting enzyme.Nat Protoc, 2006,1(4):1961-1964.
43 Chan B C,Yu H,Wong CW,et al.Quick identification of kuraridin,a noncytotoxic anti-MRSA(methicillin-resistant Staphylococcus aureus) agent from Sophora flavescens using high-speed counter-current chromatography.JChromatogrB Analyt Technol Biomed Life Sci,2012, 880(1):157-162.
44 Walasek M,Grzegorczyk A,Malm A,etal.Bioactivity-guided isolation of antimicrobial coumarins from Heracleum mantegazzianum Sommier& Levier(Apiaceae)fruits by high-performance counter-current chromatography.Food Chem,2015,186:133-138.
45 Shia S,Huang K,Zhang Y,et al.Purification and identification of antiviral components from Laggera pterodonta by high-speed countercurrent chromatography.J Chromatogr B Analyt Technol Biomed Life Sci,2007,859(1):119-124.
46 ShiSY,Zhou H H,Huang K L,etal.Application ofhigh-speed countercurrent chromatography for the isolation of antiviral eremophilenolides from Ligularia atroviolacea.Biomed Chromatogr,2008,22(9):985-991.
47 Roehm N W,Rodgers G H,Hatfield S M,et al.An improved colorimetric assay for cell proliferation and viability utilizing the tetrazolium saltXTT.J ImmunolMethods,1991,142(2):257-265.
48 Si W,Gong J,Tsao R,et al.Bioassay-guided purification and identification of antimicrobial components in Chinese green tea extract. JChromatogr A,2006,1125(2):204-210.
49 Chan B C,Han X Q,Lui S L,et al.Combating againstmethicillinresistant Staphylococcus aureus-two fatty acids from Purslane (Portulaca oleracea L.)exhibit synergistic effects with erythromycin.J Pharm Pharmacol,2015,67(1):107-116.
50 Li J and Lin X.Preparative Purification of Bioactive Compounds from Flos Chrysanthemi Indici and Evaluation of Its Antiosteoporosis Effect. Evid-based complAltMed,2016,2016:2587201.
51 Ying H,Liu J,and Du Q.Analysis and determination of oestrogenactive compounds in fructus amomi by the combination of high-speed counter-current chromatography and high performance liquid chromatography.JChromatogrB Analyt Technol Biomed Life Sci,2014, 958:36-42.
52 Feng Z F,Chen X F,Zhang J,etal.Activity-screening-guided isolation and purification for vasodilative effects compounds from Radix Astragali by high-speed counter-current chromatography using gradient elution. Natl Prod Res,2013,27(11):1020-1022.
53 Chen H Y,Ye X L,Cui X L,et al.Cytotoxicity and antihyperglycemic effect of minor constituents from Rhizoma Coptis in HepG2 cells. Fitoterapia,2012,83(1):67-73.
App lication of High-Speed CountercurrentChromatography to the Rapid Screening of Bioactive Components from ChineseM ateria M edica(CMM)and Natural Products
Wang Yongling1,2,Zhang Baojun1,2,FuWenwei1,2
(1.SchoolofPharmacy,ShanghaiUniversity ofTraditionalChineseMedicine,Shanghai201203,China; 2.Engineering ResearchCenterofShanghaiCollegesforTCM New Drug Discovery,Shanghai201203,China)
The combination ofhigh-speed countercurrent chromatography and rapid bioactive assay is a desirablemeth-od in the screening of bioactive components from CMM and natural products.This review focused on the application status of high-speed countercurrent chromatography to the rapid screening of bioactive components from CMM and natural productsbased on our previousstudiesand the recentprogressover it.
High-speedcountercurrentchromatography,bioactive components,rapid screening
10.11842/wst.2017.02.013
R93
A
(责任编辑:马雅静,责任译审:朱黎婷)
2017-02-20
修回日期:2017-02-20
*上海中医药大学预算内项目(2016YSN06):菲岛福木果实抗肿瘤活性成分研究,负责人:付文卫;上海中医药大学中药学一流学科创新基金(ZYX-CXYJ-012):单花山竹子、大苞藤黄以及大果藤黄抗肿瘤有效部位的化学成分及作用机制研究,负责人:付文卫。
**通讯作者:付文卫,副研究员,硕士生导师,主要研究方向:中药活性成分研究。

