浮萍遗传转化体系的建立和优化*
武凤洁 朱晔荣** 姬晓櫞 杨 琳刘苗苗 李亚辉 白艳玲 王 勇**
(1南开大学生命科学学院 天津 300071 2天津师范大学生命科学学院 天津 300384)
浮萍(Lemna minor)属于浮萍科(lemnaceae),为最简单的单子叶水生漂浮植物,虽然小而简单,但是多年来,围绕浮萍在植物生理学、遗传学、生态学等领域展开了众多理论研究,同时被广泛应用于除草剂的筛选、水环境污染程度监测、重要药用蛋白的生产和水体污染的修复,同时因为浮萍的淀粉和蛋白含量高而被开发为生物质能和优质蛋白生产的优势原料[1-5],使得浮萍成为研究、开发和应用领域的热点和焦点。遗传转化技术是理论研究和拓宽应用开发领域最重要且最有效的手段之一,特别是浮萍药用蛋白生物反应器的建立,高产淀粉或蛋白优质浮萍株系的获得等,都离不开稳定高效的遗传转化体系。
相对于其他重要农作物和模式植物的遗传转化体系,浮萍侵染体系的研究报道相对甚少[6-7]。此外,针对不同的浮萍属,其再生和侵染体系的特异性较强,因此不同属浮萍遗传转化体系的建立,对于通过转基因进行浮萍的相关机理研究和生产开发应用至关重要。本研究是在课题组建立和优化了浮萍组培体系的基础上[8],通过不同条件的摸索和优化,建立了浮萍稳定的遗传转化体系,为通过基因转化对浮萍进行理论研究和开发应用提供技术支撑。
1 材料与方法
1.1实验材料供试材料浮萍由本实验室保存;转化载体含有拟南芥丝氨酸:乙醛酸氨基转移酶基因(Serine:Glyoxylate Aminotransferase,AtAGT1),由本实验室构建(图1,见封四);供试农杆菌菌株为EHA105、LBA4404 和 C58C1。
1.2实验方法
1.2.1浮萍转化体系的建立浮萍遗传转化体系的建立根据文献6、文献7进行摸索,首先将浮萍叶状体放于诱导培养基上3周后形成愈伤组织,然后转移到继代培养基中进行继代培养,以继代培养后的浮萍愈伤为原材料进行浮萍的遗传转化,包括共培养和筛选及再生培养。其中,诱导和继代培养基与文献8相同,共培养培养基是在B5基本培养基的基础上加了100 μmol/L乙酰丁香酮,筛选培养基是在继代培养基中加入抑菌抗生素和潮霉素,再生培养基是在文献8中的再生培养基中加入抑菌抗生素和潮霉素。
1.2.2浮萍转化体系的优化使用不同种类的农杆菌(农杆碱型 EHA105、胭脂碱型 GV3101和C58C1)对浮萍进行侵染,统计侵染3 d后浮萍愈伤的GUS瞬时表达率确定哪种农杆菌对浮萍的侵染效率最高。
采 用 0、50 μmol/L、100 μmol/L、150 μmol/L、200 μmol/L的乙酰丁香酮侵染同一批浮萍愈伤,统计侵染3 d后浮萍愈伤组织的GUS瞬时表达率确定乙酰丁香酮的最适作用浓度。
将农杆菌活化于分别含有头孢霉素和羧苄青霉素(0、50 mg/L、100 mg/L、150 mg/L、200 mg/L、250 mg/L、300 mg/L)的培养基中,通过测定其OD值观察其抑菌效果。
将野生型愈伤组织和叶状体放于不同浓度的潮霉素筛选培养基中,观察野生型愈伤组织和叶状体的状态确定筛选浓度。
1.2.3转基因植株的分子鉴定将再生的转基因植株在液体培养基中进行抗性筛选,选择生长较好的抗性植株,进行GUS染色,并采用SDS法提取基因组DNA,采用RNA提取试剂盒提取抗性植株RNA进行PCR检测,PCR检测出具有目的条带的为阳性植株。其中,RNA提取试剂盒为TaKaRaMiniBEST,来源于北京六合通经贸有限公司;PCR引物为:
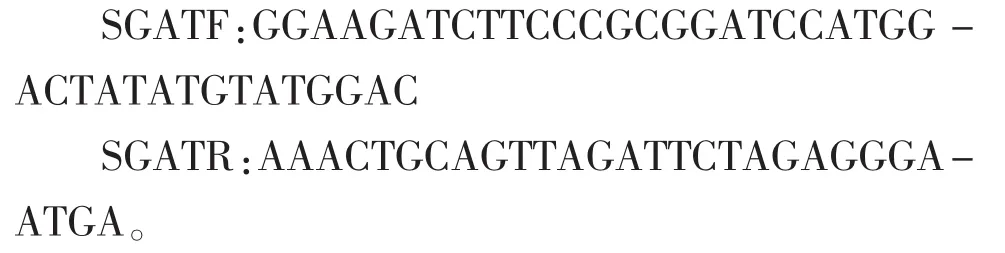
2 结果与分析
2.1不同类型的农杆菌对浮萍侵染效率的比较
使用不同农杆菌对抗性浮萍愈伤组织的GUS瞬时表达率检测结果显示,农杆菌EHA105的侵染效率要高于GV3101和C58C1,因此浮萍遗传转化确定选用农杆菌EHA105(图2)。
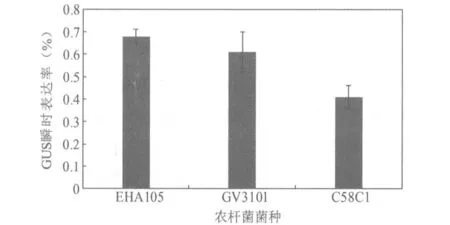
图2 不同类型的农杆菌对浮萍愈伤组织侵染的瞬时表达率比较
2.2乙酰丁香酮浓度对侵染效率的影响本实验使用添加不同浓度乙酰丁香酮(0、50 μmol/L、100 μmol/L、150 μmol/L、200 μmol/L)的菌液侵染浮萍,发现随着乙酰丁香酮浓度的升高,侵染效率先升高后降低,当乙酰丁香酮浓度为100 μmol/L时,浮萍的侵染效率最高(图3)。

图3 不同浓度乙酰丁香酮对EHA105介导的浮萍愈伤组织瞬时转化率的影响
2.3抗生素浓度的确定头孢霉素(Cef)和羧苄青霉素(Carb)都具有抑制农杆菌生长的作用,在侵染过程中抑制农杆菌过度生长是转基因成败的关键,因此抗生素浓度的选择至关重要。本实验采用检测OD值观察抗生素对农杆菌的抑制效果,由图4可知,头孢霉素和羧苄青霉素对农杆菌EHA105都有很好的抑制效果,浓度为300 mg/L时可以完全抑制农杆菌的生长,所以在侵染浮萍愈伤组织时选择头孢霉素或羧苄青霉素作为抑菌的抗生素,其最佳浓度都选用300 mg/L。
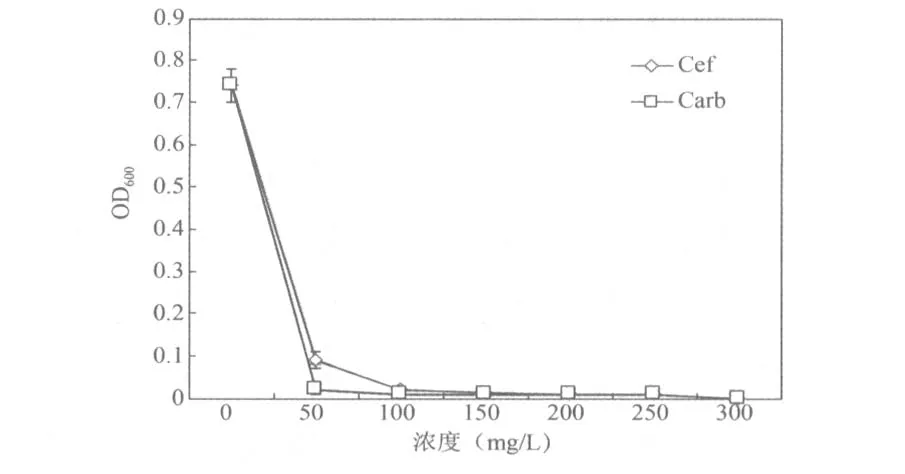
图4 头孢霉素和羧苄青霉素对农杆菌EHA105生长的影响
2.4潮霉素筛选浓度的确定
2.4.1固体潮霉素筛选浓度的确定在筛选培养过程中,随着潮霉素浓度的增加,野生型浮萍愈伤组织的存活率不断下降,当潮霉素浓度为60 mg/L时,愈伤组织的存活率为0,因此,固体潮霉素筛选的最佳浓度为60 mg/L,结果见表1。
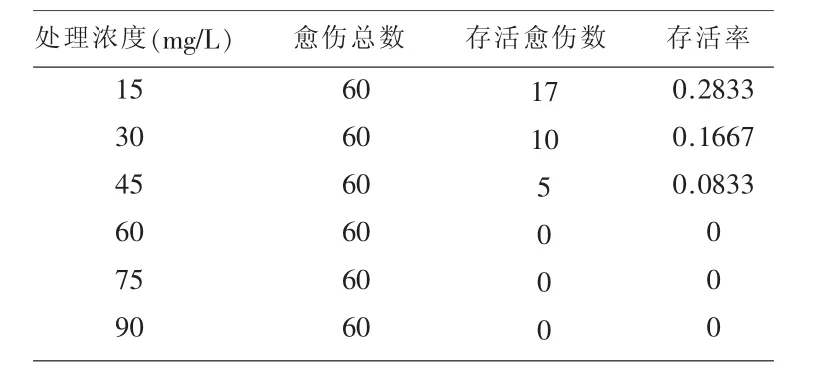
表1 固体潮霉素筛选浓度的确定
2.4.2液体潮霉素筛选浓度的确定使用野生型(WT)和转潮霉素筛选基因的浮萍(OE1)作为实验材料,当用不同浓度的潮霉素进行处理后,其表型变化如图 5~图 7(见封四),当 Hyg浓度为1 mg/L时,WT植株的根变为白色,叶状体生长明显受到抑制,当Hyg浓度大于1 mg/L时,WT植株根掉落,叶状体逐渐变白直至死亡。因此筛选转基因植株的最低Hyg浓度为1 mg/L。当Hyg浓度为10 mg/L时,OE1转基因植株的生长明显受到抑制,当Hyg浓度大于10 mg/L时,OE1植株的叶状体变小,而且叶状体上叶脉凸显,且根全部变白,因此筛选转基因植株的最高Hyg浓度选用10mg/L。

2.5浮萍转化体系的建立经过反复摸索,建立了浮萍的遗传转化体系。首先用含有OD值为0.5~0.8的农杆菌YEP培养液侵染浮萍愈伤组织,于28℃暗培养3 d,超声清洗愈伤组织后将其放于含有抗性的筛选培养基中进行筛选培养2~3周,直至长出绿色抗性愈伤组织,随后将其转接到再生培养基中进行再生培养3周,将再生出的苗转接到液体培养基中进行扩繁鉴定。
2.6转基因植株的鉴定
2.6.1抗性苗的筛选将再生出的苗选取单株接入含有潮霉素的筛选培养基中进行筛选,5 d后观察结果如(图6),非转基因植株变白死亡,转基因植株能适应液体环境并进行扩繁。
2.6.2GUS染色鉴定将已经扩繁的植株取一部分进行GUS染色鉴定,鉴定结果如(图7)。由图7可知,经过潮霉素筛选后的植株全为转基因植株,但是不同转基因株系的基因表达量存在一定的差异。
2.6.3分子鉴定选取长势良好、基因表达量高的3株抗性株系提取DNA和RNA,进行PCR检测,检测结果显示PCR片段大小符合实验设计(图8),初步结果表明已经获得转基因植株。

图8 转基因植株分子鉴定图
3 讨论
自从本课题组开始建立浮萍再生体系的同时,也在开始摸索建立浮萍的遗传转化体系,因为可参阅的浮萍转化方面的文献较少,期间发现有很多因素影响该体系的稳定性,通过多方面的不断摸索和优化,发现除需要注意培养温度和光周期外,以下几个因素的确定也很关键。
3.1侵染方法结合浮萍的结构特点,可以选择的植物转化技术主要包括基因枪法、化学药剂诱导法、显微注射法、激光微束穿刺法、多聚阳离子基因导入法、农杆菌转化法等。鉴于成本、技术等问题,选择农杆菌转化法进行转基因植株的获得较为普遍,应用也比较广泛,而且前期课题组已经建立了浮萍的再生体系。有研究表明不同植物对农杆菌的敏感性不同,且不同的农杆菌对植物的侵染能力也不同,因此对于浮萍来说,选择侵染效率高的农杆菌至关重要。本研究显示EHA105菌株对浮萍的侵染效率较其他菌株高。
3.2乙酰丁香酮的使用乙酰丁香酮AS是双子叶植物细胞壁合成的前体,通常单子叶植物在转化过程中不产生AS,所以在转化过程中外源添加AS可以促进根癌农杆菌感染单子叶植物。因为浮萍属于单子叶水生植物,因此,在侵染过程中加入AS是必需的,且合适浓度的AS对侵染效率很重要,本研究显示当AS浓度为100 μmol/L时,外源基因对浮萍的侵染效率最高。
3.3筛选抗生素浓度的确定当共培养结束后,植株在筛选培养基中筛选时,首先需要抑制农杆菌的生长,因此选择合适的抑菌抗生素和浓度很关键。本实验显示头孢霉素和羧苄青霉素都可以在300 mg/L时发挥很好的抑菌作用。在抑菌之后的筛选过程中,筛选具有抗性的转化材料是获得转基因植株的首要前提,因此植株抗性浓度的确定很重要,如果抗生素浓度过低,起不到筛选的作用,会出现大量假阳性植株,加大后期的工作量;若抗生素浓度太高,会将抗性植株也杀死,导致遗传转化不能顺利进行,本实验以潮霉素的研究显示,60 mg/L和10 mg/L分别是浮萍固体和液体潮霉素筛选的最佳浓度。
[1]朱晔荣,马荣,刘清岱,等.浮萍相关研究的几方面重要进展.生物学通报,2010,45(4):4.
[2]朱晔荣,李亚辉,刘苗苗,等.新型能源植物浮萍生物质能的研究与开发.自然杂志,2013,35(5):1.
[3]朱晔荣,刘苗苗,李亚辉,等.植物淀粉生物合成调节机制的研究进展.植物生理学报,2013,49(12):1.
[4]Verma R, Suthar S.Utility of Duckweeds as Source of Biomass Energy:a Review.Bioenerg.Res.2015(8):1589.
[5]Stomp A M,Rajbhandari N.Method for producing stablytransformedduckweedusingmicroprojectilebombardment.United States Patent 7161064.Publication Date.2007(1):9.
[6]Suk Min Ko,Hyeon Jin Sun,Myung Jin Oh,et al.Expression of the Protective Antigen for PEDVin Transgenic Duckweed,Lemna minor.Environment Biotechnology.2011,52(5):511.
[7]Aleksey Firsov Irina Tarasenko,Tatiana Mitiouchkinaet al.High Yield Expression of M2e Peptide of Avian Influenza VirusH5N1 in Transgenic Duckweed Plants.Biotechnology,2015(57):653.
[8]王勇,杨琳,朱晔荣,等.高效浮萍再生体系的建立:中国,CN102487827A[P]2013-5-6.

