PLFA方法研究连作对加工番茄根际土壤微生物群落结构的影响*
康亚龙, 孙文庆,刘建国,蒋桂英**
PLFA方法研究连作对加工番茄根际土壤微生物群落结构的影响*
康亚龙1,2, 孙文庆1,刘建国1,蒋桂英1**
(1. 石河子大学新疆兵团绿洲生态农业重点实验室 石河子 832003; 2. 巴州农业技术推广中心 库尔勒 841000)
通过在石河子大学农学院试验站开展加工番茄连作定点微区试验, 采用氯仿熏蒸和磷脂脂肪酸(PLFA)法相结合, 研究了不同连作处理(种植1 a、连作3 a、5 a和7 a)对新疆加工番茄花果期和成熟期根际土壤微生物群落结构及土壤微生物量的影响。结果表明, 连作导致土壤微生物量碳(SMBC)、微生物量氮(SMBN)和微生物熵(MB)下降, SMBC/SMBN升高, 而微生物量磷(SMBP)随连作年限和生育期的变化而不同。连作显著增加了真菌PLFAs含量, 降低了细菌PLFAs含量、土壤PLFAs总量及细菌/真菌PLFAs的比值, 而放线菌PLFAs含量变化无规律。连作7 a时, 成熟期的细菌PLFAs含量、土壤PLFAs总量较对照分别减少62.9%、50.3%(<0.05), 而真菌PLFAs含量较对照升高60.2%(<0.05)。从多样性指数分析看, Shannon-Wiener指数、Simpson指数、Brillouin指数和Pielou指数均随连作年限的延长呈先升后降的变化, 其中连作3 a时各项指数最大, 连作7 a时最小, 表明在本试验年限范围内, 连作使得微生物群落多样性与均匀程度皆出现了一定程度的降低。相关性分析表明, 土壤微生物各类群PLFAs量、微生物量及土壤肥力之间存在相关性, 说明土壤微生物量与土壤肥沃程度相关, 可作为评价土壤肥力的生物学指标。可见, 加工番茄连作改变了土壤微生物群落结构, 降低了土壤微生物量, 最终在根际土壤微生态系统和环境因子等因素的综合作用下产生连作障碍。
加工番茄; 连作; 土壤微生物量; 微生物群落结构; 磷脂脂肪酸分析法
作物长期连作可导致土壤微生物群落结构发生变化、土壤生物活性下降, 并最终表现为土壤养分失衡等系列问题, 而引起连作障碍的主要原因是土壤微生物群落发生了变化[1-2]。土壤微生物群落结构及种群多样性在土壤质量演变过程中起关键作用, 是土壤生态系统中预警土壤质量受损程度或恢复潜力的敏感指标[3]。新疆加工番茄(Mill.)已形成区域化布局、产业化生产的局面, 连作现象普遍, 连作障碍问题已成为限制加工番茄稳产和高产的主要原因[4]。因此, 开展加工番茄连作对根际土壤微生物群落的研究, 明确改善土壤健康状况的方向, 可促进新疆加工番茄产业的可持续发展。
有关加工番茄连作障碍成因的研究, 一方面以作物根际与土壤之间的微生态学较多。结果表明: 连作使土壤质量恶化, pH升高, 土壤养分失衡及次生盐渍化, 作物残根腐解及根系分泌的自毒物质累积, 土壤酶活性下降, 土壤由“细菌性”向“真菌型”转化, 微生物群落结构发生改变等[4-5]; 另一方面, 缺乏从土壤微生物量、微生物熵等角度分析加工番茄连作障碍问题。但是前人在研究黄瓜(L)、棉花(spp.)等作物连作时发现土壤微生物量碳(SMBC)、微生物量氮(SMBN)、微生物量磷(SMBP)及微生物熵受连作年限的影响呈下降趋势[3,6]。与传统的平板培养法相比, 磷脂脂肪酸(phospholipid fatty acids, PLFAs)法可以通过特定菌群的PLFA数量变化反映出原位土壤真菌、细菌活体生物量与菌群结构, 能够提供更多的微生物类群生物量信息, 技术成熟、分析速度快、成本低、结果稳定可靠, 近年来在微生物生态学研究中得到广泛应用[7]。前人利用PLFA分析法研究大豆(L. Merill)[8]、地黄(Libosch)[9]及桉树(Smith)[10]连作时发现土壤PLFAs总量显著降低, 真菌和细菌 PLFAs比例显著增加, 土壤微生物群落结构明显发生变化。
目前, 有关加工番茄连作障碍的研究已从土壤养分失衡、生物学环境变化及植株的化感作用等不同角度进行了报道[4-5,11], 并且利用DGGE方法[2]和稀释平板计数法[5]研究了土壤微生物群落结构及多样性的变化。但是一方面土壤微生物群落结构组成相当复杂, 数量巨大, 采用单一的传统培养法或分子生物学技术取得的土壤微生物信息并不能全面地反映自然状况下的土壤微生物群落结构变化, 这是因为土壤中可培养的微生物仅占环境微生物总数的0.1%~1%[12], 另一方面很难定量地分析土壤微生物随连作年限的演变规律。因此, 本研究采用磷脂脂肪酸分析法(PLFAs)对加工番茄种植1 a、连作3 a、5 a和7 a的定点微区根际土壤微生物群落结构进行定量分析, 同时结合氯仿熏蒸法测定土壤微生物量及微生物熵随连作年限的变化规律, 旨在揭示加工番茄在长期种植过程中根际微生物种群变化规律, 阐明加工番茄连作障碍形成机理, 研究结果为改善土壤质量、提高加工番茄产量和品质提供科学依据。
1 材料与方法
1.1 试验地概况
试验在新疆石河子大学农学院试验站(85°59′50″E, 44°18′58″N)的加工番茄连作定点微区试验田进行。试验地点海拔437~450 m, 年日照时数2 721~2 818 h, 无霜期168~171 d, ≥10 ℃年活动积温3 570~3 729 ℃, 年平均降水量208 mm, 平均蒸发量1 660 mm。属于典型的大陆性气候, 光照充足但干燥少雨, 昼夜温差大, 适合灌溉农业生产。土壤类型为典型灌耕灰漠土(Calcaric Fluvisal), 土壤质地为砂壤土。
1.2 试验设计
2007年4月在石河子大学农学院实验站选取3 a以上休闲空地, 长12 m, 宽5 m, 南北走向, 总面积为60 m2。将该空地划分成3个小区做3次重复, 每区面积均20 m2。同时, 开始种植加工番茄, 番茄主栽品种‘里格尔87–5’, 种植密度为4.8万株∙hm-2。采用机采模式, 一膜两行直播种植, 宽窄行配置80 cm+ 40 cm, 株距35 cm。7~8 d滴水1次, 共计10次, 生育期内滴水5 250 m3·hm-2。随水滴肥, 生育期内滴施纯氮(N) 207 kg·hm-2, 磷(P2O5) 84.86 kg·hm-2, 钾(K2O) 56.18 kg·hm-2。其他管理同大田生产。自2007年10月到2014年10月加工番茄收获, 连续分别形成了种植1 a (CK)、连作1 a、2 a、3 a、4 a、5 a、6 a、7 a的7个加工番茄连作处理。取CK (2007年)、连作3 a (2010年)、5 a (2012年) 和7 a (2014年) 4个加工番茄根际土壤, 分析土壤微生物量及群落多样性的变化。
1.3 供试土壤采集及预处理
于2007年、2010年、2012年和2014年加工番茄花果期(FS)和成熟期(MS), 在各小区按照5点法分别选取长势均匀的加工番茄植株15株, 然后轻微抖动根系, 收集紧附于根系不易脱落的土壤, 即为根际土[13], 充分混匀。一份土壤采集后立即过1 mm筛并存放于 4 ℃冰箱保鲜, 用于土壤微生物量碳、氮、磷含量测定; 另一份土壤置于无菌袋内带回实验室, 立即过2 mm土筛后保存于-80 ℃冰箱用于土壤磷脂脂肪酸(PLFAs)含量的分析。加工番茄不同连作地土壤的基本理化性质见表1。
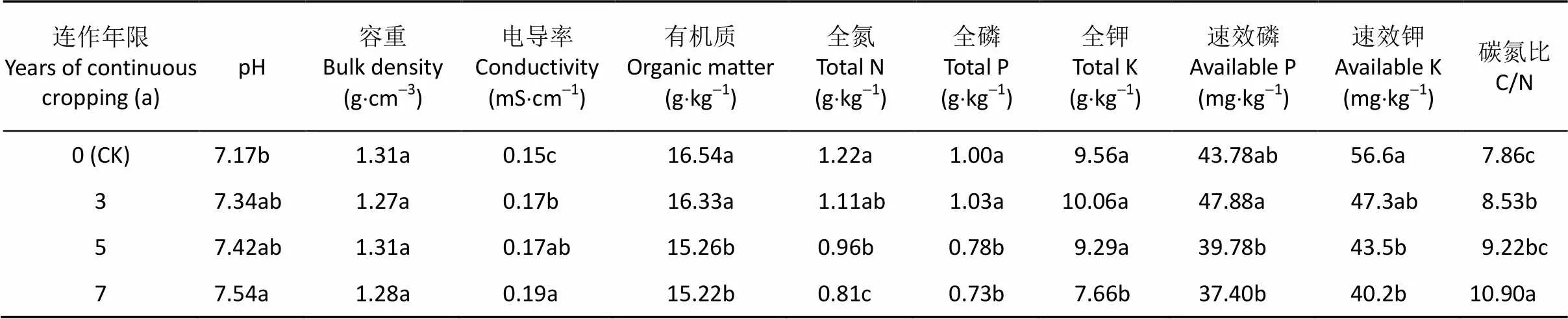
表1 不同连作年限加工番茄土壤的理化性质
表中不同小写字母表示不同连作处理间差异显著(<0.05)。Different lowercase letters within the same column indicate significant differences between different treatments (i.e., years of continuous cropping) at< 0.05.
1.4 测定项目与方法
1.4.1 微生物量及微生物熵的测定
土壤微生物量和微生物熵的测定: 采用氯仿灭菌-K2SO4提取法测定土壤微生物量碳、氮的含量[14], 土壤微生物量磷的测定采用氯仿灭菌-NaHCO3提取法[15]。微生物熵(MB)按照Anderson等[16]的方法计算, 即微生物量碳与有机碳的比值。
1.4.2 土壤磷脂脂肪酸(PLFAs)含量的测定
参照修正的Bligh-Dyer[17]方法测定土壤磷脂脂肪酸(PLFAs)含量, 分析土壤微生物群落结构。PLFAs的鉴定采用美国MIDI公司(MIDI, Newark, Delaware, USA)开发的基于细菌细胞脂肪酸成分鉴定的Sherlock MIS 4.5系统(Sherlock Microbial Identification System)。
1.4.3 微生物群落多样性指数分析
参照Garland和Mills[18]方法, 利用Shannon- Wiener多样性指数、Brillouin多样性指数、Simpson优势度指数和Pielou均匀度指数分析加工番茄连作土壤微生物群落多样性。
1.5 数据分析
采用Microsoft Excel 2010和SPSS 19.0统计分析软件进行数据处理、相关分析、方差分析、主成分分析(principal components analysis, PCA)及聚类分析(cluster analysis), 采用Duncan法进行处理间差异的多重比较。
2 结果与分析
2.1 加工番茄连作对土壤微生物量碳、氮和磷的影响
连作3 a内, 成熟期的土壤微生物量碳(SMBC)、土壤微生物量氮(SMBN)、土壤微生物量磷(SMBP)及微生物熵(MB)均大于花果期,连作5 a年后则相反(表2)。连作3 a时, 成熟期SMBC、SMBN、SMBP和MB分别是花果期的1.11倍、1.18倍、1.81倍和1.11倍, 差异极显著(0.01)。
加工番茄连作导致SMBC、SMBN和MB下降, SMBC/SMBN升高(表2)。连作7 a时, 成熟期的SMBC、SMBN和MB较对照分别降低达52.3%、78.8%和48.2%, 而SMBC/SMBN是对照的2.25倍, 差异极显著(0.01)。花果期, SMBP随连作年限的延长呈增大趋势; 成熟期, SMBP随连作年限的延长呈先升后降趋势。其中, 连作7 a时, SMBP含量较对照降低54.9%, 且花果期SMBP含量是成熟期的4.77倍, 差异极显著(0.01)。
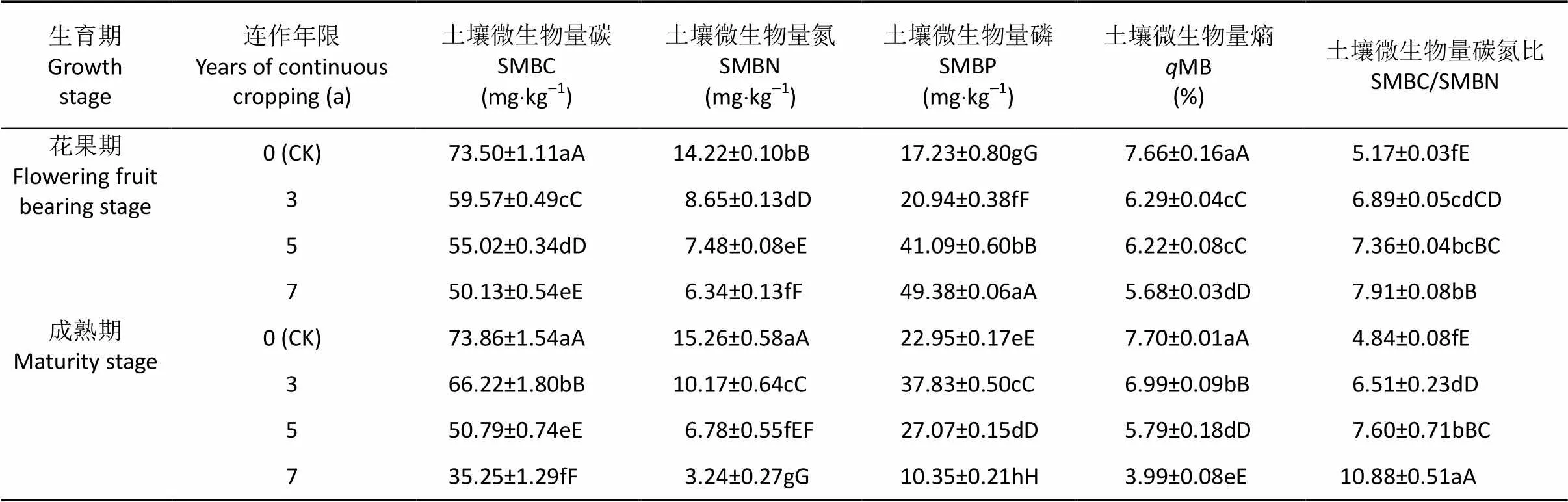
表2 不同连作年限加工番茄不同生育期根际土壤微生物量的变化
同列数值后不同大、小写字母分别表示不同连作处理间差异显著(<0.05)和极显著(<0.01)。SMBC, SMBN, SMBP andMB mean soil microbial biomass C, soil microbial biomass N, soil microbial biomass P, and soil microbial biomass entropy, respectively. Different lowercase and capital letters within the same column indicate significant differences between treatments of continuous cropping years at< 0.05 and< 0.01, respectively.
2.2 不同连作年限加工番茄根际土壤微生物的磷脂脂肪酸标记
本试验在供试土壤样品中共检测出16种PLFAs (图1)。其中, 有14种标记细菌磷脂脂肪酸, 其中标记G+细菌的PLFA有6种, 分别是12Me13:0、12Me14:0、14Me15:0、14Me16:0、i16Me17:0、17Me18:0; 标记G-细菌的PLFA有1种, 为16:1ω11c; 标记好氧细菌的PLFA有2种, 分别是16:1ω7、16:1ω9c; 标记其余细菌的PLFA有5种, 依次是14:0、15:0、16:0、17:0、20:0。此外, 放线菌有1种, 为10Me18:0; 真菌有1种, 为18:1ω9c。
加工番茄根际土壤PLFAs总量随生育期和连作年限的变化而变化(图1)。花果期, 连作3 a时土壤PLFAs标记含量最大的是14Me15:0, 其次是16:1ω9c; 成熟期, 连作7 a时土壤PLFAs标记含量最大的是18:1ω9c。整体上看, 不同连作年限下, 土壤中PLFAs标记含量最大的有14Me15:0、16:0、i16Me17:0、18:1ω9c。
2.3 连作对加工番茄土壤PLFA总量的影响
加工番茄根际土壤各类群微生物PLFAs总量随连作年限的延长呈显著下降趋势, 但随着生育期的变化则呈先升后降的规律(表3)。连作7 a时, 花果期和成熟期的土壤微生物PLFAs总量较对照分别减少了41.8%、50.3%, 差异极显著(<0.01)。土壤微生物PLFAs总量在连作5 a内的变化为成熟期>花果期, 而连作7 a时则相反(表3)。其中, 连作7 a时, 成熟期土壤微生物PLFAs总量较花果期时下降达10%。可见, 加工番茄根际土壤PLFAs总量因生育期和连作年限而表现出较大差异。
2.4 连作对加工番茄土壤主要微生物(PLFAs)含量的影响
根据不同PLFA标记类型可大致将土壤微生物类群分为细菌、真菌、放线菌和原生动物等4大类[19]。由表3可知, 不同连作年限下土壤微生物的类群包括细菌、放线菌和真菌, 未检测到原生动物。花果期和成熟期, 连作土壤中微生物PLFAs含量的高低顺序均为细菌>真菌>放线菌, 其中细菌磷脂脂肪酸占微生物PLFAs总量的69%~93%, 真菌磷脂脂肪酸占微生物PLFAs总量的5%~28%, 放线菌磷脂脂肪酸占微生物PLFAs总量的2%~26%。
i、Me、cy和a依次代表异、甲基分枝、环丙基和反异脂肪酸; ω、t和c依次代表脂肪端、反式和顺式空间构造。i, Me, cy and a respectively mean iso, methyl branching, cyclopropyl and anteiso fatty acids. ω, t and c respectively mean the aliphatic end, trans and cis configuration.

表3 加工番茄不同生育期不同连作年限根际土壤微生物类型的PLFA含量的变化
同列数值后不同大、小写字母分别表示不同连作处理间差异显著(<0.05)和极显著(<0.01)。Different lowercase and capital letters within the same column indicate significant differences between treatments of continuous cropping years at< 0.05 and< 0.01, respectively.
加工番茄连作导致细菌PLFAs含量显著下降, 真菌PLFAs含量显著升高(表3)。连作7 a时, 成熟期的细菌PLFAs含量较对照降低62.9%, 而真菌PLFAs含量较对照升高151.4%, 差异显著(<0.05)。连作3 a内, 细菌PLFAs含量变化为成熟期>花果期, 连作5 a后则相反。相同连作年限下, 真菌PLFAs含量表现为成熟期>花果期, 与放线菌PLFAs含量的变化相反(表3)。成熟期, 连作3 a时放线菌PLFAs含量达到最大值, 是对照的1.29倍, 差异极显著(<0.01)。
2.5 连作对加工番茄土壤微生物(PLFAs)含量之间比值的影响
从革兰氏阳性细菌与阴性细菌PLFAs含量的比值(G+/G-)看, 加工番茄花果期其比值随连作年限的增加呈先升后降的变化, 与成熟期其比值变化相反(图2)。花果期, 连作3 a时G+/G-值最大为12.65, 是对照的1.6倍, 差异极显著(<0.01)。成熟期, 连作7 a时G+/G-值达到最大值22.38, 是对照的3.3倍, 差异极显著(<0.01)。
细菌与真菌的PLFAs比值(用B/F表示)是表征土壤生态系统缓冲能力的重要指标[20]。加工番茄连作导致B/F值显著降低, 且B/F值在生育期的大小顺序为花果期>成熟期(图2)。连作7 a时, 花果期和成熟期的B/F值较对照分别降低71.1%、93.5%, 差异极显著(<0.01)。可见, 加工番茄在成熟期时土壤生态系统应对连作的缓冲能力最弱。
不同大、小写字母分别表示不同连作处理间差异显著(<0.05)和极显著(<0.01)。Different lowercase and capital letters indicate significant differences between treatments of continuous cropping years at< 0.05 and< 0.01, respectively.
2.6 加工番茄连作土壤中微生物磷脂脂肪酸的主成分分析
由图3可知, PC1解释了连作年限64.92%的变异, PC2解释了连作年限23.55%的变异。可见, PC1和PC2基本上能把连作处理下根际土壤微生物群落PLFA区分开。进一步分析发现, 种植1 a(CK)的磷脂脂肪酸投影点在PCA图中的分布最集中, 相距最近, 说明花果期和成熟期的根际土壤微生物群落结构非常相似。连作3 a后土壤微生物PLFAs投影点在主成分分析图中的分布较分散, 相距较远, 说明连作导致加工番茄不同生育期根际土壤微生物群落组成差异很大。
对16种磷脂脂肪酸进行主成分分析(图4), 结果发现PC1和PC2可以解释总变异的82.51%, 其中PC1占58.46%, PC2占24.05%。采用方差极大正交旋转法进一步分析发现, PC1的代表因子有5个变量, 分别是12Me14:0、17Me18:0、14Me15:0、16:1ω7、12Me13:0(载荷值>0.800); PC2的代表因子有6个变量, 分别是20:0、14:0、16:1ω9c、i16Me17:0、10Me18:0、17:0(载荷值>0.800)。连作导致标记细菌的特有磷脂脂肪酸14Me15:0、16:0含量减少, 标记真菌的特征磷脂脂肪酸18:1ω9c含量增加。可见, 加工番茄连作土壤有真菌化的趋势。
2.7 加工番茄连作土壤中微生物群落磷脂脂肪酸标记的聚类分析
当欧氏距离为10时, 各处理的土壤PLFAs生物标记均可分成3个大的类群(图5)。类型Ⅰ包括的土壤PLFAs生物标记有12Me13:0、14:0、12Me14:0、15:0、16:1ω7、16:1ω9c、16:1ω11c、14Me16:0、17:0、i16Me17:0、10Me18:0、17Me18:0、20:0, 其特征为在加工番茄连作7 a内分布不均匀且分布量偏低; 类型Ⅱ包括PLFAs生物标记是14Me15:0、18:1ω9c, 其表现为完全分布且分布量较高; 只有16:0属于类型Ⅲ, 其特征是完全分布且分布量最高。可见, 在试验的年限内, 加工番茄连作虽然未明显改变土壤微生物PLFAs不同标记物的聚类优势类群, 但是显著地导致优势类群的分布量下降。
a: 12Me13:0; b: 14:0; c: 12Me14:0; d: 15:0; y: 14Me15:0; f: 16:0; g: 16:1ω7; h: 16:1ω9c; i: 16:1ω11c; j: 14Me16:0; k: 17:0; l: i16Me17:0; m: 18:1ω9c; n: 10Me18:0; o: 17Me18:0; p: 20:0.
2.8 加工番茄连作根际土壤微生物群落多样性分析
Shannon-Wiener指数、Brillouin指数和Simpson指数均随加工番茄连作年限的延长呈先升后降的变化(表4), 其中连作3 a时其根际土壤微生物各项指数最大, 连作7 a最小, 说明连作3 a内有利于根际土壤微生物种类的增多和群落丰富度的提高, 但当连作超过3 a时土壤微生物多样性出现一定程度的下降, 微生物个体数量在减少。
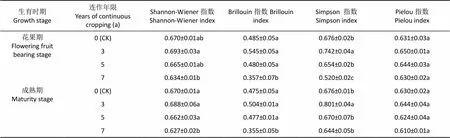
表4 不同连作年限加工番茄不同生育期根际土壤微生物群落多样性指数
同列数值后不同小写字母表示不同连作处理间差异显著(<0.05)。Different lowercase letters within the same column indicate significant differences between treatments of continuous cropping years at< 0.05.
从加工番茄生育期看, Shannon-Wiener指数和Brillouin指数的变化呈花果期>成熟期, 而Simpson优势度指数则相反。这可能是在新疆, 加工番茄收获后进入漫长寒冷的冬季, 土壤中残存的根茬、枯叶和残枝等几乎不分解, 到翌年夏初时节, 地温快速回升, 微生物的活动趋于旺盛, 加速了残根枯叶的腐解, 同时植株生长进入旺季, 根系分泌物增多, 增加了土壤中可供微生物利用的碳源、氮源, 刺激和加速微生物的代谢活动, 提高了土壤微生物多样性, 也使得某些微生物类群成为优势菌群; 然而, 当加工番茄处于成熟期时, 气候依然较热, 地温变化不大, 但根系分泌物减少在一定程度上造成微生物多样性有所降低。
Pielou均匀度指数表示生物物种在群落中的相对密度, 均匀度指数高, 相对密度大[20]。由表4可知, 均匀度指数在连作3 a时最大, 连作7 a最小, 但各处理间差异不显著, 说明连作超过3 a后导致均匀度指数出现一定程度的下降, 但土壤微生物类群在群落中的相对密度并没有明显改变。
2.9 加工番茄连作土壤理化性质与土壤生物活性的相关性
2.9.1 土壤理化性状与土壤微生物量的相关性
由相关性可知, pH对土壤微生物量有显著抑制作用(<0.05), 不利于微生物的繁殖与生存。土壤主要养分与微生物量、MB呈显著或极显著正相关。细菌PLFAs及土壤总PLFAs与土壤有机质、全氮、全磷、速效钾含量存在极显著正相关(<0.01); 真菌PLFAs与土壤主要养分极显著负相关(<0.01); 全钾、速效磷含量与放线菌PLFAs呈极显著正相关(表5)。可见, 加工番茄土壤各菌群 PLFAs可用作表征土壤肥力的重要指标, 而且土壤养分含量的高低也直接影响到土壤微生物数量和种类的多少。

表5 加工番茄连作土壤理化性质与根际土壤微生物PLFAs的相关关系
*和**分别表示在<0.05和<0.01水平显著相关。* and ** mean significant correlation at 0.05 and 0.01 levels, respectively.
2.9.2 土壤微生物量与根际土壤微生物PLFAs的相关性
将PLFAs分析法测得的土壤微生物PLFAs含量与氯仿熏蒸法测得的土壤微生物量的结果进行相关分析(表6), 结果表明: 真菌PLFAs量与SMBC、SMBN、SMBP及MB呈显著或极显著负相关(< 0.01); 细菌PLFAs总量、细菌/真菌的PLFAs比值及土壤总PLFAs与SMBC、SMBN和MB之间呈极显著正相关, 而与SMBC/SMBN极显著负相关(< 0.01); 放线菌PLFAs与SMBP达到极显著正相关(=0.963,<0.01)。可见, 采用这两种方法测定加工番茄连作对土壤微生物的影响时结果具有一致性, 表现为连作显著减少了土壤微生物量。因此, 将土壤熏蒸法与磷脂脂肪酸分析法相结合可以更加有效、准确地从土壤微生物量受连作影响而变化的角度揭示连作障碍发生机理。

表6 土壤微生物量与根际土壤微生物PLFAs的相关关系
SMBC、SMBP和MB分别为土壤微生物量氮、土壤微生物量磷和土壤微生物熵。*和**分别表示在<0.05和<0.01水平显著相关。SMBC, SMBN, SMBP andMB mean soil microbial biomass C, soil microbial biomass N, soil microbial biomass P, and soil microbial biomass entropy, respectively.* and ** mean significant correlation at 0.05 and 0.01 levels, respectively.
3 讨论与结论
3.1 加工番茄连作对土壤微生物量的影响
微生物生物量反映着土壤有效养分含量、生物活性和能量循环[20]。本试验结果表明, 加工番茄长期连作明显降低了土壤微生物生物量, 这与前人研究黄瓜、棉花、大豆等长期连作对土壤生物活性的影响结果相一致[3,6]。这是因为一方面, 土壤长期在人为翻耕等剧烈的农作措施下, 表层土侵蚀严重, 加速有机物质的矿化, 同时加工番茄收获时将秸秆等移除田外, 直接减少了土壤腐殖质的形成, 使得土壤中可供微生物利用的碳源、氮源减少, 不利于微生物的繁殖与活动; 另一方面, 长期连作使得根系分泌的自毒物质在土壤中不断累积, 土壤pH升高, 促使土壤呈真菌化, 改变了土壤微生物区系[1-3], 也不利于土壤微生物生长, 最终引起根际微生物总量下降。
微生物熵(MB)反映微生物利用碳源、氮源的效率, 可揭示加工番茄连作根际土壤生物学性质的变异情况[16]。本研究结果表明, 加工番茄连作引起MB减小, 说明加工番茄长期连作一方面使土壤中土壤活性有机碳含量不断降低, 有机碳周转速率减缓, 不利于土壤矿物对有机质的固定, 造成一定的土壤碳、氮损失; 另一方面, 长期连作造成组成微生物的碳氮等成分比例失衡, 导致微生物在需求外界能源时也有所差异, 从而在整体上影响到MB的大小[16], 最终反映出土壤微生物区系的变化[2-3]。
土壤微生物量碳氮比(SMBC/SMBN)的变化与土壤微生物群落结构变化有关[21]。本研究结果表明, SMBC/SMBN在加工番茄长期连作条件下呈增大趋势, 变化范围为4.84~10.88。一般情况下, 真菌的C/N值一般为7~12, 细菌为3~6[22]。可见, 加工番茄连作年限越长, 土壤由细菌型向真菌型转化, 导致地力衰竭, 连作障碍明显, 这与前人等的研究结果相一致[2-3]。前人研究也认为作物根系分泌物的种类、数量会改变根际土壤微生物区系组成, 使得根际土壤微生物种群平衡遭到破坏, 有害菌大量繁殖, 有益菌明显减少, 最终表现出连作障碍[23-24]。
3.2 加工番茄连作根际土壤微生物群落结构变化
利用磷脂脂肪酸谱图分析法可以准确客观地判断土壤中微生物量的变化情况, 揭示微生物群落结构的差异性, 对研究土壤环境的质量变化具有重要作用。本研究表明, 加工番茄不同年限土壤中所含PLFAs的种类相同, 共检测到13种PLFA生物标记, 但其含量存在显著差异, 即土壤的PLFAs总量对照> 连作3 a>连作5 a>连作7 a, 说明长期连作造成土壤微生物量的急剧下降, 这与前人研究大豆[25]、玉米[10]连作时发现土壤微生物量有所下降的结果相一致。原因是长期高强度的农业耕作措施破坏了土壤稳定结构, 减小底物的丰度和均匀度, 不利于土壤微生物的代谢, 导致微生物多样性减少, 最终表现为土壤微生物量的降低。
本研究发现, 加工番茄连作对根际土壤中指示不同微生物类群的PLFAs含量的影响也存在显著差异。长期连作导致土壤细菌和放线菌PLFAs含量降低, 真菌PLFAs含量升高, 说明连作后根际土壤由细菌型向真菌型转化, 与前人的研究结果一致[2-3]。有研究认为, 连作后根系分泌物的数量增多会诱导土壤真菌数量的增加[23]。从细菌与真菌的PLFAs比值看, 加工番茄连作显著降低了细菌与真菌的PLFAs比值, 说明加工番茄土壤的生态系统稳定性在连作影响下逐渐降低, 表明长期连作导致土壤抗逆境胁迫的缓冲能力减弱, 从而表现出连作障碍。Li等[26]在研究大豆连作时认为根际土壤微生物群落结构的改变是根系分泌的化感物质引起的, 且其根际化感物质黄酮含量与土壤微生物群落存在正相关[10]。研究发现, 加工番茄化感作用明显, 主要化感物质有邻苯二甲酸、苯甲酸和肉桂酸等[27], 但这些化感物质含量的多少是否也与土壤微生物群落结构存在相关性, 有待今后进一步的研究。
3.3 土壤微生物生物量与土壤理化性质的相关性
本试验在利用熏蒸法对土壤中整体微生物量进行测定的同时, 采用磷脂脂肪酸分析法研究了特定菌群生物量, 将该两种方法结合起来有助于更加全面地说明土壤微生物量的情况。研究发现, 真菌PLFAs总量与土壤微生物量呈极显著负相关(<0.01), 这与Zhao等[28]的研究结果不一致, 原因是选取的土壤样品、试验处理等不同, 但可以推断土壤微生物量的变化主要是源于土壤中细菌、真菌数量的变化, 导致二者变化趋势显著相关。细菌PLFAs总量、土壤PLFAs总量与土壤微生物量碳氮均呈极显著正相关(<0.01), 放线菌PLFAs含量与土壤微生物量磷极显著正相关(=0.963 0,<0.01)。这与前人研究认为的在农田土壤生态系统中, 土壤微生物多样性与微生物生物量之间显著相关的结论相符合[3,25]。
土壤微生物最主要的3大类群细菌、真菌和放线菌构成了主要的土壤微生物生物量, 其区系组成和数量的变化表征着土壤生物活性大小。本试验相关分析表明, 真菌PLFAs与土壤主要养分之间显著或极显著负相关, 细菌PLFAs和土壤总PLFAs与有机质、全氮含量存在极显著正相关(<0.01)。一方面, 意味着有机质和全氮可能是影响土壤微生物生长的主要因素, 可以用土壤总PLFAs量、细菌和真菌PLFAs量来反映土壤碳、氮水平; 另一方面, 加工番茄长期连作土壤趋于贫瘠化, 有机质和全氮含量下降, 抑制了细菌、放线菌的生长, 使得细菌、放线菌的生物量减小, 说明土壤微生物量与土壤肥力相关[29]。相反, 真菌的生长并没有受到连作土壤贫瘠化的影响, 而是表现为真菌生物量的不断增加, 这是因为已有研究发现真菌较细菌更能适应养分贫瘠的土壤[30]。
4 结论
本试验的年限范围内, 加工番茄连作导致细菌PLFAs含量、土壤微生物量及微生物熵下降, 真菌PLFAs含量升高, 土壤由“细菌型”趋向“真菌型”, 使得土壤微生物多样性与均匀度皆出现了一定程度的降低, 土壤微生物活性受到抑制, 从而不利于土壤养分的转化和利用, 最终表现出连作障碍。土壤微生物各类群PLFAs量、微生物量及土壤肥力之间存在相关性, 表明土壤微生物量与土壤的肥沃程度相关, 可作为评价土壤肥力的生物学指标。
[1] 秦越, 马琨, 刘萍. 马铃薯连作栽培对土壤微生物多样性的影响[J]. 中国生态农业学报, 2015, 23(2): 225-232 Qin Y, Ma K, Liu P. Effect of potato continuous cropping on genetic diversity of soil microorganisms[J]. Chinese Journal of Eco-Agriculture, 2015, 23(2): 225-232
[2] 马宁宁, 李天来. 设施番茄长期连作土壤微生物群落结构及多样性分析[J]. 园艺学报, 2013, 40(2): 255–264 Ma N N, Li T L. Effect of long-term continuous cropping of protected tomato on soil microbial community structure and diversity[J]. Acta Horticulturae Sinica, 2013, 40(2): 255–264
[3] Zhou X G, Gao D M, Liu J, et al. Changes in rhizosphere soil microbial communities in a continuously monocropped cucumber (L.) system[J]. European Journal of Soil Biology, 2014, 60: 1–8
[4] 康亚龙, 景峰, 孙文庆, 等. 加工番茄连作对土壤理化性状及微生物量的影响[J]. 土壤学报, 2016, 53(2): 533–542 Kang Y L, Jing F, Sun W Q, et al. Effects of continuous cropping of processing tomato on physical-chemical properties of and microbial biomass in the soil[J]. Acta Pedologica Sinica, 2016, 53(2): 533–542
[5] 孙艳艳, 蒋桂英, 刘建国, 等. 加工番茄连作对农田土壤酶活性及微生物区系的影响[J]. 生态学报, 2010, 30(13): 3599–3607 Sun Y Y, Jiang G Y, Liu J G, et al. Effects of continuous cropping tomato for processing on soil enzyme activities and microbial flora[J]. Acta Ecologica Sinica, 2010, 30(13): 3599–3607
[6] 刘瑜, 梁永超, 褚贵新, 等. 长期棉花连作对北疆棉区土壤生物活性与酶学性状的影响[J]. 生态环境学报, 2010, 19(7): 1586–1592 Liu Y, Liang Y C, Chu G X, et al. Effects of long-term cotton monocropping on soil biological characteristics and enzyme activities in Northern Xinjiang[J]. Ecology and Environmental Sciences, 2010, 19(7): 1586–1592
[7] 赵帅, 张静妮, 赖欣, 等. 放牧与围栏内蒙古针茅草原土壤微生物生物量碳、氮变化及微生物群落结构PLFA分析[J]. 农业环境科学学报, 2011, 30(6): 1126–1134 Zhao S, Zhang J N, Lai X, et al. Analysis of microbial biomass C, N and soil microbial community structure ofsteppes using PLFA at grazing and fenced in Inner Mongolia, China[J]. Journal of Agro-Environment Science, 2011, 30(6): 1126–1134
[8] Guo Z Y, Kong C H, Wang J G, et al. Rhizosphere isoflavones (daidzein and genistein) levels and their relation to the microbial community structure of mono-cropped soybean soil in field and controlled conditions[J]. Soil Biology and Biochemistry, 2011, 43(11): 2257–2264
[9] 吴林坤, 黄伟民, 王娟英, 等. 不同连作年限野生地黄根际土壤微生物群落多样性分析[J]. 作物学报, 2015, 41(2): 308-317 Wu L K, Huang W M, Wang J Y, et al. Diversity analysis of rhizosphere microflora of wildgrown in monocropping for different years[J]. Acta Agronomica Sinica, 2015, 41(2): 308–317
[10] Chen F L, Zheng H, Zhang K, et al. Soil microbial community structure and function responses to successive planting of[J]. Journal of Environmental Sciences, 2013, 25(10): 2102–2111
[11] 康亚龙, 刘彦荣, 刘建国, 等. 连作对加工番茄植株生理活性和物质生产的影响[J]. 中国生态农业学报, 2015, 23(3): 319–328 Kang Y L, Liu Y R, Liu J G, et al. Physiological activity and material production in processing tomato under continuous cropping[J]. Chinese Journal of Eco-Agriculture, 2015, 23(3): 319–328
[12] Bakken L R. Separation and purification of bacteria from soil[J]. Applied and Environmental Microbiology, 1985, 49(6): 1482–1487
[13] 中国科学院南京土壤研究所微生物室. 土壤微生物研究法[M]. 北京: 科学出版社, 1985: 65–83 Microbiology Laboratory in Institute of Soil Science, Chinese Academy of Sciences. Methods for Studying Soil Microbe[M]. Beijing: China Science Press, 1985: 65–83
[14] 林启美, 吴玉光, 刘焕龙. 熏蒸法测定土壤微生物量碳的改进[J]. 生态学杂志, 1999, 18(2): 63–66 Lin Q M, Wu Y G, Liu H L. Modification of fumigation extraction method for measuring soil microbial biomass carbon[J]. Chinese Journal of Ecology, 1999, 18(2): 63–66
[15] Brookes P C, Powlson D S, Jenkinson D S. Measurement of microbial biomass phosphorus in soil[J]. Soil Biology and Biochemistry, 1982, 14(4): 319–329
[16] Anderson J P E, Domsch K H. A physiological method for the quantitative measurement of microbial biomass in soils[J]. Soil Biology and Biochemistry, 1978, 10(3): 215–221
[17] Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911–917
[18] Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environment Microbiology, 1991, 57(8): 2351–2359
[19] Frostegård A, Bååth E. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil[J]. Biology and Fertility of Soils, 1996, 22(1/2): 59–65
[20] Bossio D A, Girvan M S, Verchot L, et al. Soil microbial community response to land use change in an agricultural landscape of western Kenya[J]. Microbial Ecology, 2005, 49(1): 50–62
[21] Fang S Z, Liu D, Tian Y, et al. Tree species composition influences enzyme activities and microbial biomass in the rhizosphere: A rhizobox approach[J]. PLoS One, 2013, 8(4): e61461
[22] Bonde T A, Schnürer J, Rosswall T. Microbial biomass as a fraction of potentially mineralizable nitrogen in soils from long-term field experiments[J]. Soil Biology and Biochemistry, 1988, 20(4): 447–452
[23] Zhou X, Wu F. Artificially applied vanillic acid changed soil microbial communities in the rhizosphere of cucumber (L.)[J]. Canadian Journal of Soil Science, 2013, 93(1): 13–21
[24] 王茹华, 张启发, 周宝利, 等. 浅析植物根分泌物与根际微生物的相互作用关系[J]. 土壤通报, 2007, 38(1): 167–172 Wang R H, Zhang Q F, Zhou B L, et al. Analysis on the interaction between root exudates and rhizosphere microbes[J]. Chinese Journal of Soil Sciences, 2007, 38(1): 167–172
[25] 谷岩, 邱强, 王振民, 等. 连作大豆根际微生物群落结构及土壤酶活性[J]. 中国农业科学, 2012, 45(19): 3955–3964 Gu Y, Qiu Q, Wang Z M, et al. Effects of soybean continuous cropping on microbial and soil enzymes in soybean rhizosphere[J]. Scientia Agricultura Sinica, 2012, 45(19): 3955–3964
[26] Li C G, Li X M, Kong W D, et al. Effect of monoculture soybean on soil microbial community in the Northeast China[J]. Plant and Soil, 2010, 330(1/2): 423–433
[27] 李志宏, 秦勇, 彭思健, 等. 加工番茄植株残体腐解物化感作用的研究[J]. 中国农学通报, 2008, 24(6): 306–309 Li Z H, Qin Y, Peng S J, et al. Allelopathy of decomposing processing tomato plant residue on processing tomato growth[J]. Chinese Agricultural Science Bulletin, 2008, 24(6): 306–309
[28] Zhao J, Zeng Z X, He X Y, et al. Effects of monoculture and mixed culture of grass and legume forage species on soil microbial community structure under different levels of nitrogen fertilization[J]. European Journal of Soil Biology, 2015, 68: 61–68
[29] 罗世琼, 黄建国, 袁玲. 野生黄花蒿土壤的养分状况与微生物特征[J]. 土壤学报, 2014, 51(4): 868–879 Luo S Q, Huang J G, Yuan L. Nutrients and microorganisms in soils with wildL.[J]. Acta Pedologica Sinica, 2014, 51(4): 868–879
[30] Ding X F, Wu C D, Huang J, et al. Interphase microbial community characteristics in the fermentation cellar of Chinese-flavor liquor determined by PLFA and DGGE profiles[J]. Food Research International, 2015, 72: 16–24
Microbial community structure in rhizosphere soils of long-term continuously cropped processing tomato based on PLFA method*
KANG Yalong1,2, SUN Wenqing1, LIU Jianguo1, JIANG Guiying1**
(1. Laboratory of Oasis Ecology Agriculture of Xinjiang Bingtuan, Shihezi University, Shihezi 832003, China; 2.BavariaAgricultural Technology Promotion Center, Kuerle 841000, China)
Xinjiang Uygur Autonomous Region is a major production base of processing tomato in China. In the effort to meet market demand for processing tomato, mono-cropping has been widely adopted. Unfortunately, this phenomenon has become the dominant factor limiting the stable production and yield of tomato in the region. Here, we conducted a field study to determine the impact of continuous cropping over the long-term on microbe community structurein rhizosphere soil of processing tomato using phospholipid fatty acid (PLFA) and chloroform fumigation extraction method. The mono-cropping field experiment started in 2007 at a station belonging to the College of Agriculture of Shihezi University. The processing tomato cultivar used in the experiment was ‘Ligeer 87-5’. Soil samples were collected for analysis from plots with different cultivation histories (3, 5 and 7 years of continuous cropping) and a control plot that was under fallow for 3 years. The results showed that soil microbial biomass C (SMBC), soil microbial biomass N (SMBN) and soil microbial biomass entropy(MB) significantly decreased, while soil microbial biomass C/N increased with increasing duration of continuous cropping (0.05). However, soil microbial biomass P (SMBP) exhibited a different response to both continuous cropping and various growth stages. PLFA analysis indicated that continuous cropping significantly increased fungal PLFAs, whereas the reverse trend was observed for bacterial PLFAs, total PLFAs and the ratio of bacterial PLFAs to fungal PLFAs. However, actinomycetous PLFAs had no regular change with increasing duration of continuous cropping. After 7 years of continuous cropping, bacterial PLFAs and total PLFAs amount decreased by 62.9% and 50.3% (0.05), respectively, but fungal PLFAs amount significantly increased by 60.2% compared with control. Based on diversityindex analysis, Shannon-Wiener index, Simpson index, Brillouin index and Pielou index all initially increased and then decreased with increasing years of continuous cropping of processing tomato. Soil microbial diversityindex was highest in the treatment of 3 years continuous cropping and was lowest for the treatment of 7 years continuous cropping.It was concluded that microbial community diversity and uniformity decreased with increasing of continuous cropping years in this area. Correlation analysis showed significant correlation among PLFAs of bacteria, fungi and actinomycetes, total PLFAs, soil microbial biomass and soil fertility, which indicated that soil microbial biomass was highly related with soil fertility. Therefore, soil microbial biomass could be used as an available biological index for the evaluation of soil fertility. The results suggested that years of mono-cropping had a major influence on microbial community structure and soil microbial biomass in rhizosphere soil of processing tomato, which in turn limited sustainable development of processing tomato.
Processing tomato; Continuous cropping; Soil microbial biomass; Microbial community structure; Phospholipid fatty acid biomarker
10.13930/j.cnki.cjea.160844
S311; S314
A
1671-3990(2017)04-0594-11
2016-09-19
2016-11-23
Sep. 19, 2016; accepted Nov. 23, 2016
* 国家自然科学基金项目(31260142)资助
* This work was supported by the National Natural Science Foundation of China (31260142).
** Corresponding author, E-mail: jgy67@126.com
**通讯作者:蒋桂英, 主要从事农田生态环境与作物生理研究。E-mail: jgy67@126.com
康亚龙, 研究方向为作物生理生态。E-mail: 1175015468@qq.com
康亚龙, 孙文庆, 刘建国, 蒋桂英. PLFA方法研究连作对加工番茄根际土壤微生物群落结构的影响[J]. 中国生态农业学报, 2017, 25(4): 594-604
Kang Y L, Sun W Q, Liu J G, Jiang G Y. Microbial community structure in rhizosphere soils of long-term continuously cropped processing tomato based on PLFA method[J]. Chinese Journal of Eco-Agriculture, 2017, 25(4): 594-604

