液相与气相碳四烷基化反应热力学的异同
李玉新
(中国石化 工程建设有限公司, 北京 100101)
液相与气相碳四烷基化反应热力学的异同
李玉新
(中国石化 工程建设有限公司, 北京 100101)
针对异丁烷和2-丁烯烷基化反应过程,进行了液相和气相反应的热力学计算,包括反应焓、吉布斯自由能、热力学常数及平衡组成。分析了液相碳四烷基化与气相碳四烷基化反应热力学的异同。结果表明,液相碳四烷基化反应的平衡常数比气相的高3~5个数量级,表明烷基化反应在液相条件下更容易自发进行。液相碳四烷基化的三甲基戊烷(TMP)平衡选择性高于气相的。气相烷基化反应产物的平衡选择性对温度和压力的变化更敏感。正丁烷的添加对气相和液相2种碳四烷基化反应条件下的平衡选择性和平衡转化率均无影响。从热力学角度看,碳四烷基化反应更适宜在液相条件下进行。
碳四烷基化; 热力学; 液相反应; 气相反应
在石油炼制过程中,加氢裂化、催化裂化和焦化加工过程常常副产大量饱和或不饱和液化气。如何进一步高效利用这些副产的轻烃资源,提高其附加值,一直是炼油化工企业进行加工总流程优化的重点。在炼油化工一体化企业中,通常将饱和液化气(含丙烷)作为乙烯裂解原料,丙烯作为下游的化工原料,碳四作为生产甲基叔丁基醚(MTBE)和烷基化油的原料。与其他汽油调合组分(催化汽油、芳烃重整油、轻石脑油和MTBE等)相比,烷基化油具有高辛烷值(RON约为95),且不含芳烃、烯烃、硫、氧等杂质,被视为理想的汽油调合组分[1]。随着环保要求的日益严格,汽油中的烯烃、芳烃、苯含量等多项环保指标将更加严苛。正在实施的国Ⅴ车用汽油排放标准限制汽油烯烃体积分数不超过24%,芳烃体积分数不超过40%;正在制定的国Ⅵ车用汽油排放标准和京Ⅵ车用汽油排放标准将可能要求汽油烯烃体积分数不大于15%,芳烃体积分数不大于35%。因此,烷基化工艺已越来越受炼油厂的青睐。
目前,烷基化工艺主要采用液体酸催化烷基化技术,包括硫酸法和氢氟酸法[2-3],以及复合离子液体法[4]。虽然固体酸催化剂可以解决液体酸污染等问题,但是容易结焦失活,工业化进程缓慢。液体酸催化剂仍然是烷基化工艺的首选,其反应温度均低于303.15 K,且在液相条件下进行,反应压力大于相应温度下反应物料的饱和蒸气压。
对于气相烷基化反应热力学讨论较多[5-6],对于液相烷基化热力学及与气相烷基化热力学对比的研究比较少。笔者对液相碳四烷基化反应进行了较全面的热力学计算,并且与气相反应对比,讨论了温度、压力、惰性组分对液相和气相烷基化平衡组成的影响,不但弥补了液相烷基化热力学数据的不足,亦为异丁烷与丁烯的烷基化反应研究提供更多参考。
1 碳四烷基化反应组分的确定及物性
在强酸的催化作用下,碳四烷基化的主反应为异丁烷(i-C4H10)与2-丁烯(2-C4H8)反应生成C8烷烃(三甲基戊烷,简称TMP),副反应包括裂化、歧化、聚合、异构化,生成较多的C8异构体,并有一定量的C5~C7小分子和C9+的较大分子产物。为了简化计算,通常忽略叠合等副反应[5],只考虑生成C8烷烃的烷基化反应。液体酸法烷基化反应产物分布中,C8组分主要为4种TMP同分异构体(2,3,3-TMP、2,3,4-TMP、2,2,3-TMP、2,2,4-TMP)和4种二甲基己烷(DMH)同分异构体(2,4-DMH、2,5-DMH、2,3-DMH、3,4-DMH);与TMP和DMH相比,甲基庚烷(MH)可以忽略[11],计算中主要考虑上述几种TMP和DMH的同分异构体。
表1和表2分别列出了气相和液相碳四烷基化反应的组分的热力学参数。在气相反应中,比热容为温度的函数,如式(1)所示,A、B、C和D数值列于表1;在液相反应中,比热容变化很小,在本计算温度范围内可以忽略不计。
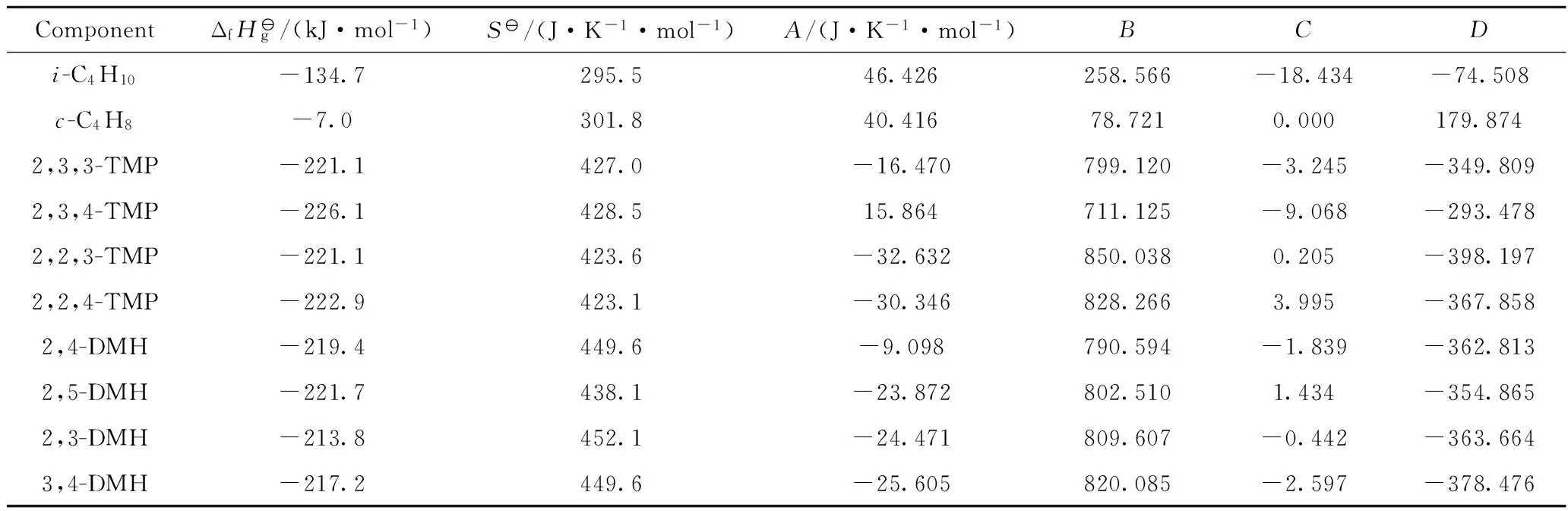
Cp=A+B×10-3T+C×105T-2+D×10-6T2 (1)

表2 碳四液相烷基化反应组分热力学性质数据[7-8]Table 2 Thermodynamic data of components in C4 liquid-phase alkylation [7-8]
2 碳四烷基化的反应焓、吉布斯自由能和反应平衡常数
反应焓为温度的函数,由基希霍夫公式表示,如式(2)所示。其中,ΔrCp为生成物热容与反应物热容之差,由式(3)表示。将式(3)代入式(2),可得到不定积分式(4)。
dΔrH/dT=ΔrCp
(2)
ΔrCp=ΔA+ΔB×10-3T+
ΔC×105T-2+ΔD×10-6T2
(3)
(4)
式(4)中,M为积分常数,将某一温度下的标准反应焓代入,即可求出。
反应熵随温度的变化由式(5)计算。将式(3)代入式(5),可得不定积分式(6)。
dΔrS/dT=ΔrCp/T
(5)
(6)
式(6)中,N为积分常数,将某一温度下的标准反应熵代入,即可求出。
反应吉布斯自由能与焓和熵的关系如式(7)所示。反应平衡常数可通过定义式(8)得到。
ΔrG=ΔrH-TΔrS
(7)
lnK=-ΔrG/RT
(8)
根据异丁烷、2-丁烯和生成物TMP、DMH的A、B、C、D值,结合标准反应生成焓及熵的数值,求解式(4)、式(7)、式(8),可得到不同反应温度下,碳四气相和液相烷基化反应的ΔrH、ΔrG和K,结果分别列于表3~表7。根据计算式中系数的适用范围,气相体系的温度计算范围取273.15~473.15 K,液相体系计算温度范围取273.15~303.15 K。

表3 不同温度下碳四气相烷基化反应焓(ΔrHg)Table 3 Enthalpies (ΔrHg) of gas-phase C4 alkylation at different temperatures

表4 不同温度下碳四液相烷基化反应焓(ΔrHl)Table 4 Enthalpies(ΔrHl) of liquid-phase C4 alkylation at different temperatures
由表3、表4可以看出,碳四烷基化反应焓均为负值,说明不同反应温度下均为放热反应。在可比温度下,气相烷基化反应焓的绝对值高于液相反应3~7 kJ/mol,说明气相体系烷基化的反应热高于液相。并且,随着反应温度的增加,气相体系的ΔrHg的绝对值逐渐减小,放热量逐渐减小;随着反应温度的增加,液相体系的ΔrHl的绝对值逐渐增加,放热量逐渐增加。
由表5、表6可以看出,在计算温度范围内,ΔrGg大多数是负值,而ΔrGl均为负值。在2种体系中,随着反应温度的升高,吉布斯自由能ΔrG均逐渐增大。气相体系中,当反应温度为473.15 K时,生成2,2,4-TMP和2,2,3-TMP的ΔrGg为正值,说明该反应已不能自发进行了。在可比温度下,生成C8烷烃的ΔrGl比ΔrGg低0.6~1.0倍,说明碳四烷基化反应在液相条件下更容易进行。

表5 不同温度下碳四气相烷基化反应吉布斯自由能(ΔrGg)Table 5 Gibbs energies(ΔrGg) of gas-phase C4 alkylation at different temperatures

表6 不同温度下碳四液相烷基化反应吉布斯自由能(ΔrGl)Table 6 Gibbs energies(ΔrGl) of liquid-phase C4 alkylation at different temperatures

表7 碳四气相和液相烷基化反应平衡常数(K)Table 7 Equilibrium constants(Kg, Kl) of gas-phase and liquid-phase C4 alkylations
由表7可见,碳四液相烷基化反应的平衡常数比气相烷基化反应高3~5个数量级,说明碳四液相烷基化反应更容易进行。随着反应温度的升高,两体系的平衡常数均逐渐减小,反应温度从273.15 K升至303.15 K,烷基化平衡常数减小了1~2个数量级。碳四液相烷基化反应平衡常数在303.15 K仍保持108~1010量级,说明碳四液相烷基化反应平衡程度很高。
3 碳四烷基化的反应平衡
3.1 反应温度的影响
碳四烷基化产物中几种TMP的辛烷值很接近[9],均为目标产物,几种DMH的辛烷值亦接近。为简明对比碳四气相和液相反应的热力学平衡选择性,主要考虑TMP、DMH的相应异构体之和。计算平衡组成时,采用液体酸法烷基化工艺的反应条件,温度范围为273.15~303.15 K,异丁烷/丁烯摩尔比为1,反应压力为1.0 MPa,得到碳四气相和液相烷基化反应的平衡选择性如图1所示。在计算条件下,碳四液相和气相烷基化反应平衡转化率均接近100%,二者相差不大,但二者产物的平衡选择性差异显著。273.15 K时,碳四气相烷基化反应产物中TMP的平衡选择性为47.2%,并且随着反应温度升高而降低;DMH的平衡选择性随着温度的升高而增加。碳四液相烷基化反应中,TMP与DMH选择性随温度变化趋势与气相类似,但TMP的平衡选择性高于气相反应5~7百分点,DMH的选择性比气相反应时更低。需要指出,计算出的热力学平衡选择性与实际产物分布[10-11]并无一一对应关系,这是由于实际过程除了热力学还受动力学等因素影响。另外,从反应温度对热力学平衡选择性的影响看,温度从273.15 K升至303.15 K时,碳四气相烷基化反应产物TMP的平衡选择性降低了6.2百分点,而在液相反应中降低了4.5百分点,表明碳四气相烷基化反应的平衡组成对温度更敏感。

图1 不同温度下碳四烷基化反应平衡选择性Fig.1 Equilibrium selectivity of C4 alkylation atdifferent temperaturesn(i-C4H10)/n(C4H8)=1; p=1.0 MPa
3.2 反应压力的影响
在反应温度288.15 K、异丁烷/丁烯摩尔比为1时,考察压力对平衡组成影响,结果如图2所示。由图2可见,无论是气相反应还是液相反应,随着压力的增加,各C8产物的平衡选择性基本不变,因此压力对碳四烷基化反应的产物选择性影响不大。值得注意的是,在气相烷基化反应中,平衡转化率随着反应温度的增加而增加,说明气相反应中增加压力有利于反应的正向进行;对于液相反应,压力对平衡转化率没有影响。因此从热力学角度而言,增加压力有利于气相反应的正向进行,而液相反应只要保证物料处于液态,无需过高的压力。

图2 不同压力下碳四烷基化反应平衡选择性Fig.2 Equilibrium selectivity of C4 alkylation at different pressuresn(i-C4H10)/n(C4H8)=1; T=288.15 K(a) Gas-phase; (b) Liquid-phase
3.3 惰性物质的影响
烷基化工业装置中,进料中会含有一些不参与反应的惰性物质,如正丁烷。在反应温度288.15 K、压力1 MPa、异丁烷/丁烯摩尔比为1时,考察正丁烷对反应平衡组成的影响,结果如图3所示。由图3 可见,正丁烷的添加对碳四液相和气相烷基化反应产物平衡选择性没有影响。气相和液相烷基化反应丁烯的平衡转化率均接近100%,并且不受正丁烷加入量的影响。需要指出的是,上述结论皆从热力学角度讨论得出,在实际反应过程中,正丁烷虽然不参与反应[12],但是正丁烷的存在会影响反应物的浓度,进而影响反应动力学,造成烷基化油收率的变化。

图3 惰性组分对烷基化反应平衡选择性的影响Fig.3 Effect of inert component on equilibrium selectivity of alkylation reactionn(i-C4H10)/n(C4H8)=1; T=288.15 K; p=1.0 MPa
4 结 论
对碳四烷基化反应进行了详细的热力学分析,并对比了其气相和液相反应的热力学异同。在273.15~303.15 K,液相烷基化反应的放热量略小于气相;液相反应的平衡常数比气相反应高3~5个数量级,说明碳四烷基化反应在液相中更容易进行。对比了温度、压力、惰性组分对反应平衡组成的影响,发现液相反应具有更高的TMP平衡选择性,而气相反应对反应压力和温度都更敏感。惰性组分的添加对碳四气相和液相反应的热力学平衡组成没有影响。从热力学角度看,碳四烷基化反应发生在液相中能获得更高的转化率和目的产物选择性,并且受温度、压力的影响较小。
符号说明:
A——常数,J/(K·mol);
B——常数;
C——常数;
Cp——定压比热容,J/(K·mol);
Cp——标准定压比热容,J/(K·mol);
ΔrCp——生成物比热容与反应物比热容之差,J/(K·mol);
D——常数;
ΔrG——反应的吉布斯自由能,kJ/mol;
ΔfH——标准摩尔生成焓,kJ/mol;
ΔrH——反应焓,kJ/mol;
K——平衡常数;
M——常数;
N——常数;
p——压力,MPa;
R——理想气体常数,J/(K·mol);
S——标准摩尔熵,J/(K·mol);
ΔrS——反应熵,J/(K·mol);
T——温度,K;
下标
g——气相;
l——液相
[1] WARD J W, HOMMELTOFT S I, HILLIERW J. Development and commercialization of Topsoe alkylation technology[C]//Washington D C: National Petroluem Refiners Association, 1994: 1-13.
[2] ALBRIGHT L F, SPALDING M A, NOWINSKI J A, et al. Alkylation of isobutane with C4olefins 1 First-step reactions using sulfuric acid catalyst[J].Industrial & Engineering Chemistry Research, 1988, 27(3): 381-386.
[3] MEYERS R A. Handbook of Petroleum Refining Process[M]. New York: McGraw-Hill, 1986.
[4] 马会霞, 周峰, 乔凯. 液体酸烷基化技术进展[J].化工进展, 2014, 33(S1): 32-40.(MA Huixia, ZHOU Feng, QIAO Kai. Advances in liquid acid alkylation technologies[J].Chemical Industry and Engineering Progress, 2014, 33(S1): 32-40.)
[6] 任杰, 赵愈林, 袁海宽, 等. 异丁烷与丁烯烷基化反应热力学研究[C]//Proceedings of 2011 AASRI Conference on Information Technology and Economic Development. Kuala Lumpur: Intelligent Information Technology Application Association, 2011: 121-124.
[7] 迪安. 兰氏化学手册[M].第二版. 北京: 科学出版社, 2003.
[8] CHASE M W. NIST-JANAF Thermochemical Tables[M]. Wash D C: ACS, 1998.
[9] CHAUVIN Y, HIRSCHAUER A, OLIVIER H. Alkylation of isobutane with 2-butene using 1-butyl-3-methylimidazolium chloride——Aluminium chloride molten salts as catalysts[J].Journal of Molecular Catalysis, 1994, 92(2): 155-165.
[10] 刘鹰, 刘植昌, 徐春明, 等. 室温离子液体催化异丁烷丁烯烷基化的中试研究[J].化工进展, 2005, 24(6): 656-660. (LIU Ying, LIU Zhichang, XU Chunming, et al. Study on room temperature ionic liquid catalyzed alkylation of isobutane with butene at pilot plant scale[J].Chemical Industry and Engineering Progress, 2005, 24(6): 656-660.)
[11] 高步良. 高辛烷值汽油组分生产技术[M]. 北京: 中国石化出版社, 2006.
[12] SUN W, SHI Y, CHEN J, et al. Alkylation kinetics of isobutane by C4olefins using sulfuric acid as catalyst[J].Industrial & Engineering Chemistry Research, 2013, 52(44): 15262-15269.
Differences in Thermodynamics of Liquid-Phase and Gas-Phase C4Alkylations
LI Yuxin
(EngineeringIncorporation,SINOPEC,Beijing100101,China)
Thermodynamic calculation ofiso-butane and 2-butene alkylation reaction was carried out for both gas-phase and liquid-phase condition, including enthalpy, Gibbs free energy, equilibrium constant and equilibrium composition. Differences in thermodynamic of gas-phase and liquid-phase C4alkylations were analyzed. It is found that the equilibrium constant of the liquid-phase C4alkylation was 3-5 orders higher than that of gas phase C4alkylation, indicating that alkylation reaction proceed more easily under liquid phase condition thermally. The equilibrium selectivity of trimethylpentane(TMP) in liquid-phase C4alkylation was higher than that in gas phase. And the equilibrium selectivity of gas-phase C4alkylation was more sensitive to temperature and pressure.n-Butane has no effect on the equilibrium selectivity and equilibrium conversion for both gas- and liquid- phase C4alkylation. From the viewpoint of thermodynamics, liquid-phase condition is more suitable for C4alkylation than gas-phase condition.
C4alkylation; thermodynamic; liquid-phase; gas-phase
2016-07-25
李玉新,女,博士,主要从事石油炼制反应工程研究;Tel:010-84876543; E-mail:liyuxin@sei.com.cn
1001-8719(2017)02-0364-07
TQ021.2
A
10.3969/j.issn.1001-8719.2017.02.023

