L-丙氨酰-L-谷氨酰胺对杂交鲟体成分、肠道形态的影响
王常安,李晋南,王连生,赵志刚,徐奇友
(中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070)
L-丙氨酰-L-谷氨酰胺对杂交鲟体成分、肠道形态的影响
王常安,李晋南,王连生,赵志刚,徐奇友
(中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070)
将初始体质量(0.42±0.05)g的杂交鲟(Acipenser schrenckii♀×A.baerii♂)仔鱼饲养在室内循环水养殖系统中,投喂添加0(G1)、0.25%(G2)、0.5%(G3)、0.75%(G4)和1.0%(G5)L-丙氨酰-L-谷氨酰胺(L-AG)的5种等氮饲料,每个处理3个重复,每个重复1500尾鱼,研究L-AG水平对杂交鲟体成分和十二指肠形态的影响。56d的养殖结果表明:饲料中添加0.25%和5.0%L-AG对全鱼粗蛋白含量影响不显著(P>0.05),但添加0.75%和1.0%L-AG显著提高了全鱼粗蛋白含量(P<0.05)。添加0.25%~1.0%L-AG对全鱼水分、粗脂肪和灰分含量影响不显著(P>0.05)。与对照组相比,添加0.25%~1.0%L-AG对肠道绒毛高度、微绒毛高度和肌层厚度均未产生显著影响(P>0.05)。结果表明:外源补充0.75%~1.0%L-AG可显著提高杂交鲟仔鱼粗蛋白含量,但添加0.25%~1.0%L-AG对十二指肠形态不产生显著影响。
杂交鲟;L-丙氨酰-L-谷氨酰胺;体成分;十二指肠形态
谷氨酰胺(Gln)是肠道黏膜细胞各项生理活动所需的能量物质,也是肠黏膜修复及细胞分裂活动所需核酸合成的氮源[1]。在动物发育早期,肠黏膜细胞以及快速增殖细胞对Gln的需求量大,是该阶段的必需氨基酸[2]。当Gln的需要量不能满足时,机体发育减缓,体蛋白分解代谢增加[3],免疫受抑制[4]。因此,有必要提高机体的Gln水平。然而,Gln在低pH和高温下很不稳定,水溶性和胃肠的消化吸收较差。丙氨酰谷氨酰胺(Ala-Gln)则具有更好的化学稳定性和水溶性,进入体内后迅速分解为Gln而发挥作用[5]。鲟仔鱼开口期是鱼类苗种培育过程中的关键时期,此时体质弱、易患病、成活率低,因此给开口仔鱼提供均衡的营养物质十分必要。鉴于Gln具有提高动物生产性能等作用,本文通过研究L-丙氨酰-L-谷氨酰胺(L-AG)对杂交鲟(Acipenser schrenckii♀×A.baerii♂)仔鱼的营养作用,以期为配制鲟开口饲料提供参考。
1 材料和方法
1.1 材料
试验用杂交鲟为7日龄仔鱼,初始体质量为(0.42±0.05)g,购于中国水产科学研究院鲟鱼繁育技术工程中心;L-丙氨酰-L-谷氨酰胺(L-AG)(纯度>98%),购于上海旭新化工科技有限公司。
1.2 方法
1.2.1 投喂试验
5种等氮饲料添加L-AG的水平分别为:0(G1)、0.25%(G2)、0.5%(G3)、0.75%(G4)和1.0%(G5),养殖周期56d。每处理组3个重复,每重复中放养1 500尾试验鱼。饲料配方和营养组成见表1。饲料蛋白源主要有鱼粉、大豆分离蛋白和血粉,脂肪源为鱼油。饲料原料经过60目粉碎后,混合、制粒(颗粒直径为3.0mm),然后破碎成微颗粒饲料,筛选。微颗粒饲料置于封口袋,保存于-20℃冰箱中。
试验鲟养殖在220L水族箱中,水为曝气自来水,水温22.5~23.5℃,溶氧>6.0mg/L,pH7.8~8.0,氨氮<0.02mg/L,日换水量为1/3。养殖试验共进行56d,前30d期间,每2h饱食投喂1次,后期日饱食投喂4次。
1.2.2 体成分测定
养殖试验结束时,鱼饥饿24h,每处理组每重复随机取12尾,全鱼用于体成分分析。饲料和体成分测定方法为:粗蛋白以凯氏定氮法(总氮×6.25);粗脂肪为索氏乙醚抽提法;灰分用茂福炉灼烧法(550℃);水分用105℃烘箱干燥恒重法。
1.2.3 肠道组织形态学观察
试验在4周末和8周末时,鱼饥饿24h后,每处理组每重复随机取4尾全鱼固定于Bouin’s液固定中48h,常规石蜡包埋,用KD1508型切片机进行横方向连续切片,切片厚度为6μm,苏木精-伊红染色法(H.E.)染色,中性树胶封片。Motic光学显微镜下测定十二指肠的绒毛高度、微绒毛高度和肌层厚度。每张切片测定10个绒毛高度、微绒毛高度和肌层厚度。
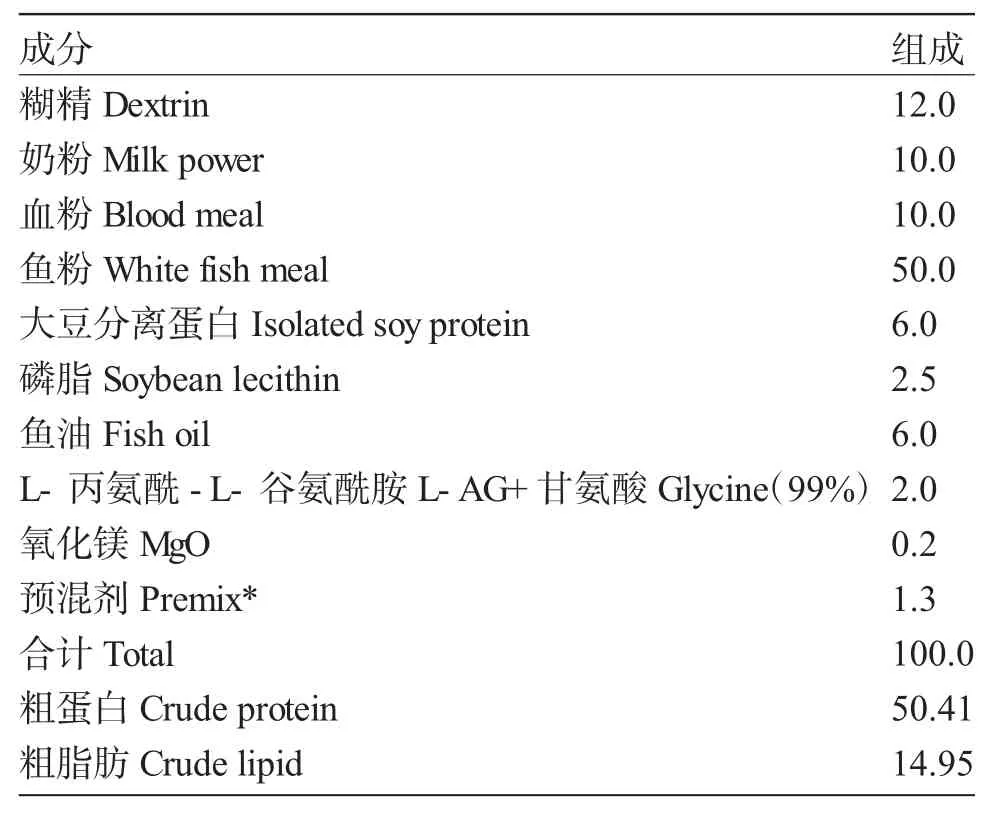
表1 饲料配方和营养组成(风干基础)Tab.1Ingredients and nutrient levels of the basal diets(air-dry basis,%)
1.3 统计分析方法
试验数据用平均值标准差(±SD)表示。用SPSS 19.0软件进行单因素方差分析和Duncan’s多重比较,显著性水平P=0.05。
2 结果与分析
2.1 L-丙氨酰-L-谷氨酰胺对杂交鲟体成分的影响
由表2可知,饲料中添加0.25%和0.5%L-AG对全鱼粗蛋白含量影响不显著(P>0.05),但添加0.75%和1.0%L-AG显著提高了全鱼粗蛋白含量(P<0.05),两者间差异不显著(P>0.05)。饲料中添加0.25%~1.0%L-AG对全鱼水分、粗脂肪和灰分含量影响不显著(P>0.05)。
2.2 L-丙氨酰-L-谷氨酰胺对杂交鲟肠道形态的影响
表3和图版I表明,与对照组相比,在4周末和8周末时,添加0.25%~1.0%L-AG对十二指肠道绒毛高度、微绒毛高度和肌层厚度均未产生显著影响(P>0.05)。
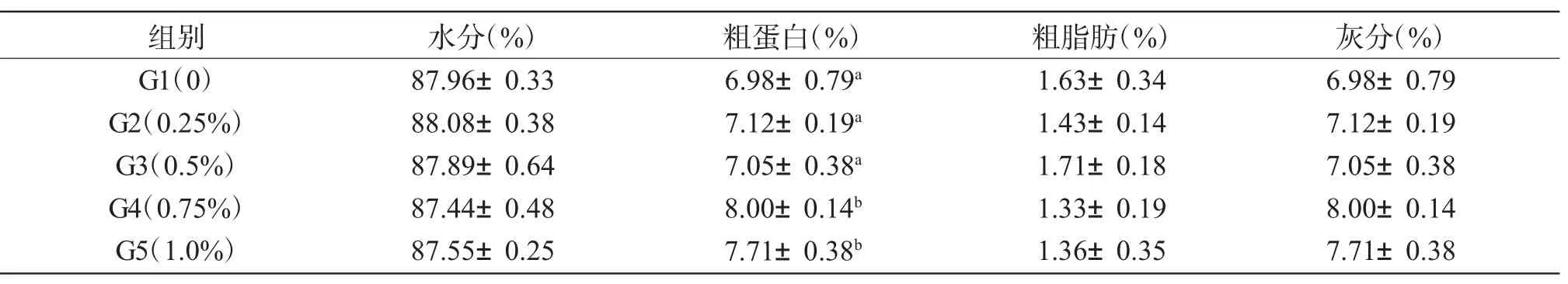
表2 L-丙氨酰-L-谷氨酰胺含量对杂交鲟体成分的影响Tab.2Effects of L-AG on body composition of hybrid sturgeon(Acipenser schrenckii×A.baerii)
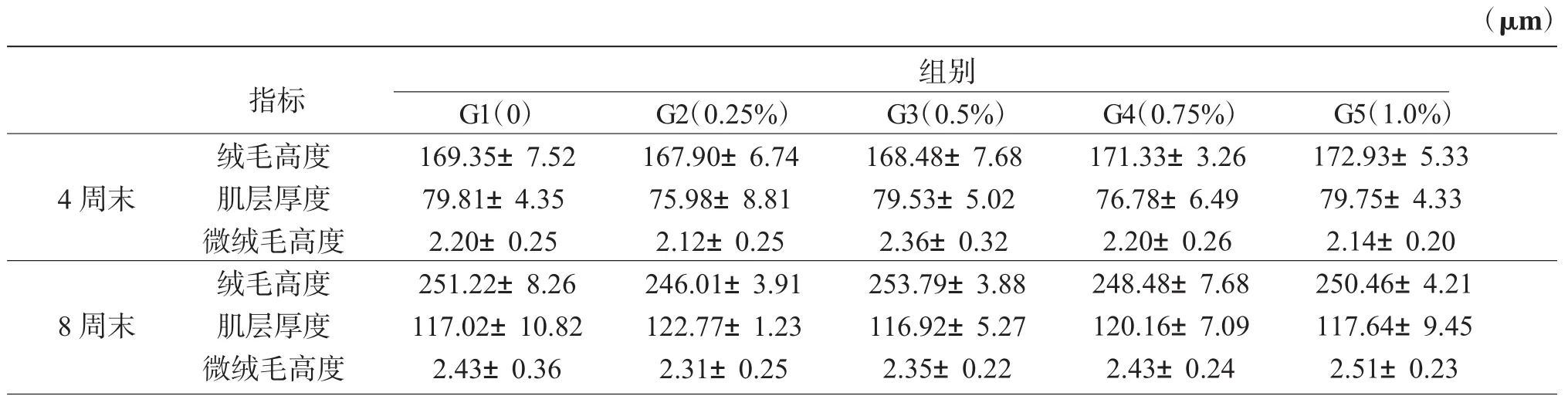
表3 L-丙氨酰-L-谷氨酰胺对杂交鲟肠道形态的影响Tab.3Effects of L-AG on intestinal morphology of hybrid sturgeon(Acipenser schrenckii×A.baerii)
3 讨论
3.1 L-AG对鲟蛋白质合成的影响
本试验结果显示:饲料中添加0.25%~1.0% L-AG对杂交鲟仔鱼粗脂肪、水分、粗灰分水平均无显著性影响(P>0.05),然而,饲料中添加0.75%~1.0%L-AG明显提高了杂交鲟仔鱼全鱼粗蛋白水平,而低水平添加组(0.25%~5.0%L-AG)则效果不明显,结果与镜鲤[6]、建鲤[7]等研究结果类似,表明饲料中添加0.75%~1.0%L-AG可以弥补杂交鲟仔鱼快速生长期蛋白质合成不足的问题。可见,补充适宜水平的外源性L-AG有促进杂交鲟仔鱼蛋白质合成的作用,对鲟早期发育具有积极的意义。目前关于L-AG对鱼类营养作用的研究有限,推测L-AG促进鲟蛋白质合成的原因主要有以下3个方面:(1)L-AG进入体内后能够迅速分解为Gln,其可促进细胞内蛋白质的合成[8],其在体内可转化为精氨酸,随着精氨酸浓度的上升,促进了生长激素(GH)的分泌;GH通过增强DNA聚合酶活性,促进mRNA转录水平,加速了机体蛋白质的表达[9]。(2)Gln也可能通过脱氨基和转氨基过程合成多种氨基酸来促进鱼体合成蛋白质[6,10]。前期研究表明,L-AG对促进杂交鲟仔鱼生长有明显效果,且机体内的Gln水平明显升高[11];对松浦镜鲤的研究表明,其饲料中添加Gln后,血清总蛋白(TP)、谷氨酸(Glu)含量明显升高[10]。(3)Gln还可能通过促进胰岛素生长因子(IGF-I)和甲状腺的分泌,促进机体蛋白质的合成。对断奶仔猪的研究发现,饲料中添加Gln后,机体内游离三碘甲腺原氨酸(FT3)、游离甲状腺素(FT4)水平提高,小肠黏膜细胞IGF-I mRNA表达量上调,IGF-I自分泌和旁分泌增加[12]。
3.2 L-AG对鲟肠道形态的影响
Gln是动物肠道黏膜细胞各项生理活动所需的能量物质,具有减少肠绒毛萎缩,改善机体肠道黏膜组织结构和促进肠道吸收等多种积极作用[1]。仔兔饲料中添加0.05%Ala-Gln后,小肠绒毛高度、肠壁厚度、隐窝的深度与绒毛高度/隐窝深度比值均显著高于对照组[13]。饲料中添加1.2%的谷氨酰胺,也可促进断奶仔猪肠道的发育[14,15]。补充外源Gln使建鲤肠道皱璧高度显著升高(P<0.05)[16]。当机体缺乏Gln时,机体肠道损伤明显;肠黏膜萎缩,绒毛变矮而稀疏,黏膜上皮屏障受损;肠黏膜杯状细胞黏液分泌减少,使肠黏膜表面的黏液层变薄、黏液屏障受损;肠黏膜免疫系统的细胞增生、分化、激活发生异常,肠黏膜免疫屏障功能下降[17]。本研究表明:饲料中添加0.25%~1.0%L-AG对杂交鲟十二指肠未产生不良影响。这可能由于不同种类的鱼组织中Gln代谢机制与哺乳动物有所差异[18]。硬骨鱼的胃和肠道中存在Gln合成酶,其在胃和肠道中分布不同,多数在肠道中的活性最强[19,20]。与陆生动物饲料(添加鱼粉的量很少或者不添加)不同的是,本试验饲料中含有50%鱼粉,其中的Gln可能已满足了鲟仔鱼肠道发育的需要,因此其肠道未产生明显损伤。
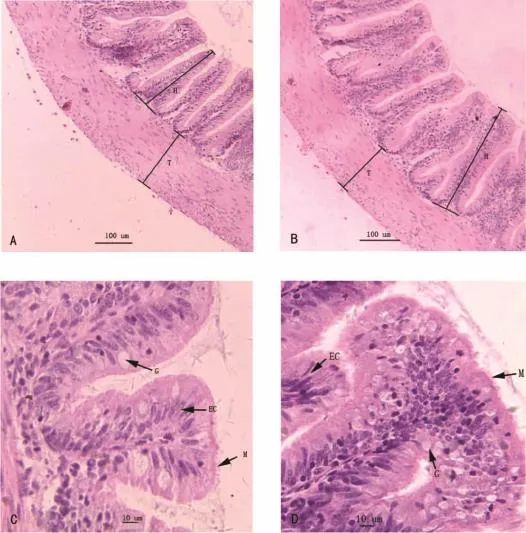
图版Ⅰ不同水平L-丙氨酰-L-谷氨酰胺对杂交鲟肠道形态的影响Plate IEffects of dietary L-AG on the intestinal morphology of hybrid sturgeon(Acipenser×A.baerii)
[1]Wu G.Amino acids:metabolism,functions,and nutrition[J].AminoAcids,2009,37(1):1-17.
[2]Mondello S,Galuppo M,Mazzon E,et al.Glutamine treatment attenuates the development of ischaemia/reperfusion injury of the gut[J].European Journal of Pharmacology, 2010,643(2):304-315.
[3]Boelens P G,Nijveldt R J,Houdijk A P J,et al.Glutamine alimentation in catabolic state[J].The Journal of Nutrition, 2001,131(9):569-577.
[4]Walker S P,Keast D and McBride S.Distribution of glutamine synthetase in the snapper(Pagrus auratus)and implications for the immune system[J].Fish Physiology and Biochemistry,1996,15(3):187-194.
[5]Klassen P,Mazariegos M,Solomons N W,et al.The pharmacokinetic responses of humans to 20 g of alanyl-glutamine dipeptide differ with the dosingprotocol but not with gastric acidity or in patients with acute dengue fever[J]. The Journal ofNutrition,2000,130(2):177-182.
[6]朱青,许红,徐奇友,等.谷氨酰胺对幼鲟鱼血清、肝胰脏生化指标及体成分的影响[J].水产学杂志,2010,23(2): 16-20.
[7]徐贺,郑伟,陈秀梅,等.丙氨酰-谷氨酰胺和γ-氨基丁酸对建鲤生长、饲料利用及体成分的影响[J].华南农业大学学报,2016,37(2):7-13.
[8]Wu G,Bazer F W,Davis T A,et al.Arginine metabolism andnutritioningrowth,health and disease[J].AminoAcids, 2009,37(1):153-168.
[9]周光明,王嫒,吴西华,等.谷氨酰胺的生物学功能研究进展及其在养牛生产中的应用[J].中国奶牛,2013(1): 13-16.
[10]李晋南,徐奇友,位莹莹,等.谷氨酰胺及其前体物对松浦镜鲤生长性能、体成分和血清生化指标的影响[J].东北农业大学学报,2013,44(12):119-125.
[11]WangCA,Xu Q Y,Xu H,et al.DietaryL-alanyl-L-glutamine supplementation improves growth performance and physiological functionof hybridsturgeonAcipenser schrenckii♀×A.baerii♂[J].Journal ofApplied Ichthyology,2011,27(2):727-732.
[12]黄冠庆,黄晓亮,李嘉嘉.丙氨酰谷氨酰胺对断奶仔猪生长和血清抗氧化能力的影响[J].动物营养学报,2008, 20(6):706-711.
[13]杨杰,翟频,白文霞.丙氨酰谷氨酰胺二肽对仔兔生长性能、小肠黏膜形态及抗氧化性能的影响[J].江苏农业学报,2009,25(3):583-586.
[14]边连全,陈静,刘显军.谷氨酰胺对早期断奶仔猪小肠黏膜形态和抗氧化性能的影响[J].沈阳农业大学学报, 2006,37(6):849-852.
[15]席鹏彬,林映才,蒋宗勇,等.谷氨酰胺二肽对断奶仔猪生长、免疫、抗氧化力和小肠黏膜形态的影响[J].动物营养学报,2007,19(2):135-141.
[16]林燕.谷氨酞胺对幼建鲤肠道功能和免疫力的影响[D].雅安:四川农业大学,2005:26-41.
[17]De-Souza D A and Greene L J.Intestinal permeability and systemic infections in critically ill patients:effect of glutamine[J].Critical Care Medicine,2005,33(5): 1125-1135.
[18]Chamberlin M E,Glemet H C and Ballantyne J S.Glutamine metabolism in a holostean(Amia calva)and teleost fish(Salvelinus namaycush)[J].American Journal ofPhysiology-Regulatory,Integrative and Comparative Physiology,1991,260(1):159-166.
[19]Mommsen TP,BusbyE R,von SchalburgK R,et al.Glutamine synthetase in tilapia gastrointestinal tract:zonation, cDNAand induction bycortisol[J].Journal ofComparative PhysiologyB,2003,173(5):419-427.
[20]徐奇友,王常安,许红,等.外源性谷氨酰胺对虹鳟稚鱼生长和肠道形态的影响[J].中国粮油学报,2009,24(4): 98-102.
Effects of Dietary L-Alanyl-L-Glutamine Supplementation on Body Composition and Intestinal Morphology of Hybrid Sturgeon Acipenser schrenckii♀×A.baerii♂
WANG Chang-an,LI Jin-nan,WANG Lian-sheng,ZHAO Zhi-gang,XU Qi-you
(Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China)
Juvenile hybrid sturgeon(Acipenser schrenckii♀×A.baerii♂)with initial body weight of(0.42±0.05)g were reared in a recirculation system and fed five isonitrogenous and isocaloric diets supplemented with L-Alanyl-L-Glutamine(L-AG)at a dose of 0%(G1),0.25%(G2),0.5%(G3),0.75%(G4)or 1.0%for 56 days with triplication to evaluate the effects of(L-AG)on body composition and duodenal morphology of the fish.The results showed that there were no significant differences in body crude protein content in the fish fed the diets containing 0.25%and 5.0%of L-AG(P>0.05).However,the fish fed the diets containing 0.75%and 1.0%of L-AG had increased in body crude protein content(P<0.05),without significant differences in body moisture,crude lipid and ash among the groups(P>0.05).No significant differences in intestinal villus height,microvillus height and muscle thickness were observed in the fish among the groups(P>0.05).In conclusion,body crude protein was significantly affected by 0.75%~1.0%L-AG supplementation,however,duodenal morphology was not changed by 0.25%~1.0%L-AG supplementation.
hybrid sturgeon;L-Alanyl-L-Glutamine;body composition;duodenal morphology
S963.73文献标识码:A
1005-3832(2017)02-0012-05
2016-10-27
黑龙江水产研究所基本科研业务费专项(HSY201512);黑龙江省自然科学基金(QC2015041);国家自然科学基金项目(31302204).
王常安(1981-),男,助理研究员,博士,从事水产动物营养与饲料学研究.E-mail:gordoncase@126.com

