枯草芽孢杆菌精氨酸脱羧酶基因speA的表达与蛋白纯化
曹宁,王亚娟,钟杰,佟硕秋,吴拥军*
(贵州大学生命科学学院,贵州贵阳550025)
枯草芽孢杆菌精氨酸脱羧酶基因speA的表达与蛋白纯化
曹宁,王亚娟,钟杰,佟硕秋,吴拥军*
(贵州大学生命科学学院,贵州贵阳550025)
根据枯草芽孢杆菌(Bacillus subtilis)BJ3-2的精氨酸脱羧酶(ADC)的编码基因speA序列设计特异性酶切引物,克隆基因speA序列。测序结果显示,基因speA全长为1 473 bp,编码490个氨基酸,分子质量为58 ku。基因speA克隆至原核表达载体,获得重组菌pET28a-speA/BL21,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)结果显示,1.0 mmol/L的异丙基β-D-硫代半乳糖苷(IPTG)28℃诱导4 h,上清液和菌体均能表达出ADC蛋白,上清液经纯化、透析、冷冻干燥可获得纯度97%的ADC酶,酶联免疫吸附检测(ELISA)ADC酶活为16 780 U/mg。为speA基因的表达、纯化及酶学性质研究奠定了理论基础。
枯草芽孢杆菌;精氨酸脱羧酶;表达;纯化
生物胺(biogenic amine,BA)是一类具有生物活性、低分子质量、含氮有机化合物的总称。根据组成成分可分为单胺(酪胺、组胺、尸胺、苯乙胺、色胺等)和多胺(腐胺、精胺和亚精胺)两大类[1]。生物胺可作为生物体合成荷尔蒙、核苷酸、蛋白质的前体物质,具有一定生理功能。但是过量摄入,则会引起诸如头痛、恶心、心悸、血压变化、呼吸紊乱等过敏反应,严重的还会危及生命[2]。
生物胺的产生需具备游离的氨基酸和氨基酸脱羧酶,通过氨基酸脱羧酶催化使氨基酸脱羧而产生[3]。目前研究发现,氨基酸脱羧酶主要存在于芽孢杆菌属、乳酸菌属、埃希氏杆菌属、变性菌属、假单胞菌属、沙门氏菌属、志贺氏菌属及一些柠檬酸细菌属细菌,其中乳酸杆菌的催化脱羧作用最为突出[4]。
贵州地区水豆豉属于典型的多菌混合细菌型自然发酵豆豉,主要参与发酵的微生物有芽孢杆菌属、枝芽孢杆菌属、产碱菌属、肠球菌属、丛毛单胞菌属、乳酸菌属和微球菌属等,在这些微生物的发酵作用下形成风味独特的豆豉[5]。实验室前期研究发现,细菌型豆豉能够有效分离出8种生物胺,分别是色胺、β-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺。其中前发酵阶段亚精胺含量最高,精胺次之,后发酵阶段酪胺含量最高,且显著高于其他生物胺2倍以上[6]。在枯草芽孢杆菌中生物胺合成只有一条途径,起始于精氨酸,在精氨酸脱羧酶、胍基丁胺酶、亚精胺合酶和精胺合酶共同作用合成亚精胺或精胺[7-8]。精氨酸脱羧酶(arginine decarboxylase,ADC)作为胺合成的关键酶[9-10]对精胺和亚精胺的形成起着重要的作用。所以目前认为控制食品中过量生物胺最有前景的方法是通过控制精氨酸脱羧酶的活性来控制生物胺的形成[7]。
枯草芽孢杆菌(Bacillus subtilis)是中国农业部批准使用的一种重要工业酶制剂的生产菌,现已大量用于食品发酵行业[11]。本实验室从水豆豉样品中分离获得了B.subtilis BJ3-2菌株[12]。本研究对B.subtilisBJ3-2菌株中获得的精氨酸脱羧酶(arginine decarboxylase ADC)基因speA序列进行聚合酶链反应(polymerase chain reaction,PCR)扩增,通过
1 材料与方法
1.1 材料与试剂
1.1.1 菌种和质粒
枯草芽孢杆菌(Bacillus subtilis)BJ3-2、大肠杆菌(Escherichiacoli)DH5α:本实验室保藏菌株;表达载体pET28a、宿主菌大肠杆菌(Escherichia coli)BL21(DE3):德国默克(中国)公司。
1.1.2 培养基及试剂
LB培养基:配制方法参考文献[13]。
T4 DNA连接酶、溶菌酶、基因组DNA提取试剂盒:美国Promega公司;脱氧核糖核苷三磷酸(deoxy-ribonucleotide triphosphate,dNTP)、DL2000 DNA Marker、rTaqDNA聚合酶、蛋白质Marker、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、限制性核酸内切酶、DNA Ligation Kit Ver.2.1连接试剂盒:TaKaRa(大连)公司;氨苄青霉素(ampicillin,Amp)、卡拉霉素(kanamycin,Kan):北京索莱宝科技有限公司;E.Z.N.A.TMGelExtraction Kit、E.Z.N.A.TM Plasmid Mini KitⅠ:美国Omega公司;考马斯亮蓝R-250、精氨酸脱羧酶(ADC)酶联免疫分析试剂盒:上海生工生物工程有限公司;His.Bind Purification Kit试剂盒:美国Novagen公司;咪唑(纯度99%):上海展云化工有限公司。
1.2 仪器与设备
TGL-161高速台式离心机、MyCycler PCR仪、Gel Doc XR凝胶成像系统:美国Bio-Rad公司;Biosafer-10D真空冷冻干燥机:美国Thermo公司。SW-CJ-1FD标准型净化工作台:苏州净化设备有限公司;GMSX-280高压灭菌锅:英国阿斯太欧(Astell)公司;SHZ-82A气浴恒温振荡器:江苏荣华仪器制造有限公司;DYCZ-25D小型垂直电泳槽(SDA-PAGE电泳槽)、DYY-4型稳压稳流电泳仪:北京市六一仪器厂。
1.3 实验方法
1.3.1 基因组DNA的提取
挑选B.subtilisBJ3-2的单菌落,接种到5 mL LB液体培养基中37℃、180 r/min过夜培养,按照Promega公司的革兰氏阳性细菌中基因组提取试剂盒说明书提取B.subtilis BJ3-2全基因组。
1.3.2 PCR扩增精氨酸脱羧酶基因
根据枯草芽孢杆菌(Bacillus subtilis)BJ3-2的speA基因序列,设计合成含BamHI引物PF:CGCGGATCCATGTCTCA ACATGAAACACCC和含XhoI引物PR:CCGCTCGAGTT GAATTGCTTTTTGTTCTTTG。采用PCR扩增引物对目的基因进行扩增,PCR反应体系:10μmol/μLPF和PR各0.4 μL、10×PCRbuffer2.0μL、dNTPMixture1.6μL、模板DNA1μL、rTaqDNA聚合酶0.1μL、ddH2O14.5μL,总体积20μL。PCR反应条件:94℃预变性5 min,94℃变性40 s,55℃复性45 s,72℃延伸90 s,30个循环,72℃延伸10 min。反应结束后用0.7%琼脂糖凝胶电泳检测。
1.3.3 重组质粒pGEM-T-speA的构建及测序
PCR产物采用胶回收试剂盒进行纯化,纯化后的PCR产物与pGEM-T连接,连接的过程及产物的转化过程按试剂盒的操作说明书进行。将连接好的10 μL产物按照常规方法转化至E.coliDH5α感受态细胞中。挑选阳性重组子,提取质粒后进行质粒PCR鉴定。将阳性菌株提取质粒后送至Life Technologies公司进行测序[14]。序列结果通过网站http://blast.ncbi.nlm.nih.gov/Blast.cgi的BLAST软件对基因序列进行在线的比对和分析,鉴定所克隆的基因是否为目的基因。将测序鉴定正确的重组质粒命名为pGEM-T-speA。
1.3.4 重组质粒pET28a-speA的构建
将质粒pGEM-T-speA和表达载体pET28a分别用BamH I(37℃)和XhoI(37℃)双酶切,对目的片段胶回收并纯化,用T4 DNA连接酶将双酶切产物和载体pET28a连接。按照试剂盒DNA Ligation Kit Ver.2.1中的说明书的使用方法进行连接。将连接产物转化至感受态细胞E.coli BL21(DE3)中,划线接种到含有Kan的LB固体平板上,37℃恒温培养箱中过夜培养,同时接种到含有Kan(50 μg/mL)的LB液体培养基中,37℃、180 r/min振荡培养过夜。将阳性菌株提取质粒DNA后进行酶切鉴定。
1.3.5 重组蛋白精氨酸脱羧酶的表达
将重组菌pET28a-speA/BL21和pET28a/BL21分别接种于5 mL含Kan(50 μg/mL)的LB液体培养基中,37℃、180 r/min培养至OD600nm=0.4~0.6,用终浓度为1 mmol/L的IPTG,28℃、180 r/min诱导培养4 h。取1 mL菌液4 000 r/min离心收集菌体,加入500μL的pH7.4磷酸盐缓冲液(phosphatebuffered saline,PBS)溶液重悬后进行超声波破碎(破碎条件:冰浴、200 MHz、超声3 s,间隔2 s)30 min,10 000 r/min离心10 min,收集上清液即为重组蛋白精氨酸脱羧酶。分别取20 μL上清液和超声沉淀上清液进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamidegelelectrophoresis,SDS-PAGE)检测(分离胶浓度为15%浓缩胶浓度为5%),考马斯亮蓝R-250染色、脱色[11],凝胶成像系统拍照并进行灰度扫描分析。
1.3.6 重组蛋白的纯化及浓度测定
参照His.Bind Purification Kit试剂盒说明书对重组蛋白精氨酸脱羧酶进行纯化,纯化条件:依次采用浓度为10 mmol/L、50 mmol/L、200 mmol/L、500 mmol/L的咪唑溶液进行洗脱,收集洗脱液,参考文献[15]的方法进行透析除盐,将透析过后的蛋白质样品装入无菌离心管内,立即置于液氮中2 min,将其快速彻底冻透,转入大气压为110 kPa的冷冻干燥机,4℃预冷15~30 min,放入样品,启动真空泵,37℃干燥24~72 h,取出样品即为纯化后的重组蛋白。采用考马斯亮蓝法测定蛋白浓度[15]。
1.3.7 重组蛋白酶活的测定
参照ADC酶联免疫分析试剂盒说明书对重组蛋白精氨酸脱羧酶活性进行测定。以精氨酸脱羧酶标准试剂的酶活力作为横坐标,吸光度值OD450nm作为纵坐标,绘制标准曲线。将样品所测得的OD450nm代入酶活力标准曲线直线回归方程式,算出样品酶活力后乘以稀释倍数所得值即为样品实际酶活力大小。
2 结果与分析
2.1 B.subtilisBJ3-2基因组DNA的提取及PCR扩增
以菌株B.subtilisBJ3-2基因组DNA为模板,PCR扩增speA基因,经0.7%的琼脂糖凝胶电泳,结果见图1。由图1可知,泳道1~4出现约1条带,其中约1 400 bp处扩增带与预期的speA大小相符。

图1 speA基因PCR扩增电泳图Fig.1 Electrophoretogram of genespeAby PCR amplification
2.2 重组质粒PCR的鉴定
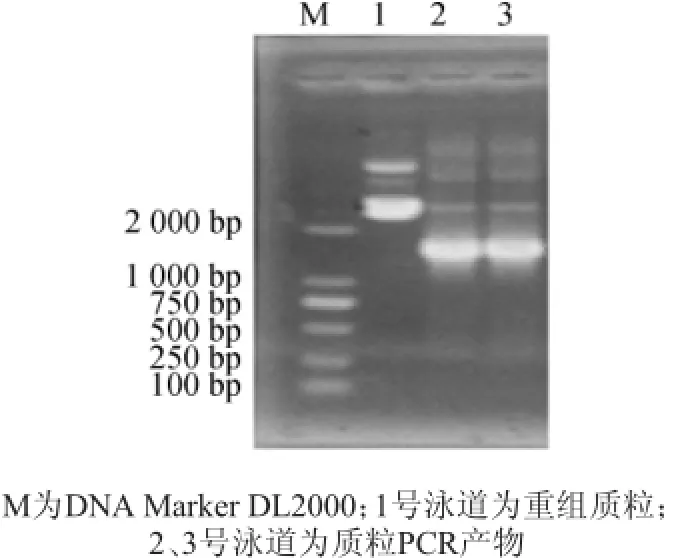
图2 重组质粒PCR扩增电泳图Fig.2Electrophoretogramof recombinant plasmid by PCR amplification
目的DNA片段进行胶回收,连接T载体后转化大肠杆菌(Escherichia coli)DH5α。经过菌落PCR鉴定为阳性的重组菌落接种到LB培养基中过夜培养,提取质粒进行质粒PCR鉴定,结果(图2)可知,在预期的1 400 bp处出现特异性条带,说明目的基因已经正确克隆至pGEM-T载体,重组载体命名为pGEM-speA。
2.3 目的基因的序列分析
测序结果表明,B.subtilisBJ3-2精氨酸脱羧酶基因speA大小为1 473 bp,编码490个氨基酸,计算其蛋白质分子质量为53.53 ku,等电点为5.29,酸性氨基酸19.6%,碱性氨基酸12.2%。与GenBank中登录号为KJ561348序列完全一致,说明所克隆的基因正确。
2.4 重组表达载体pET28a-speA构建及鉴定
以BamH I和XhoI分别双酶切阳性质粒pGEM-T-speA与pET28a载体,经转化、抗性筛后进行菌落PCR验证,结果见图3。取1号菌过夜培养后提取质粒进行双酶切验证,结果见图4。

图3 pET28a-speA重组质粒PCR扩增电泳图Fig.3 Electrophoretogram of recombinant plasmid pET28a-speA by PCR amplification
由图3可知,挑取得3个菌落均扩增出均出现1条带,其中约1400bp处扩增带与预期的speA大小相符,说明目的基因已正确克隆至pET28a载体中,重组质粒命名为pET28a-speA。

图4 pET28a-speA重组质粒酶切鉴定Fig.4 Enzyme digestion identification of recombinant plasmid pET28a-speA
由图4可知,酶切产物片段大小与克隆的基因大小相符。泳道2、3均酶切出两个条带,其中较小的条带出现的位置大约在1 400 bp处,与目的基因(speA)序列大小一致。其中泳道3目的片段稍微偏大,可能由于琼脂糖凝胶制备原因所致。为确定读码框是否正确,取2号泳道菌进行测序,结果显示序列长度为1473bp,同时在pET28a载体中的读码框也正确,这表明克隆的精氨酸脱羧酶基因与表达载体pET28a连接成功,即预期获得重组表达载体pET28a-speA重组子。
2.5 目的蛋白诱导表达
将pET28a-speA/BL21(DE3)重组菌接种于含Kan(50μg/mL)的LB液体培养基,28℃摇瓶大量培养,1.0mmol/L IPTG诱导培养后离心,分别取上清、沉淀及未诱导的细胞裂解液进行SDS-PAGE电泳检测,结果见图5。由图5可知,未添加诱导物的菌液蛋白基本不表达,泳道2、3和4号均出现显著的蛋白条带,说明ADC蛋白在上清、菌体内都能表达。通过软件Quantity One分析得出目的蛋白的分子大小约为58 ku,与推测的蛋白质分子质量大小相当。诱导表达的ADC蛋白菌体为包涵体形式表达,上清为可溶性表达且表达量更高,因此选取可溶性部分进行后续实验。
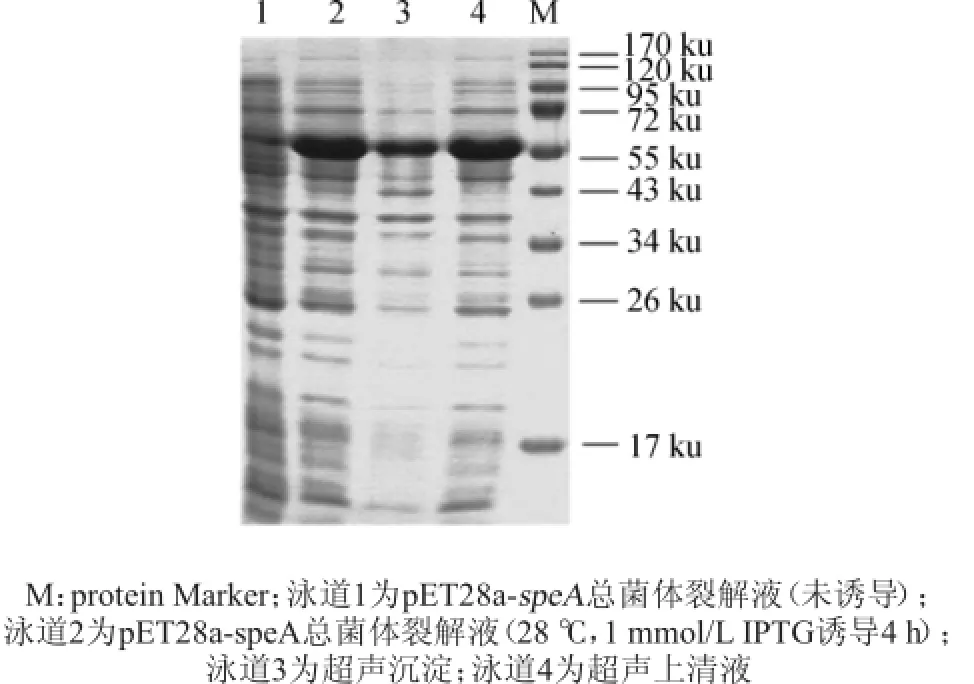
图5 蛋白小量诱导表达SDS-PAGE电泳图Fig.5 Electrophoretogram of protein inducible expression by SDS-PAGE analysis
2.6 蛋白的纯化
对pET28a-speA/BL21(DE3)重组菌进行500 mL大量表达,取上清利用His纯化试剂盒进行过柱纯化,纯化后大部分杂蛋白被除去,结果如图6所示。由图6可知,纯化结果表明,10~500 mmol/L咪唑洗脱均能获得目的蛋白,其中200 mmol/L咪唑可洗脱获得较高浓度的蛋白带。选择该浓度进行剩余蛋白的洗脱,合并所有洗脱液进行后续进一步纯化处理。
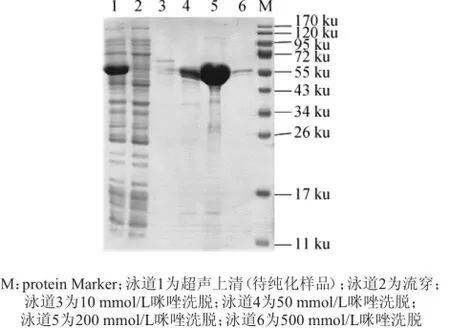
图6 纯化蛋白的SDS-PAGE电泳图Fig.6 Electrophoretogram of purified protein by SDS-PAGE analysis
2.7 蛋白含量的测定
采用方法测定纯化后重组蛋白含量,以牛血清蛋白(bovine serum albumin,BSA)质量浓度(X)为横坐标,吸光度值OD595nm(Y)为纵坐标,绘制牛血清蛋白标准曲线,根据标准曲线得出回归方程为:Y=3.515 4X+0.002,相关系数为R2=0.998 4,按照回归方程计算ADC蛋白质含量为0.97 mg/mL,即纯度为97%。
2.8 ADC酶活的检测
选用酶联免疫分析试剂盒对重组蛋白ADC酶活进行检测,以精氨酸脱羧酶标准试剂的酶活(X)为横坐标,吸光度值OD450nm(Y)为纵坐标,绘制ADC酶标准曲线。根据标准曲线得出回归方程为:Y=0.008 1X+0.036 4,R2=0.980 2,根据回归方程计算ADC酶活为16 780 U/mg。
3 结论
枯草芽孢杆菌作为豆豉发酵过程中的主要菌种,本研究成功克隆获得了B.subtilisBJ3-2精氨酸脱羧酶基因speA。以pET-28a作为表达载体,经IPGT诱导表达,并经15% SDS-PAGE电泳检测分析,在200mmol/L咪唑处可洗脱获得较高浓度蛋白,采用考马斯亮蓝法测其浓度为0.972mg/mL,即纯度为97%。应用ELISA法检测精氨酸脱羧酶酶活为16 780 U/mg。通过对主效微生物枯草芽孢杆菌产生的主要生物胺相关酶—ADC进行表达纯化以及酶活性研究,可以进一步探索酶活性与生物胺的关联性,以ADC活性作为指标可以反映出发酵豆豉的品质;同时通过对酶活性影响因素的研究,进而达到控制发酵过程,从而降低生物胺提高发酵食品安全性的目的。
[1]王颖,邱璠,韩北忠,等.食品中的生物胺及其检测方法[J].中国酿造,2011,30(10):1-5.
[2]冯婷婷,方芳,杨娟.食品生物制造过程中生物胺的形成与消除[J].食品科学,2013,34(19):360-366.
[3]王光强,俞剑燊,胡健,等.食品中生物胺的研究进展[J].食品科学,2016,37(1):269-278.
[4]RIVAS B,MARCOBAL A,CARRASCOSA A V,et al.PCR detection of foodborne bacteria producing the biogenic amines histamine,tyramine, putrescine,and cadaverine[J].J Food Prot,2006,69(10):2509-2514.
[5]唐雪.细菌型水豆豉发酵菌群的动态研究[D].贵阳:贵州大学,2015. [6]韩忠安,罗信旭,杨春艳,等.豆豉中生物胺含量的动态变化研究[J].中国酿造,2016,35(5):60-64.
[7]刘艳敏,卢彪,沈玺龙,等.枯草芽孢杆菌BJ3-2精氨酸脱羧酶基因speA的克隆与序列分析[J].中国酿造,2014,33(5):39-43.
[8]马瑛,刘静.植物体中多胺代谢及其功能研究进展[J].陕西理工学院学报:自然科学版,2010,26(2):47-54.
[9]TIBURCIO A F,MASDÉU M A,DUMORTIER F M.Polyamine metabolism and osmotic stress I.Relation to protoplast viability[J]. Plant Physiol,1986,82(2):369-374.
[10]汪天,孟艳琼,谷风,等.多胺代谢及其与农产品贮藏保鲜关系的研究[C].合肥:安徽食品安全博士论坛,2005.
[11]孟望霓,吴拥军,李耀中,等.应用原生质体融合技术筛选豆豉芽孢杆菌[J].中国酿造,2011,30(8):57-60.
[12]贾东旭,吴拥军,李耀中,等.细菌型豆豉发酵芽孢杆菌的筛选与鉴定[J].食品科学,2009,30(5):217-221.
[13]SAMBROOKJ,RUSSELLDW.Molecularcloning:a laboratorymanual [M].New York:Scholastic Corporation Press,2001:106-152.
[14]唐雪,蔡传斌,罗信旭,等.枯草芽孢杆菌BJ3-2赖氨酸脱羧酶基因yaaO的克隆与序列分析[J].中国酿造,2014,33(12):116-120.
[15]李慎涛,张富喜,陈振文,等.精编蛋白质科学实验指南[M].北京:科学出版社,2007:4-12.
[16]李志军,吴永宁,薛长湖.生物胺与食品安全[J].食品与发酵工业,2004,30(10):84-91.
[17]苏国兴,刘友良.高等植物体内的多胺分解代谢及其主要产物的生理作用[J].植物学通报,2005,22(4):408-418.
[18]何庆华,吴永宁,印遇龙.食品中生物胺研究进展[J].中国食品卫生杂志,2007,19(5):451-454.
Expression and purification of arginine decarboxylase genespeAofBacillus subtilis
CAO Ning,WANG Yajuan,ZHONG Jie,TONG Shuoqiu,WU Yongjun*
(College of Life Science,Guizhou University,Guiyang 550025,China)
Specific enzyme primers were designed according to the arginine decarboxylase(ADC)gene sequence ofBacillus subtilisBJ3-2,the gene speAwas cloned and obtained.The results of sequence analysis indicated that the full-length of genespeAwas 1 473 bp,which could encode 490 amino acids with deduced molecular mass of 58 ku.The genespeAwas cloned into prokaryotic expression vector to obtain recombinant strain pET28a-speA/BL21.The results of SDS-PAGE showed that the target protein was induced with 1.0 mmol/LIPTG at 28℃for 4 h,and the ADC protein could be expressed in supernatant fluid and bacteria.After purification,dialysis and freeze-drying,the ADC with 97%purity was obtained in supernatant fluid.The ADC activity was 16 780 U/mg by ELISA.The study laid a theoretical foundation for expression,purification and enzymatic properties of genespeA.
Bacillus subtilis;arginine decarboxylase;expression;purification
Q936
0254-5071(2017)03-0090-05
10.11882/j.issn.0254-5071.2017.03.019
2016-12-20
国家自然科学基金项目(31260394/C200207)
曹宁(1989-),女,硕士研究生,研究方向为生物化学与分子生物学。
*通讯作者:吴拥军(1971-),男,教授,博士,研究方向为食品生物技术。大肠杆菌(Escherichia coli)BL21(DE3)进行表达,获得精氨酸脱羧酶,并对其进行纯化和酶活力的检测对其ADC基因的研究会有助于进一步了解多胺的合成途径,可用于后期酶学性质的研究,以期为实际生产中抑制ADC活性、间接控制腐胺、亚精胺和精胺等相关生物胺的合成提供理论依据。

