丁苯酞对Aβ1-42诱导人脐静脉内皮细胞凋亡的保护作用及机制研究Δ
黄江,姜鲜,宋大强,刘明华,章卓#(.西南医科大学药学院药理教研室,四川 泸州 646000;2.西南医科大学附属中医院药剂科,四川 泸州 646000;.西南医科大学附属医院麻醉科,四川 泸州 646000)
丁苯酞对Aβ1-42诱导人脐静脉内皮细胞凋亡的保护作用及机制研究Δ
黄江1,2*,姜鲜3,宋大强1,刘明华1,章卓1#(1.西南医科大学药学院药理教研室,四川 泸州 646000;2.西南医科大学附属中医院药剂科,四川 泸州 646000;3.西南医科大学附属医院麻醉科,四川 泸州 646000)
目的:研究丁苯酞对β-淀粉样蛋白1-42(Aβ1-42)诱导人脐静脉内皮细胞(HUVEC)凋亡的保护作用及其机制。方法:将HUVEC分为正常对照组、Aβ1-42组、TAK242组(10 nmol/L)、二甲基亚砜(DMSO)组(1‰DMSO)和丁苯酞低、中、高浓度组(40、80、160 μg/L),除正常对照组和DMSO组外,其余各组细胞均加入50µmol/LAβ1-42培养HUVEC 24 h,同时TAK242组、DMSO组和丁苯酞低、中、高浓度组细胞还加入相应浓度的药物作用30 min,每个浓度3个复孔。CCK-8法测定细胞活力,Hochest 33342/PI双染法观察细胞凋亡情况,膜联蛋白(Annexin)Ⅴ-异硫氰酸荧光素(FITC)流式细胞仪检测细胞凋亡率,Western blot法检测细胞中果蝇样受体4(TLR4)、环氧合酶2(COX-2)蛋白表达,ELISA法检测细胞中白细胞介素1(IL-1)、肿瘤坏死因子α(TNF-α)含量。结果:与正常对照组比较,Aβ1-42组细胞活力减少、凋亡率增加,TLR4、COX-2蛋白表达和IL-1、TNF-α含量增加;与Aβ1-42组比较,TAK242组和丁苯酞低、中、高浓度组细胞活力增加、凋亡率减少,TLR4、COX-2蛋白表达和IL-1、TNF-α含量减少,差异均有统计学意义(P<0.05或P<0.01)。结论:丁苯酞可改善Aβ1-42所致的HUVEC凋亡,其机制可能与抑制TLR4、COX-2和炎症因子表达有关。
β-淀粉样蛋白1-42;人脐静脉内皮细胞;细胞凋亡;机制
β-淀粉样蛋白(β-amyloid protein,Aβ)的沉积导致脑血管内皮损伤可能是阿尔茨海默病(Alzheimer's disease,AD)发病机制之一,可能与Aβ致血管内皮细胞细胞凋亡,产生炎症反应以及内皮功能障碍等有关[1]。人体内最常见的亚型是Aβ1-40和Aβ1-42。果蝇样受体4(Toll-like receptor-4,TLR4)是机体参与炎症信号的重要受体之一,特异性配体可以激活TLR4信号通路,激活环氧合酶2(Cyclooxygenase-2,COX-2),释放炎症因子白细胞介素1(Interleukin 1,IL-1)、肿瘤坏死因子α(Tumor necrosis factor α,TNF-α)[2]。Aβ诱导血管内皮细胞凋亡也可能与TNF-α、IL-1的释放及COX-2等基因改变有关[3]。丁苯酞(Butylphthalide)具有神经功能保护作用,能抑制TLR4表达及炎症介质释放[4]。据此笔者通过体外培养人脐静脉内皮细胞(Human umbilical vein endothelial cells,HUVEC)研究丁苯酞是否能减轻Aβ1-42诱导的HUVEC凋亡,探讨其保护效应与TLR4/COX-2表达的关系,为了解丁苯酞保护Aβ所致血管内皮损伤的机制提供依据。
1 材料
1.1 仪器
PAC300型垂直型电泳槽和湿式电转膜槽转膜仪(美国Bio-Rad公司);SW-CJ-1F型超净工作台(苏州净化设备有限公司);CKX41型倒置相差显微镜(日本Olympus公司);SpectraMaxM3型酶标仪(美国MDS公司);TCS SP5型激光共聚焦扫描显微镜(德国Leica公司);SBK-YLQX-003552型流式细胞仪(美国BD公司);MR23i型超低温离心机(美国Thermo Fisher公司)。
1.2 药品与试剂
丁苯酞软胶囊(石药集团恩必普药业有限公司,批号:20151011,规格:每粒100 mg);兔TLR4多克隆抗体、兔COX-2多克隆抗体(美国Abcam公司);辣根过氧化物酶(HRP)标记山羊抗兔免疫球蛋白G(IgG)、CCK-8试剂盒(碧云天生物技术研究所);Aβ1-42多肽(北京奥普森有限公司);TLR4阻滞剂TAK242(美国MCE公司,批号:20151112,纯度:98.10%);IL-1、TNF-α试剂盒(武汉优尔生科技股份有限公司);Hochest 33342、碘化丙啶(PI)、膜联蛋白(Annexin)Ⅴ-异硫氰酸荧光素(FITC)(碧云天生物技术有限公司)。
1.3 细胞
HUVEC购自上海拜力生物试剂有限公司。
2 方法
2.1 CCK-8法检测HUVEC细胞活力
Aβ1-42在37℃下孵育1周使其变为聚集状态备用。HUVEC常规培养。将HUVEC分为正常对照组、Aβ1-42组、TAK242组(10 nmol/L)、二甲基亚砜(DMSO)组(1‰DMSO)和丁苯酞低、中、高浓度组(40、80、160 μg/L)。除正常对照组和DMSO组外,其余各组细胞均加入50 µmol/L Aβ1-42培养24 h,同时TAK242组、DMSO组和丁苯酞低、中、高浓度组细胞还加入相应浓度的药物作用30 min,每个浓度3个复孔。24 h后每孔细胞加入CCK-8 10 μL继续培养1 h。酶标仪450 nm波长处测定光密度(OD),以OD值的大小评价细胞活力。TAK242用 DMSO溶解,DMSO终浓度小于1‰。
2.2 Hochest 33342/PI双染法观察HUVEC凋亡情况
将HUVEC分为正常对照组、Aβ1-42组、TAK242组和丁苯酞低、中、高浓度组(40、80、160 μg/L),同“2.1”项下方法加药培养24 h后,Hochest 33342/PI双染检测HUVEC凋亡情况。具体方法:收集培养24 h后的细胞悬浮于1 mL培养基中,加入10 μL Hochest 33342贮存液(100 mg/L,蒸馏水溶解),染色15 min;冰上冷却,3 000× g离心5 min,去上清,细胞重悬于1 mL磷酸盐缓冲液(PBS)中,加5 μL PI液(1 g/L,蒸馏水溶解),混匀;显微镜下观察细胞核,蓝色为正常细胞,亮蓝色为凋亡细胞,红色为死亡细胞。
2.3 AnnexinⅤ-FITC流式细胞仪检测HUVEC凋亡率
同“2.2”项下分组加药培养HUVEC 24 h,消化收集细胞,冷PBS洗2次,悬浮于AnnexinⅤ混合缓冲液(1× 106mL-1)中。取100 μL细胞悬液加5 μL AnnexinⅤ-FITC和5 μL PI,轻摇细胞,室温下暗处放置15 min,1 h内流式细胞仪分析细胞凋亡率。
2.4 Western blot法检测HUVEC中TLR4、COX-2蛋白表达
采用Western blot法检测HUVEC中TLR4、COX-2蛋白表达。同“2.2”项下分组加药培养HUVEC 24 h,冰上裂解10 min,4℃下12 000×g离心10 min,取上清备用。采用二喹啉甲酸(BCA)法测定蛋白浓度,采用8%分离胶和4%的浓缩胶,加蛋白样后十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,电转120 min,与兔TLR4多克隆抗体、兔COX-2多克隆抗体4℃孵育过夜,TBST缓冲液洗膜3次,加入HRP标记山羊抗兔IgG(1∶2 000),孵育,洗膜,显影。以β-肌动蛋白(β-actin)为内参,用图像分析仪扫描,Image Pro-plus软件测定蛋白条带OD,以相应蛋白与内参OD值的比值评价蛋白表达。
2.5 ELISA法检测HUVEC中IL-1、TNF-α含量
同“2.2”项下分组加药培养HUVEC 24 h,收集细胞上清,4℃下1 500×g离心10 min,按ELISA法,以IL-1、TNF-α试剂盒说明书操作,酶标仪于450 nm波长处测定IL-1、TNF-α含量。
2.6 统计学方法
3 结果
3.1 细胞活力
正常对照组、Aβ1-42组、TAK242组、DMSO组和丁苯酞低、中、高浓度组细胞的OD值分别为0.99±0.12、0.79±0.07、0.94±0.11、1.02±0.09、0.92±0.04、0.97± 0.03、0.99±0.07。与正常对照组比较,Aβ1-42组细胞OD值明显降低;与Aβ1-42组比较,TAK242组和丁苯酞低、中、高浓度组细胞的OD值均明显升高,差异均有统计学意义(P<0.05)。正常对照组与DMSO组比较细胞的OD值无明显变化(P>0.05)。
3.2 细胞凋亡情况
Hochest 33342/PI双染显示,正常对照组细胞形态呈圆形,细胞核呈淡蓝色,几乎无凋亡细胞;Aβ1-42组多数细胞细胞核呈亮蓝色,凋亡细胞较多,还可见红色细胞核的死亡细胞;丁苯酞高浓度组凋亡细胞较少,丁苯酞中、低浓度组和TAK242组可见少量凋亡细胞。各组细胞凋亡染色图见图1。
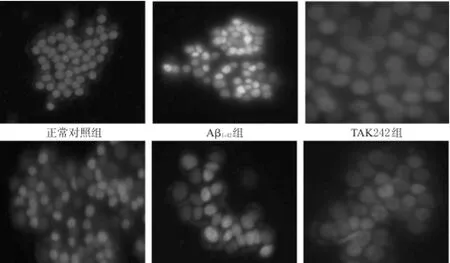
图1 各组细胞凋亡染色图(Hochest 33342/PI,×200)Fig 1 Cell apoptosis staining in each group(Hochest 33342/PI,×200)
3.3 细胞凋亡率
正常对照组、Aβ1-42组、TAK242组和丁苯酞低、中、高浓度组细胞的凋亡率分别为0.89%、21.89%、1.81%、11.12%、5.32%、2.31%。与正常对照组比较,Aβ1-42组细胞的凋亡率明显升高,差异有统计学意义(P<0.01);与Aβ1-42组比较,TAK242组和丁苯酞低、中、高浓度组细胞的凋亡率均明显降低,差异有统计学意义(P<0.01)。
3.4 细胞中TLR4、COX-2蛋白表达
与正常对照组比较,Aβ1-42组细胞中TLR4、COX-2蛋白表达明显增强,差异有统计学意义(P<0.01)。与Aβ1-42组比较,TAK242组和丁苯酞低、中、高浓度组细胞中TLR4、COX-2蛋白表达均明显减弱,差异有统计学意义(P<0.05或P<0.01)。各组细胞中TLR4、COX-2蛋白表达的电泳图见图2,测定结果见表1。
3.5 细胞中IL-1、TNF-α含量
与正常对照组比较,Aβ1-42组细胞中IL-1、TNF-α含量明显增加,差异有统计学意义(P<0.01)。与Aβ1-42组比较,TAK242组和丁苯酞低、中、高浓度组细胞中IL-1、TNF-α含量均明显减少,差异有统计学意义(P<0.01)。各组细胞中IL-1、TNF-α含量的测定结果见表2。
4 讨论
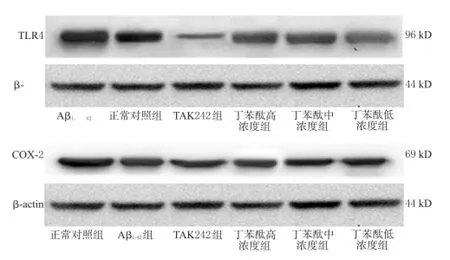
图2 各组细胞中TLR4、COX-2蛋白表达的电泳图Fig 2 Electrophoresis of protein expression of TLR4 and COX-2 in HUVECs of each group
表1 各组细胞中TLR4、COX-2蛋白表达的测定结果(±s,n=3)Tab 1 Determination results of protein expression of TLR4 and COX-2 in HUVECs of each group(±s,n=3)

表1 各组细胞中TLR4、COX-2蛋白表达的测定结果(±s,n=3)Tab 1 Determination results of protein expression of TLR4 and COX-2 in HUVECs of each group(±s,n=3)
注:与正常对照组比较,*P<0.01;与Aβ1-42组比较,#P<0.05,##P<0.01Note:vs.normal control group,*P<0.01;vs.Aβ1-42group,#P<0.05,##P<0.01
?
表2 各组细胞中IL-1、TNF-α含量的测定结果(±s,n=3,pg/mL)Tab 2 Determination results of the contents of IL-1 and TNF-α in HUVECs of each group(±s,n=3,pg/mL)

表2 各组细胞中IL-1、TNF-α含量的测定结果(±s,n=3,pg/mL)Tab 2 Determination results of the contents of IL-1 and TNF-α in HUVECs of each group(±s,n=3,pg/mL)
注:与正常对照组比较,*P<0.01;与Aβ1-42组比较,##P<0.01Note:vs.normal control group,*P<0.01;vs.Aβ1-42group,##P<0.01
?
尽管血管因素在AD的发生和进展中的作用越来越引起人们的重视,但Aβ致血管内皮损伤机制目前并未完全清楚。AD血管的异常包括不规则血管形成、微血管密度降低、小动脉和毛细血管萎缩、血管内皮功能退化、脑血管结构改变等[3]。Toll样受体是机体最重要的模式识别受体之一,其通过启动不同的信号途径参与了机体的天然与获得性免疫调节,目前发现约有12种Toll样受体[5]。其中TLR4是识别特异性配体LPS的主要受体,是机体参与炎症信号的重要受体之一,TLR4激活后,会启动Myd88依赖和非Myd88依赖的信号通路,激活下游COX-2释放,激发炎症因子,从而参与炎症反应[6]。TLR4可能参与了AD的血管内皮细胞凋亡[7]。有资料显示,LPS启动的TLR4通路参与了AD的发生,比如利用LPS腹腔注射和脑内注射,均发现大鼠海马tau蛋白不同位点出现了过度磷酸化的改变[8]。如果敲除掉与LPS连接的CD14,则可减少由Aβ诱导的小胶质细胞的激活[9]。另有研究也发现,Aβ能够刺激TLR4野生型小鼠大脑分泌更多的炎症因子,如TNF-α、IL-1、IL-10和IL-17。同TLR4野生型小鼠比较,TLR4缺乏或者突变的小鼠更容易发生淀粉样沉积和弥散[10]。由此可知,TLR4可能与AD发生过程中内皮细胞损伤存在一定联系。
丁苯酞在临床上可用于AD的防治[11],对Aβ1-42诱导的HUVEC凋亡可能具有保护效应。HUVEC的优点在于较为稳定、易于实验操作,故本研究选择了HUVEC作为研究对象。结果显示,Aβ1-42刺激HUVEC后,细胞凋亡明显增加,细胞活力下降;与Aβ1-42组比较,丁苯酞作用后减少了Aβ1-42诱导的血管内皮细胞凋亡率,提高了细胞活力,因此其具有一定的保护效应。
进一步研究丁苯酞保护效应是否与抑制TLR4表达和炎症因子释放有关。研究结果显示,与Aβ1-42刺激后的HUVEC比较,给予TLR4阻滞剂的细胞凋亡明显减少,细胞活力提高,提示TLR4的激活可能参与了Aβ1-42刺激后的HUVEC细胞凋亡。同时,给予TLR4阻滞剂后,炎症因子IL-1和TNF-α明显减少,COX-2表达减少,提示Aβ1-42刺激后的HUVEC细胞凋亡与炎症因子IL-1、TNF-α、COX-2表达减少有关。丁苯酞作用后减少了Aβ1-42诱导的HUVEC中TLR4、COX-2蛋白表达,也明显减少了炎症因子IL-1、TNF-α表达,推测其保护效应与抑制TLR4表达和炎症因子表达有关。
综上所述,TLR4参与了Aβ1-42刺激后的HUVEC细胞凋亡;丁苯酞对Aβ1-42诱导的HUVEC细胞凋亡具有明显的保护效应,其保护效应可能与抑制TLR4启动的信号通路中COX-2与炎症因子表达有关。其他的Toll受体亚型是否也参与了丁苯酞的保护作用值得进一步研究。
[1] Karch CM,Jeng AT,Nowotny P,et al.Expression of novel Alzheimer's disease risk genes in control and Alzheimer's disease brains[J].PLoS One,2012,7(11):e50976.
[2] Hwang EH,Kim TH,Oh SM,et al.Toll/IL-1 domaincontaining adaptor inducing IFN-β(TRIF)mediates innate immune responses in murine peritoneal mesothelial cells through TLR3 and TLR4 stimulation[J].Cytokine,2016,doi:10.1016/j.cyto.2015.11.010.
[3] Yu H,Yang M,Wang Y,et al.p75NTR is mainly responsible for Aβ toxicity but not for its internalization:a primary study[J].Neurol Sci,2012,33(5):1043-1050.
[4] 张晓璇,邱海鹏,赵淑敏.丁苯酞对脑缺血再灌注大鼠HSP70及TLR4的影响研究[J].中国免疫学杂志,2014,30(10):1401-1403.
[5] Ma JF,Wang HM,Li QY,et al.Starvation triggers Abeta42 generation from human umbilical vascular endothelial cells[J].FEBS Lett,2010,584(14):3101-3106.
[6] Zhang W,Wang LZ,Yu JT,et al.Increased expressions of TLR2 and TLR4 on peripheral blood mononuclear cells from patients with Alzheimer's disease[J].J Neurol Sci,2012,315(1/2):67-71.
[7] Gambuzza ME,Sofo V,Salmeri FM,Soraci L,et al.Tolllike receptors in Alzheimer's disease:a therapeutic perspective[J].CNS Neurol Disord Drug Targets,2014,13(9):1542-1558.
[8] Shi S,Liang D,Chen Y,et al.Gx-50 reduces β-amyloid-induced TNF-α,IL-1β,NO,and PGE2 expression and inhibits NF-κB signaling in a mouse model of Alzheimer's disease[J].Eur J Immunol,2016,46(3):665-676.
[9] Wu D,Zhang X,Zhao M,et al.The role of the TLR4/ NF-κB signaling pathway in Aβ accumulation in primary hippocampal neurons[J].Acta physiologica Sinica,2015,67(3):319-328.
[10] Chen L,Bai Y,Zhao M,et al.TLR4 inhibitor attenuates amyloid-β-induced angiogenic and inflammatory factors in ARPE-19 cells:Implications for age-related macular degeneration[J].Mol Med Rep,2016,13(4):3249-3256.
[11] 齐凡星,胡莹,卢军栋,等.丁苯酞治疗阿尔茨海默病的临床观察[J].中国药房,2016,27(17):2412-2414.
Protective Effect of Butylphthalide on Human Umbilical Vein Endothelial Cell Apoptosis Induced by Aβ1-42and Its Mechanism
HUANG Jiang1,2,JIANG Xian3,SONG Daqiang1,LIU Minghua1,ZHANG Zhuo1(1.Pharmacology Teaching and Research Section,School of Pharmacy,Southwest Medical University,Sichuan Luzhou 646000,China;2.Dept. of Pharmacy,the Affiliated TCM Hospital of Southwest Medical University,Sichuan Luzhou 646000,China;3.Dept.of Anesthesiology,the Affiliated Hospital of Southwest Medical University,Sichuan Luzhou 646000,China)
OBJECTIVE:To study the protective effect of butylphthalide on the apoptosis of human umbilical vein endothelial cells(HUVECs)induced by Aβ1-42and its mechanism.METHODS:HUVECs were divided into normal control group,Aβ1-42group,TAK242 group(10 nmol/L),DMSO group(1‰DMSO)and butylphthalide low-concentration,medium-concentration and high-concentration groups(40,80,160 μg/L).Except for normal control group and DMSO group,other groups were given 50 µmol/L Aβ1-42to culture HUVECs for 24 h.TAK242 group,DMSO group and butylphthalide low-concentration,medium-concentration and high-concentration groups were given relevant concentration of drugs for 30 min,with 3 holes for each concentration.The cell viability was determined by CCK-8 assay;cell apoptosis was observed by Hochest 33342/PI double staining;the cell apoptotic rate was detected by AnnexinⅤ-fluorescein isothiocyanate(FITC)flow cytometry;the protein expression of TLR-4 and COX-2 were determined by Western blot assay;the contents of IL-1 and TNF-α were detected by ELISA.RESULTS:Compared with normal control group,cell viability of HUVECs were decreased in Aβ1-42group;while apoptotic rate,protein expression of TLR4 and COX-2,the contents of IL-1 and TNF-α were increased.Compared with Aβ1-42group,cell viability of HUVECs were increased in TAK242 group and butylphthalide low-concentration,medium-concentration and high-concentration groups;while apoptotic rate,protein expression of TLR4 and COX-2,the contents of IL-1 and TNF-α were decreased,with statistical significance(P<0.05 or P<0.01).CONCLUSIONS:Butylphthalide can reduce HUVECs apoptosis induced by Aβ1-42,which may be related with inhibiting the expression of TLR4,COX-2 and inflammatory factors.
Aβ1-42;Human umbilical vein endothelial cells;Cell apoptosis;Mechanism
R361+.3;R967
A
1001-0408(2017)04-0483-04
2016-09-16
2016-10-27)
(编辑:邹丽娟)
四川省科技厅一般项目(No.2014S20071);泸州市科技局科技支撑计划项目(No.2013LZLY-J52)
*主管药师,硕士研究生。研究方向:分子药理学。电话:0830-3162291。E-mail:354699170@qq.com
#通信作者:副教授,硕士。研究方向:分子药理学。电话:0830-3162291。E-mail:zhhuozhang100@163.com
DOI10.6039/j.issn.1001-0408.2017.04.14

