重症肌无力患者肌细胞中LRP4胞内区与SNX17的相互作用*
安 颖,吕 杰,张迎娜,高 峰#,张 婧,方 华,李倩如,杜 英,张清勇,王金兰#,
张运克5)
1)郑州大学第二附属医院神经内科 郑州 450014 2)郑州大学医药科学研究院神经免疫学研究室 郑州 450052 3)郑州大学基础医学院免疫学系 郑州 450001 4)郑州大学第二附属医院普胸外科 郑州 450014 5)河南中医药大学康复医学院康复办公室 郑州 450000
重症肌无力患者肌细胞中LRP4胞内区与SNX17的相互作用*
安 颖1),吕 杰2),张迎娜2),高 峰2)#,张 婧2),方 华2),李倩如3),杜 英3),张清勇4),王金兰1)#,
张运克5)
1)郑州大学第二附属医院神经内科 郑州 450014 2)郑州大学医药科学研究院神经免疫学研究室 郑州 450052 3)郑州大学基础医学院免疫学系 郑州 450001 4)郑州大学第二附属医院普胸外科 郑州 450014 5)河南中医药大学康复医学院康复办公室 郑州 450000
#通信作者:高峰,男,1970年12月生,在读博士,研究员,研究方向:神经免疫病机制与临床,E-mail:gaoyuanshan@126.com;王金兰,女,1968年9月生,博士,主任医师,研究方向:脑血管病及自身免疫性疾病,E-mail:wangjinlan08@126.com
低密度脂蛋白受体相关蛋白4;分拣微管连接蛋白17;重症肌无力;免疫共沉淀
目的:探讨低密度脂蛋白受体相关蛋白4(LRP4)和分拣微管连接蛋白17(SNX17)在重症肌无力(MG)患者肌细胞中相互作用关系。方法:分别构建原核表达载体pET30a-LRP4胞内区和真核表达载体pEASY-Blunt M2-SNX17,在大肠杆菌BL21(DE3)中诱导表达相对分子质量约为17 800的His-LRP4胞内区,在HEK293T细胞中诱导表达相对分子质量约为53 000的Myc-SNX17。利用抗Myc单克隆抗体磁珠与抗His单克隆抗体磁珠进行双向免疫共沉淀(Co-IP),以验证LRP4、SNX17两种蛋白分子是否存在相互作用。结果:成功构建了原核表达载体pET30a-LRP4胞内区和真核表达载体pEASY-Blunt M2-SNX17; 抗Myc单克隆抗体磁珠与His-LRP4混合后不发生共沉淀,如再与Myc-SNX17 混合则可发生共沉淀;抗His单克隆抗体磁珠与Myc-SNX17混合后不发生共沉淀,再与His-LRP4胞内区混合可发生共沉淀。结论:原核表达的LRP4胞内区蛋白与真核表达的SNX17体外可发生直接结合。
重症肌无力(myasthenia gravis,MG)是一种主要累及神经肌肉接头(neuromuscular junction,NMJ)突触后膜的自身免疫性疾病[1],主要病理特征是突触后膜乙酰胆碱受体(acetylcholine receptor,AChR)数量减少、结构变化导致的终板膜崩解。有研究[2]结果显示,低密度脂蛋白受体相关蛋白4(low density lipoprotein receptor-related protein 4,LRP4)与肌肉特异性受体酪氨酸激酶(muscle specific kinase,MuSK)、烟碱型乙酰胆碱受体(nicotinic Acetylcholine receptor ,nAChR)一起组成了NMJ终板膜特有的功能单元LRP4-MuSK-nAChR,该功能单元在神经肌肉兴奋化学传递的过程中发挥了重要作用。课题组[3]前期发现MG患者肌肉组织分拣微管连接蛋白17(sorting nexin 17,SNX17)含量明显增高,并证实该分子与AChR共定位于NMJ。SNX17是细胞分拣微管连接蛋白家族成员,主要作用是通过其FERM-like基元与低密度脂蛋白受体(low density lipoprotein receptor,LDLR)、LRP1、P选择素和载脂蛋白2(the ε2 isoform of ApoE,ApoER2)等多种膜蛋白胞内域天冬酰胺-脯氨酸-X-酪氨酸(NPxY)基元结合,促进这些膜蛋白高效率循环再利用到细胞膜[4-5]。生物信息学分析显示,LRP4与LRP1、LDLR等同属于低密度脂蛋白(low density lipoprotein,LDL)家族,具有类似的NPxY基元,因此,SNX17与LRP4存在相互作用的可能,可使LRP4逃避溶酶体降解,促进LRP4在胞内的循环利用[6]。为验证这一推测,作者通过分别表达LRP4胞内区和SNX17,采用双向免疫共沉淀(co-immunoprecipitation,Co-IP)法明确两者之间的相互作用关系。
1 材料与方法
1.1 材料与试剂 肌肉标本取自2015年1月在郑州大学第二附属医院胸外科行胸腺切除术治疗的MG患者的第二肋间,质量约60 mg,取出后立即保存于液氮中。MG诊断参考文献[7]的标准,根据病史、体征、疲劳试验和新斯的明试验确诊,手术时机选择参考文献[8]。患者均签署知情同意书,该研究由郑州大学伦理审查委员会批准。质粒pMD18T、限制性内切酶NdeⅠ和XhoⅠ、T4 DNA连接酶、反转录试剂盒购自TaKaRa公司,质粒pET30a购自Novagen公司,pEASY-Blunt M2表达载体购自北京全式金生物技术有限公司,Turbo8.0转染试剂、羊抗人LRP4胞内区抗体、辣根过氧化物酶标记鼠抗羊单克隆抗体、抗Myc单克隆抗体磁珠购自Origene公司,鼠抗人SNX17抗体、辣根过氧化物酶标记羊抗鼠单克隆抗体购自Santa Cruz公司, 抗His单克隆抗体磁珠购自MBL医学生物研究所,pET30a-SNX17及大肠杆菌DH5α、Trans1-T1、BL21(DE3)、HEK293T细胞均由郑州大学医药科学研究院神经免疫学研究室保存。
1.2 His-LRP4胞内区蛋白的表达及鉴定
1.2.1 质粒pMD18T-LRP4胞内区的克隆及鉴定 从MG患者肌肉标本中提取总RNA,用试剂盒反转录成cDNA。以LRP4胞内区基因(GenBank编码:NM_002334.3 第5 482~5 891位)为模板设计引物,上游引物序列:5’-GGAATTCCATATGTACAGA CACAAAAAATCCAAGTTCAC-3’,下游引物序列:5’-CCGCTCGAGGACCTGGCTCTCTGAGGAG-3’;引物由上海生工生物工程股份有限公司合成。PCR扩增出LRP4胞内区,用T4 DNA连接酶与质粒pMD18T连接,16 ℃连接过夜,转化大肠杆菌DH5α,同时以空质粒和灭菌双蒸水转化作对照,涂布于含有氨苄青霉素的LB选择培养基,37 ℃培养12~18 h,挑取单克隆至5 mL LB选择培养基,37 ℃ 180 r/min培养过夜,经菌落PCR和酶切鉴定,将阳性克隆送上海生工生物工程股份有限公司进行测序。
1.2.2 原核表达载体pET30a-LRP4胞内区的构建
用NdeⅠ、XhoⅠ分别酶切质粒pMD18T-LRP4胞内区和表达载体pET30a,切胶回收目的基因片段和载体片段,连接、转化及鉴定方法同1.2.1。
1.2.3 His-LRP4胞内区蛋白的表达及鉴定 将测序正确的质粒pET30a-LRP4胞内区转化大肠杆菌BL21(DE3),涂布于含有50 mg/L卡那霉素的LB选择培养基上,37 ℃培养12~16 h。挑取单克隆接种于25 mL含有50 mg/L 卡那霉素的LB液体培养基中,37 ℃培养过夜,次日取菌悬液1 mL接种于100 mL新鲜的LB培养基中,37 ℃ 180 r/min 培养,至OD(600 nm)为0.4~0.6时,加入异丙基-β-D-硫代半乳糖苷(IPTG)至终浓度为1 mmol/L,30 ℃诱导4 h,收集菌液,离心收集菌体,用PBS缓冲液重悬,冰浴超声破碎,离心收集上清液后使用BIO-RAD蛋白纯化仪进行纯化。
1.2.4 His-LRP4胞内区蛋白的鉴定 纯化完成的His-LRP4胞内区蛋白经SDS-PAGE电泳,考马斯亮蓝染色,脱色液脱色后观察。将电泳后的凝胶转移至硝酸纤维素膜上,30 g/L的BSA封闭2 h,加入按12 000稀释的羊抗人LRP4胞内区抗体,4 ℃孵育过夜,次日摇床上用TBST缓冲液洗涤3次,10 min/次;再加入按16 000稀释的辣根过氧化物酶标记鼠抗羊单克隆抗体,摇床上室温孵育2 h,用TBST 洗涤3次,10 min/次,暗室中ECL曝光1 min后进行显影和定影。
1.3 Myc-SNX17蛋白的表达及鉴定
1.3.1 真核表达载体pEASY-Blunt M2-SNX17的构建 以SNX17基因序列为模版设计引物。上游引物序列:5’-ACCACCATGGTGCACTTTTCCATTCCCGA AACCG-3’,下游引物序列:5’-CAGATCCTCATCTCC AATGCCCTCG-3’;引物由上海生工生物工程股份有限公司合成。从pET30a-SNX17扩增出SNX17片段,将扩增出的片段与pEASY-Blunt M2表达载体进行连接,转化到Trans1-T1感受态细胞中,涂布于含有氨苄青霉素的LB选择培养基,37 ℃培养12~18 h,挑取单克隆进行鉴定。连接、鉴定方法同1.2.1。
1.3.2 Myc-SNX17的表达及鉴定 将在6孔细胞培养板中培养24 h的HEK293细胞培养上清用移液器轻轻吸出,然后沿孔壁缓慢加入2 mL含体积分数10%胎牛血清的RPMI 1640培养基,静置待用。按每孔加100 μL脂质体质粒混合液计算转染需要的总体积,然后取相应体积的无血清RPMI 1640培养液,按3 μL/孔加入Turbo8.0转染试剂,轻轻混匀,静置5 min,再按1 μg/孔加入重组质粒pEASY-Blunt M2-SNX17,轻轻混匀,静置30 min,转染空质粒作对照,然后将准备好的转染试剂和重组质粒的混合液按100 μL/孔加入相应的培养孔中,轻轻晃动培养板使其混合均匀,于37℃、体积分数5%CO2培养箱中培养72 h。收集细胞,加入细胞裂解液RIPA和细胞蛋白酶抑制剂PMSF冰上裂解30 min, 4 ℃ 12 000 r/min 离心15 min,去除细胞碎片,收获细胞裂解上清,进行SDS-PAGE电泳检测,Western blot法验证Myc-SNX17的表达。
1.4 SNX17与LRP4相互作用的双向Co-IP鉴定
取50 μL磁珠置于1.5 mL EP管中,用RIPA洗3次,向其中加入200 μL LRP4胞内区蛋白质(2.6 g/L)和50 μL SNX17(3.8 g/L),充分混匀,4 ℃孵育过夜。然后将装有磁珠样品混合物的EP管置于磁力架上,静置30~60 s,弃去所有溶液,RIPA洗3次,然后向其中加入20 μL 5×SDS上样缓冲液,充分混匀后95 ℃煮沸10 min,12 000 r/min 4 ℃离心4 min,收集上层溶液进行SDS-PAGE电泳,后进行Western blot鉴定。
2 结果
2.1 His-LRP4胞内区的表达及鉴定结果 原核表达载体pET30a-LRP4胞内区单酶切、双酶切结果符合预期(图1A),BL21(DE3)/pET30a-LRP4胞内区诱导表达后出现LRP4条带(图1B),提示pET30a-LRP4构建成功,质粒图见图1C;Western blot结果证实BL21(DE3)/pET30a-LRP4胞内区诱导表达的蛋白是His-LRP4胞内区(图1D)。

A:pET30a-LRP4胞内区(0)、单酶切(1)、双酶切(2)电泳;B:BL21(DE3)/pET30a-LRP4胞内区未诱导表达(0)和诱导表达(1)的蛋白;C:pET30a-LRP4胞内区质粒图;D:Western blot验证BL21(DE3)/pET30a-LRP4胞内区未诱导(0)与诱导后(1)LRP4胞内区的表达。图1 His-LRP4胞内区的表达与鉴定
2.2 Myc-SNX17的表达及鉴定结果 琼脂糖凝胶电泳显示成功扩增出SNX17(图2A),从HEK293T/pEASY-Blunt M2与HEK293T/pEASY-Blunt M2-SNX17细胞中提取的总蛋白差异不大(图2B),质粒图见图2C;Western blot结果证实从HEK293T/pEASY-Blunt M2-SNX17细胞中提取的总蛋白含Myc-SNX17(图2D),提示成功构建pEASY-Blunt M2-SNX17。
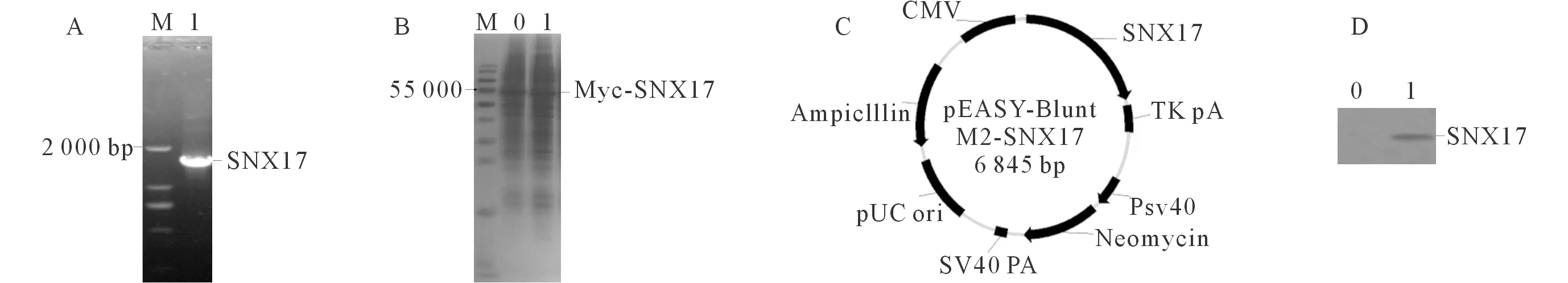
A: SNX17基因扩增;B: HEK293T/pEASY-Blunt M2(0)和HEK293T/pEASY-Blunt M2-SNX17(1)细胞中提取的总蛋白;C:pEASY-Blunt M2-SNX17的质粒图;D:Western blot验证细胞HEK293T/pEASY-Blunt M2(0)与HEK293T/pEASY-Blunt M2-SNX17(1)细胞中SNX17的表达。图2 Myc-SNX17的表达与鉴定
2.3 LRP4与SNX17相互作用的鉴定结果 抗Myc单克隆抗体磁珠与His-LRP4胞内区混合后未沉淀出LRP4胞内区,如再与Myc-SNX17 混合同时沉淀出SNX17与LRP4胞内区(图3)。抗His单克
隆抗体磁珠与Myc-SNX17混合后未沉淀出SNX17,再与His-LRP4胞内区混合则同时沉淀出SNX17与LRP4胞内区(图4)。
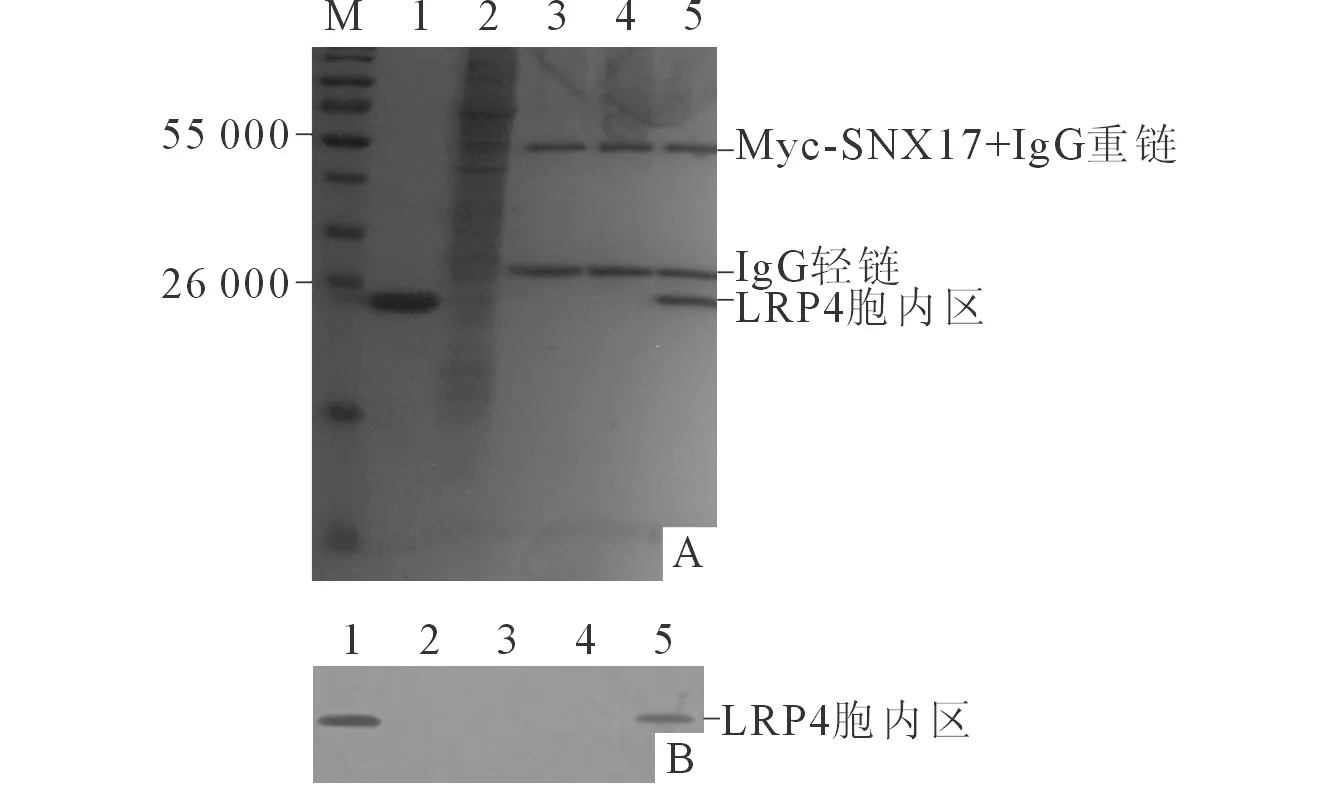
M:Marker;1:His-LRP4胞内区;2:Myc-SNX17;3:抗Myc单克隆抗体磁珠;4:抗Myc单克隆抗体磁珠+His-LRP4胞内区;5:抗Myc单克隆抗体磁珠+ His-LRP4胞内区+Myc-SNX17。图3 抗Myc单克隆抗体磁珠介导的Co-IP电泳图(A)及Western blot图(B)
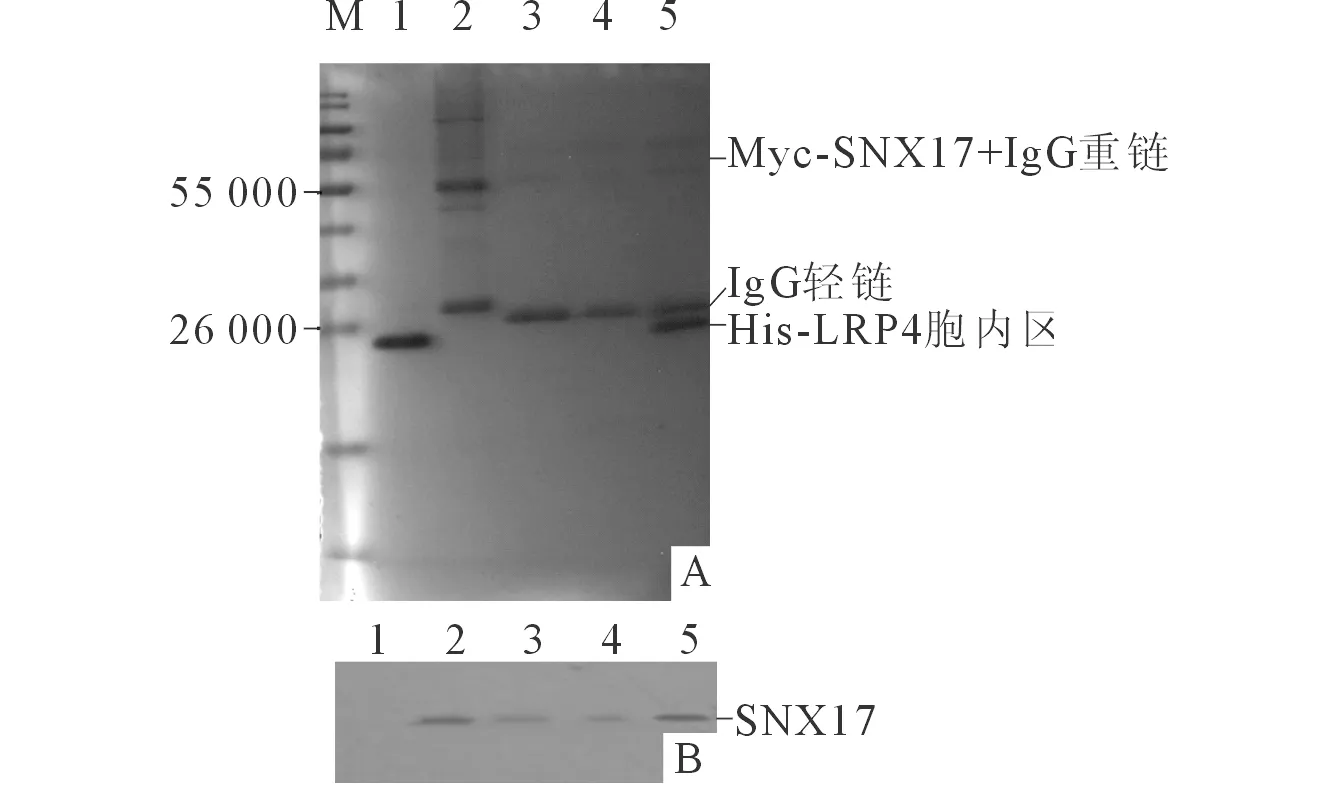
M:Marker;1:His-LRP4胞内区;2:抗Myc单克隆抗体磁珠+Myc-SNX17;3:抗His单克隆抗体磁珠;4:抗His单克隆抗体磁珠+Myc-SNX17;5:抗His单克隆抗体磁珠+Myc-SNX17+His-LRP4胞内区。图4 抗His单克隆抗体磁珠介导的Co-IP电泳图(A)及Western blot图(B)
3 讨论
MG是自身抗体介导、细胞免疫依赖、补体参与的以NMJ信号传递障碍为特征的一种自身免疫性疾病。MG主要有两种病理变化:一是胸腺异常[9],二是NMJ突触后膜(终板膜)AChR数量减少[10];主要涉及三种抗体:AChR抗体、MuSK抗体和LRP4抗体[11]。LRP4属LDLR家族中的一员,通常情况下,LRP4作为受体蛋白与突触前膜运动神经元纤维末梢分泌的聚集蛋白结合,促进MuSK发生酪氨酸磷酸化,诱导nAChR聚集于终板膜,更好地接收来自突触前膜的神经递质乙酰胆碱,传导神经冲动[12-13]。LDLR家族拥有相似的蛋白质结构和膜拓扑学特征,最先发现的LDLR家族成员是作为LDL细胞内化的膜受体。有研究[14]显示,在LDL与LDLR结合诱发细胞内化过程中,位于初级内体的SNX17可与LDLR胞内区域结合,引导LDLR逃避溶酶体降解,重新回到细胞膜发挥受体的功能,从而加速细胞对LDL的摄取。
LRP4位于NMJ的突触后膜,以及脑和脊髓中的运动神经元上,已确定为集聚蛋白受体,作为第三个自身抗原在MG患者中出现。高浓度AChR的突触后折叠是信号从神经到肌肉高效传导的关键。MuSK是突触后膜的形成、维护和再生必不可少的分子。神经元释放的集聚蛋白结合LRP4,形成复合物,进而激活MuSK,形成LRP4-MuSK-nAChR功能单元,这表明LRP4是维持NMJ的结构和功能完整性是必需的[15]。SNX17的FERM-Like基元与LRP1胞内区NPxY基元相结合。生物信息学分析结果显示,LRP1与LRP4同属于LDLR家族成员[16],具有相同的NPxY基元,因此,SNX17与LRP4具有相互结合的结构基础。
为了明确SNX17与LRP4之间是否能够相互作用,作者构建了原核表达载体pET30a-LRP4胞内区和真核表达载体pEASY-Blunt M2-SNX17,分别表达His-LRP4胞内区和Myc-SNX17,通过抗Myc单克隆抗体磁珠与抗His单克隆抗体磁珠进行双向的Co-IP鉴定,初步结果显示LRP4胞内区与SNX17能够发生相互作用,提示SNX17可能通过与LRP4结合,诱导LRP4肌细胞内的循环再利用,募集nAChR,修复受损的NMJ。但是,SNX17是否结合于LRP4胞内区NPxY基元仍需进一步研究。
[1]SOUZA PV,BATISTELLA GN,LINO VC,et al.Clinical and genetic basis of congenital myasthenic syndromes[J].Arq Neuropsiquiatr,2016,74(9):750
[2]KIM N,STIEGLER AL,CAMERON TO,et al.Lrp4 is a receptor for agrin and forms a complex with MuSK[J].Cell,2008,135(2):334
[3]朱明振,张婧,张迎娜,等.重症肌无力患者肌细胞分拣微管连接蛋白17的表达及作用[J].中华实验外科杂志,2015,32(11):2754
[4]FARFAN P,LEE J,LARIOS J,et al.A sorting nexin 17-binding domain within the LRP1 cytoplasmic tail mediates receptor recycling through the basolateral sorting endosome[J].Traffic,2013,14(7):823
[5]BURDEN JJ,SUN XM,GARCA AB,et al.Sorting motifs in the intracellular domain of the low density lipoprotein receptor interact with a novel domain of sorting nexin-17[J].J Biol Chem,2004,279(16):16237
[6]LI YH,LU WY,MARZOLO MP,et al.Differential functions of members of the low density lipoprotein receptor family suggested by their distinct endocytosis rates[J].J Biol Chem,2001,276(21):18000
[7]许贤豪.重症肌无力研究新展望[J].中华神经科杂志,1997,30(2):67
[8]CUI XZ,JI XY,GAO F,et al.Evaluation of the new classification and surgical strategy for myasthenia gravis[J].Am Surg,2012,78(12):1329
[9]GAO F,ZHAO XE,ZHANG J,et al.Clinical features of patients with myasthenia gravis from the Henan province, China[J].Muscle Nerve,2016,53(5):711
[10] SCHODROWSKI J, SEIPELT M, ADIBI-SEDEH I, et al. Myasthenia gravis[J]. Der Internist,2016,57(4):349
[11]ZISIMOPOULOU P,BRENNER T,TRAKAS N.Serological diagnostics in myasthenia gravis based on novel assays and recently identified antigens[J].Autoimmun Rev,2013,12(9):924
[12]YUMOTO N,KIM N,BURDEN SJ.Lrp4 is a retrograde signal for presynaptic differentiation at neuromuscular synapses[J].Nature,2012,489(7416):438
[13]LIYANAGE Y,HOCH W,BEESON D,et al.The agrin/muscle-specific kinase pathway:new targets for autoimmune and genetic disorders at the neuromuscular junction[J].Muscle Nerve,2002,25(1):4
[14]STEINBERG F,HEESOM KJ,BASS MD,et al.SNX17 protects integrins from degradation by sorting between lysosomal and recycling pathways[J].J Cell Biol,2012,197(2):219
[15]MARINO M,SCUDERI F,SAMENGOD,et al.Flow cytofluorimetricanalysis of anti-LRP4(LDL receptor-related protein 4) autoantibodies in Italian patients with myasthenia gravis[J].PLoS One,2015,10(8):e0135378
[16]OHAZAMA A,PORNTAVEETUS T,OTA MS,et al.Lrp4:A novel modulator of extracellular signaling in craniofacial organogenesis[J].Am J Med Genet A,2010,152A(12):2974
(2016-10-18收稿 责任编辑赵秋民)
Expression of LRP4 intracellular region and its interaction with SNX17 in muscle cells from patients with myasthenia gravis
ANYing1),LYUJie2),ZHANGYingna2),GAOFeng2),ZHANGJing2),FANGHua2),LIQianru3),DUYing3),ZHANGQingyong4),WANGJinlan1),ZHANGYunke5)
1)DepartmentofNeurology,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014 2)DepartmentofNeuroimmunology,InstituteofMedicalandPharmaceuticalSciences,ZhengzhouUniversity,Zhengzhou450052 3)DepartmentofImmunology,CollegeofBasicMedicalSciences,ZhengzhouUniversity,Zhengzhou450001 4)DepartmentofThoracicSurgery,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014 5)DepartmentofRehabilitation,InstituteofRehabilitationMedicine,HenanUniversityofTraditionalChineseMedicine,Zhengzhou450000
low density lipoprotein receptor-related protein 4;sorting nexin 17;myasthenia gravis;co-immunoprecipitation
Aim: To explore the interaction between LRP4 and SNX17 at the neuromuscular junction(NMJ) in patients with myasthenia gravis(MG).Methods: We constructed prokaryotic expression vector pET30a-LRP4 intracellular region,transformed it intoE.coliBL21(DE3) bacteria and induced expression of His-LRP4 intracellular region with relative molecular weight of about 17 800; we constructed eukaryotic expression vector pEASY-Blunt M2-SNX17, transfected it into HEK293T cells and expressed Myc-SNX17 with relative molecular weight of about 53 000.Then we used two-way co-immunoprecipitation to verify whether there was interaction between LRP4 and SNX17.Results: We constructed prokaryotic expression vector pET30a-LRP4 intracellular region and eukaryotic expression vector pEASY-Blunt M2-SNX17 successfully; Anti-Myc-tag mAb-magnetic beads mixed with His-LRP4 did not occur co-precipitation, while those mixed with Myc-SNX17 showed co-precipitation; Anti-His-tag mAb-magnetic beads mixed with Myc-SNX17 did not occur co-precipitation, while those mixed with His-LRP4 intracellular region showed co-precipitation. Conclusion: Prokaryotic expression LRP4 intracellular region and eukaryotic expression SNX17 can combine directlyinvitro.
*国家自然科学基金资助项目 81471545;河南省高等学校重点科研项目计划 16A320010,17A320046;河南省科技攻关计划项目 172102
3010298;河南省高校科技创新团队项目 16IRTSTHN022
10.13705/j.issn.1671-6825.2017.02.006
R746.1