SPK1基因转染的UCMSC移植对EAE小鼠的治疗作用*
许春阳,薛 鹏,花琳琳,李金凤,刘新珊,张达矜,徐志秀,王姗姗,尹红蕾,张 辉,
张玉镇2),王运良1)#,段海峰5)#
1)郑州大学第二附属医院神经内科 郑州 450014 2)中国人民解放军第148医院神经内科 山东淄博 255300 3)首都医科大学三博脑科医院神经内科 北京 100093 4)海军总医院海战伤研究所 北京 100037 5)军事医学科学院放射与辐射医学研究所 北京 100850
SPK1基因转染的UCMSC移植对EAE小鼠的治疗作用*
许春阳1),薛 鹏1),花琳琳1),李金凤2),刘新珊3),张达矜4),徐志秀1),王姗姗2),尹红蕾2),张 辉2),
张玉镇2),王运良1)#,段海峰5)#
1)郑州大学第二附属医院神经内科 郑州 450014 2)中国人民解放军第148医院神经内科 山东淄博 255300 3)首都医科大学三博脑科医院神经内科 北京 100093 4)海军总医院海战伤研究所 北京 100037 5)军事医学科学院放射与辐射医学研究所 北京 100850
#通信作者:王运良,男,1964年11月生,博士,教授,研究方向:神经病学,E-mail:wangyunliang81@163.com;段海峰,男,1973年6月生,博士,教授,研究方向:白血病的干细胞治疗,E-mail:duanhf0720@163.com
多发性硬化;脐带间充质干细胞;鞘氨醇激酶1;实验性自身免疫性脑脊髓炎;小鼠
目的:观察鞘氨醇激酶1(SPK1)基因转染的脐带间充质干细胞(UCMSC)移植对实验性自身免疫性脑脊髓炎(EAE)小鼠的疗效。方法:将C57BL/6小鼠分为对照组(12只)、EAE组、UCMSC组和UCMSC-SPK1组;后3组进行免疫诱导以制备EAE模型,每组11只。以第一次注射抗原当日为第0天,UCMSC组和UCMSC-SPK1组小鼠分别在免疫后第14、21、28天通过尾静脉注射UCMSC和UCMSC-SPK1,对照组和EAE组注射同等体积的生理盐水。每日采用双盲法进行小鼠神经功能缺损评分;第33天,ELISA法检测外周血IFN-γ、TNF-α、IL-17和L-4水平,分别采用HE和Fast-blue(LFB)染色观察并进行脊髓炎性细胞浸润评分、脱髓鞘评分,免疫组化法检测脊髓GFAP和MBP的表达,流式细胞术检测脾脏中调节性T细胞和NK细胞比例。结果:与EAE组比较,UCMSC-SPK1组和UCMSC组小鼠神经功能缺损评分、脊髓炎性细胞浸润评分和脱髓鞘评分降低,脾脏调节性T细胞比例升高、NK细胞比例降低;UCMSC-SPK1组变化更为显著(P<0.05);UCMSC-SPK1组脊髓GFAP表达较EAE组下降,MBP表达增强(P<0.05),外周血IFN-γ、TNF-α、IL-17水平降低,IL-4水平升高(P<0.05)。结论:UCMSC-SPK1移植能较UCMSC更为显著地修复EAE小鼠神经功能损伤。
多发性硬化(multiple sclerosis,MS)是一种免疫介导的中枢神经系统慢性、炎性脱髓鞘性疾病。MS的病理特征主要表现为慢性髓鞘脱失,伴随着轴突的损害和神经元的丢失[1-2]。目前,MS的病因及发病机制尚未明确,常见的治疗方法有短期、大剂量的糖皮质激素脉冲疗法,免疫调节治疗(如干扰素β、醋酸格拉默和米托蒽醌)等。这些方法虽然可以减缓MS的进展,降低该病的复发率,但长期应用往往会导致严重的不良反应,例如抑郁、感染、心脏毒性、恶心和贫血等[3]。因此,寻找疗效好、副作用低的药物迫在眉睫。
脐带来源的间充质干细胞(umbilical cord mesenchymal stem cell,UCMSC)具有伦理一致性、易获得性、低免疫原性、强大的体外扩增和多谱系分化能力等优点,目前已经开始用于治疗一些自身免疫性疾病,例如类风湿性关节炎、1型糖尿病和脑脊髓炎等,并取得了一定的疗效[4-5]。 鞘氨醇-1-磷酸(sphingosine-1-phospate,S1P)作为一种鞘氨醇磷酸化后的产物,主要由鞘氨醇激酶1(sphingosine kinase 1,SPK1)催化产生。研究表明,S1P信号途径在体内许多生理和病理生理过程中发挥重要作用。S1P受体调节剂芬戈莫德(FTY720)已在临床上广泛应用于复发-缓解型MS的治疗[6-7]。作者选用实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠作为模型,将携带SPK1基因的腺病毒感染UCMSC,观察UCMSC-SPK1对EAE模型小鼠的疗效,探讨UCMSC-SPK1对MS的治疗前景。
1 材料与方法
1.1 试剂、抗体和细胞 兔抗多克隆抗体胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和髓鞘碱性蛋白(myelin basic protein,MBP)均购自Sigma公司,SPK1多克隆抗体购自美国Abcam公司,荧光单克隆抗体抗鼠PE-NK-1.1、APC-CD3、FITC-CD4、PE-CD25购自美国Biolegend公司。ELISA检测试剂盒、流式细胞仪购自Biosciences公司。UCMSC和携带SPK1基因的腺病毒(Ad-SPK1)均由军事医学科学院二所三室馈赠,参考文献[8-9]制备UCMSC-SPK1,Ad-SPK1最佳感染复数为200,Western blot法检测证实UCMSC-SPK1高表达SPK1。
1.2 EAE模型构建及实验分组 SPF级健康雌性C57BL/6小鼠48只,体重16~20 g,购自军事医学科学院实验动物中心。根据体重随机选取12只作为对照;余36只小鼠按照文献[10-11]进行免疫诱导以制备EAE模型,至发病高峰期(即诱导后第13天),3只小鼠死亡,剩余33只随机分为EAE组(11只)、UCMSC组(11只)和UCMSC-SPK1组(11只)。以第一次注射抗原当日为第0天,UCMSC组和UCMSC-SPK1组小鼠分别在免疫后第14、21、28天通过尾静脉注射5.5×106mL-1的UCMSC和UCMSC-SPK1 0.1 mL,对照组和EAE组注射同等体积的生理盐水。
1.3 小鼠神经功能缺损评分 每日监测EAE临床症状,并采用双盲法进行神经功能缺损评分(持续评分33 d):不发病为0分,尾巴张力降低或轻度步态笨拙为1分,轻度后肢力量减弱为2分,后肢明显力量减弱为3分,后肢瘫痪为4分,后肢瘫痪合并前肢力量减弱或濒死状态为5分。
1.4 小鼠外周血中IFN-γ、TNF-α、IL-4和IL-17的检测 第33天,每组11只小鼠眼球取血并收集于1.5 mL EP管中室温静置30 min,4 ℃12 000 r/min离心15 min,吸取上层血清,-20 ℃保存备用。按照ELISA试剂盒说明书检测外周血中IFN-γ、TNF-α、IL-17及IL-4的含量。
1.5 小鼠脊髓组织学观察 第33天,随机从每组中抽取5只小鼠进行脊髓组织学观察。小鼠腹腔注射20 g/L戊巴比妥钠麻醉,无菌条件下剖开胸腔,暴露心脏,经左心室灌注生理盐水至肝脏变白,然后改用40 g/L多聚甲醛灌注,立即取出脊髓浸入40 g/L多聚甲醛中后固定,石蜡包埋,5 μm厚切片,常规HE染色观察脊髓炎性细胞浸润、Fast-blue(LFB)染色观察脱髓鞘改变。炎性细胞浸润评分标准:0分,没有炎性细胞;1分,少数散在的炎性细胞;2分,炎性细胞聚集浸润在血管的周围;3分,广泛的血管套形成并延伸入邻近实质区域,或实质区域浸润而无明显的血管套形成。脱髓鞘评分标准:0分:无髓鞘脱失;1分,1个小的脱髓鞘病灶;2分,2~3个脱髓鞘小病灶;3分,1~2个大的脱髓鞘病灶;4分,广泛髓鞘脱失且脱髓鞘面积大于白质总面积的20%。
1.6 小鼠脊髓GFAP和MBP的表达 第33天,取1.5制备的脊髓标本切片检测脊髓中GFAP和MBP的表达。石蜡切片脱蜡至水,体积分数3%H2O2孵育10 min,蒸馏水冲洗,PBS浸泡5 min,置枸橼酸盐缓冲液中于微波炉里进行抗原修复;切片自然冷却后滴加GFAP(1500稀释)和MBP(1100稀释)兔多克隆抗体4 ℃过夜,PBS洗5 min×3次,滴加50 μL辣根过氧化物酶标记的山羊抗兔IgG二抗,37 ℃孵育30 min,PBS洗5 min×3次;DAB显色,镜检控制显色,自来水终止;充分冲洗后苏木精复染,脱水透明,中性树胶封片。应用BIO-RAD公司的Quantity One软件进行图像分析。
1.7 小鼠脾脏NK-1.1、CD3、CD4、CD25的表达 第33天,取上述5只小鼠的脾脏研磨后制成单细胞悬液,加入PE-NK-1.1、APC-CD3、FITC-CD4、PE-CD25,4 ℃避光孵育30 min,然后用含体积分数1%胎牛血清的PBS洗涤,收集1×106个细胞,通过流式细胞仪(Biosciences公司)进行检测,并用FlowJo
软件(三星)分析数据。
1.8 统计学处理 使用SPSS10.0进行数据分析。4组间各指标的比较采用单因素方差分析,两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1 4组小鼠神经功能评价 小鼠神经功能缺损评分变化情况见图1。对照组小鼠神经功能正常。从第13天开始,余3组小鼠陆续显现出EAE发病的迹象,主要表现为尾部运动迟缓和后肢瘫痪,这些症状往往在第16~27天逐渐加重,出现一侧肢体瘫痪或完全瘫痪,甚至濒临死亡;然而,第19~24天,UCMSC-SPK1和UCMSC组小鼠的神经功能缺损评分较EAE组小鼠降低, UCMSC-SPK1组降低的更明显。
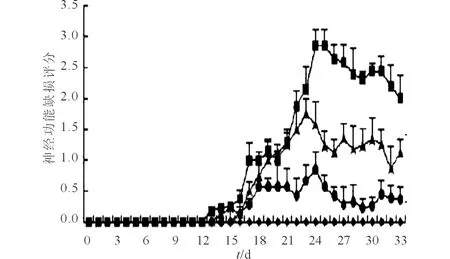
图1 小鼠神经功能缺损评分
2.2 4组小鼠外周血中IFN-γ、TNF-α、IL-4及IL-17水平的比较 与对照组小鼠比较,EAE组小鼠血清IFN-γ、TNF-α和IL-17水平增加,IL-4水平降低;与EAE组和UCMSC组小鼠比较,UCMSC-SPK1组小鼠IFN-γ、TNF-α和IL-17水平降低,IL-4水平增加,且达对照组水平,见表1。

表1 4组小鼠外周血中IFN-γ、TNF-α、IL-17和IL-4水平的比较 ng/L
*:与对照组比较,P<0.05;#:与EAE组比较,P<0.05;△:与UCMSC组比较,P<0.05。
2.3 4组小鼠脊髓组织学变化 对照组小鼠脊髓组织学表现正常,未有炎性细胞浸润,未发生脱髓鞘改变。与EAE组小鼠比较,UCMSC组和UCMSC-SPK1组小鼠炎性细胞浸润、脱髓鞘程度明显改善,并且UCMSC-SPK1组变化更明显,见图2、表2。

1~4:分别为对照组、EAE组、UCMSC组、UCMSC-SPK1组;A:HE染色;B:LFB染色。图2 4组小鼠脊髓组织学表现(×100)

表2 3组小鼠脊髓炎性细胞浸润和脱髓鞘评分的比较
*:与EAE组比较,P<0.05;#:与UCMSC组比较,P<0.05。
2.4 4组小鼠脊髓GFAP和MBP的表达 见图3、表3。与对照组比较,EAE组小鼠脊髓中GFAP表达增加,MBP表达降低;与EAE组和UCMSC组比较,UCMSC-SPK1组GFAP表达明显降低,MBP表达明显升高,并达对照组水平。
2.5 4组小鼠脾脏NK细胞和调节性T细胞比例的比较 见表4。UCMSC和UCMSC-SPK1组小鼠脾脏NK细胞比例较EAE组降低,调节性T细胞比例上升。
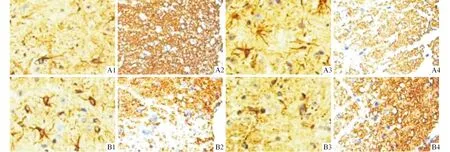
1~4:分别为对照组、EAE组、UCMSC组、UCMSC-SPK1组;A:GFAP;B:MBP。图3 4组小鼠GFAP和MBP在脊髓中的表达(×100)
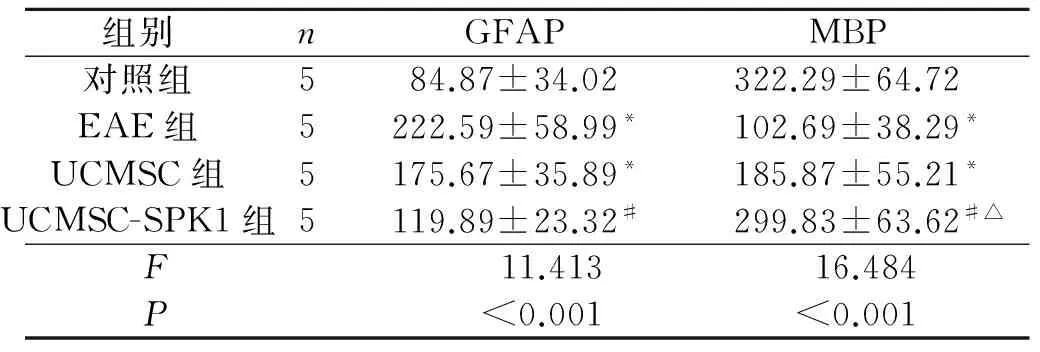
表3 免疫组化检测EAE小鼠脊髓中GFAP和MBP表达的比较
*:与对照组比较,P<0.05;#:与EAE组比较,P<0.05;△:与UCMSC组比较,P<0.05。
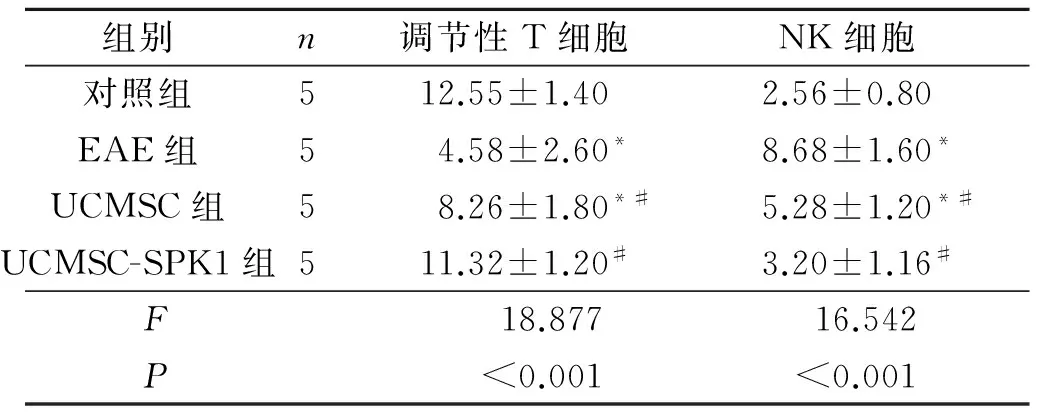
表4 4组小鼠NK细胞和调节性T细胞比例 %
*:与对照组比较,P<0.05;#:与EAE组比较,P<0.05。
3 讨论
近年来,MSCs移植作为一种新兴的治疗手段被广泛用于MS的治疗[12]。以往的研究[13]表明,经UCMSC治疗的MS患者复发率和EDSS得分显著降低,且未发现有明显的不良反应。用携带IL-4基因的慢病毒转染脂肪源MSC,其高水平表达IL-4,并有助于抑制MS发病过程中的炎性反应和中枢神经系统的保护,提示适当的基因修饰可使MSC具有更多的生物活性,从而带来更好的治疗效果[14]。SPK1是体内代谢产生S1P的关键酶,而S1P作为一种鞘脂类的代谢产物,在血管再生、炎症反应、细胞生长和免疫细胞运输过程中发挥重要作用。芬戈莫德(FTY720)作为一种S1P类似物,其治疗性或预防性应用能显著减少EAE模型动物脊髓中淋巴细胞的浸润,其作用机制主要是通过抑制初级和次级淋巴器官中淋巴细胞的溢出,降低外周血中淋巴细胞数量,从而减少中枢神经系统淋巴细胞的浸润[15]。因此,将二者结合起来治疗MS有望取得较好的疗效。
作者用携带SPK1基因的腺病毒转染UCMSC,观察了UCMSC-SPK1对EAE模型小鼠的干预效果。结果显示, UCMSC-SPK1和UCMSC组小鼠神经功能缺损评分较EAE组小鼠明显降低,脊髓炎性细胞浸润和脱髓鞘评分亦显著降低,并且UCMSC-SPK1组变化更显著;UCMSC-SPK1组小鼠脊髓星形胶质细胞标记物GFAP表达较EAE组和UCMSC组降低,MBP表达升高。在成人中枢神经系统,星形胶质细胞作为一种主要的细胞类型影响着与EAE相关的行为学、组织学和生物化学的终端事件[16]。上述结果说明,UCMSC-SPK1对EAE小鼠神经系统的损伤有较UCMSC更为显著的修复作用。
在MS/EAE发病过程中,调节性T细胞在维持免疫耐受和调节效应T细胞介导的自身免疫反应中发挥重要作用[17-19]。该研究中,作者观察到,EAE组小鼠脾脏调节性T细胞比例显著降低,NK细胞比例明显升高,外周血中炎性因子IFN-γ、 TNF-α和IL-17水平显著增加,而IL-4水平下降。而UCMSC-SPK1和UCMSC组上述指标均明显改善,并且UCMSC-SPK1组尤为明显。近年来的研究[20]显示,典型的炎性细胞因子如IFN-γ、TNF-α和IL-17等主要由Th1和Th17细胞产生,这些因子攻击髓鞘和轴突,使髓鞘脱失和轴突受损,引起中枢神经系统的损伤。UCMSC-SPK1可能通过抑制NK细胞增生,减轻了炎性因子IFN-γ、 TNF-α和IL-17等的释放,从而减轻了中枢神经系统的损伤。
综上所述,UCMSC-SPK1移植可以明显改善EAE小鼠神经功能缺损症状及缩短、延缓MS病程,这为MS的治疗提供了一种新的思路和方法,其具体机制也将会是一个有价值的研究方向。
[1]FROHMAN EM,RACKE MK,RAINE CS.Multiple sclerosis:the plaque and its pathogenesis[J].N Engl J Med,2006,354(9):942
[2]CASTEGNA A,PALMIERI L,SPERA I,et al.Oxidative stress and reduced glutamine synthetase activity in the absence of inflammation in the cortex of mice with experimental allergic encephalomyelitis[J].Neuroscience,2011,185(3):97
[3]CURSIEFEN S,FLACHENECKER P,TOYKA KV,et al.Escalating immunotherapy with mitoxantrone in patients with very active relapsing-remitting or progressive multiple sclerosis[J].Eur Neurol,2000,43(3):186
[4]CASTRO-BORRERO W,GRAVES D,FROHMAN TC,et al.Current and emerging therapies in multiple sclerosis:a systematic review[J].Ther Adv Neurol Disord,2012,5(4):205
[5]E-MORRIS M,CALDWELL B,MENCHER KJ,et al.Nurse-directed care model in a psychiatric hospital:a model for clinical accountability[J].Clin Nurse Spec,2010,24(3):154
[6]SPIEGEL S,MILSTIEN S.The outs and the ins of sphingosine-1-phosphate in immunity[J].Nat Rev Immunol,2011,11(6):403
[7]SCHWALM S,PFEILSCHIFTER J,HUWILER A.Sphingosine-1-phosphate:a Janus-faced mediator of fibrotic diseases[J].Biochim Biophys Acta,2013,1831(1):239
[8]OKADA T,KAJIMOTO T,JAHANGEER S,et al.Sphingosine kinase/sphingosine 1-phosphate signalling in central nervous system[J].Cell Signal,2009,21(1):7
[9]BRINKMANN V.Sphingosine 1-phosphate receptors in health and disease: mechanistic insights from gene deletion studies and reverse pharmacology[J].Pharmacol Ther,2007,115(1):84
[10]O′ NEILL EJ,DAY MJ,WRAITH DC.IL-10 is essential for disease protection following intranasal peptide administration in the C57BL/6 model of EAE[J].J Neuroimmunol,2006,178(1/2):1
[11]KASARELLO K,KWIATKOWSKA-PATZER B,LIPKOWSKI AW,et al.Oral administration of lactococcus lactis expressing synthetic genes of myelin antigens in decreasing experimental autoimmune encephalomyelitis in rats[J].Med Sci Monit,2015,21:1587
[12]FREEDMAN MS,BAR-OR A,ATKINS HL,et al.The therapeutic potential of mesenchymal stem cell transplantation as a treatment for multiple sclerosis:consensus report of the International MSCT Study Group[J].Mult Scler,2010,16(4):503
[13]LI JF,ZHANG DJ,GENG TC,et al.The potential of human umbilical cord-derived mesenchymal stem cells as a novel cellular therapy for multiple sclerosis[J].Cell Transplant,2014,23(1):S113
[14]CONSTANTIN G,MARCONI S,ROSSI B,et al.Adipose-derived mesenchymal stem cells ameliorate chronic experimental autoimmune encephalomyelitis[J].Stem Cells,2009,27(10):2624
[15]BRINKMANN V.FTY720(fingolimod) in Multiple Sclerosis:therapeutic effects in the immune and the central nervous system[J].Br J Pharmacol,2009,158(5):1173
[16]BRACCHI-RICARD V,LAMBERTSEN KL,RICARD J,et al.Inhibition of astroglial NF-κB enhances oligodendrogenesis following spinal cord injury[J].J Neuroinflammation,2013,10(1):92
[17]SAKAGUCHI S.Regulatory T cells:key controllers of immunologic self-tolerance[J].Cell,2000,101(5):455
[18]LISTON A,RUDENSKY AY.Thymic development and peripheral homeostasis of regulatory T cells[J].Curr Opin Immunol,2007,19(2):176
[19]FLETCHER JM,LALOR SJ,SWEENEY CM,et al.T cells in multiple sclerosis and experimental autoimmune encephalomyelitis[J].Clin Exp Immunol,2010,162(1):1
[20]REZAEI N,AMIRGHOFRAN Z,NIKSERESHT A,et al.In vitro effects of sodium benzoate on Th1/Th2 deviation in patients with multiple sclerosis[J]. Immunol Invest,2016,45(7):679
(2016-08-03收稿 责任编辑王 曼)
Efficacy of SPK1-transfected UCMSC transplantation on mouse with experimental autoimmune encephalomyelitis
XUChunyang1),XUEPeng1),HUALinlin1),LIJinfeng2),LIUXinshan3),ZHANGDajin4),XUZhixiu1),WANGShanshan2),YINHonglei2),ZHANGHui2),ZHANGYuzhen2),WANGYunliang1),DUANHaifeng5)
1)DepartmentofNeurology,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014 2)DepartmentofNeurology,the148thHospitalofPLA,Zibo,Shandong255300 3)DepartmentofNeurology,SanboBrainHospital,CapitalMedicalUniversity,Beijing100093 4)NavalWarfareInstitute,NavalGeneralHospital,Beijing100037 5)InstituteofRadiationMedicine,AcademyofMilitaryMedicalSciences,Beijing100850
multiple sclerosis;umbilical cord mesenchymal stem cells;sphingosine kinase 1;experimental autoimmune encephalomyelitis;mouse
Aim: To investigate the efficacy of transplantation of umbilical cord mesenchymal stem cell(UCMSC) transfected by sphingosine kinase 1(SPK1) gene on experimental autoimmune encephalomyelitis(EAE) mouse.Methods: C57BL/6 mice were allocated into 4 groups: control group(n=12), EAE group(n=11), UCMSC group(n=11) and UCMSC-SPK1 group(n=11);the mice in the latter 3 groups were immunized to induce EAE model. Regarding the day for the first injection of antigen as day 0, the mice in UCMSC group and UCMSC-SPK1 group were given UCMSC or UCMSC-SPK1 by tail vein injection on 14th, 21st, 28th day, while the control group and EAE group were given the same volume of physiological saline injections. Neural function defect scale was performed daily using double blind method; on 33rd day, the peripheral blood levels of IFN-γ,TNF-α,IL-17 and IL-4 were determined by ELISA, spinal inflammatory cell infiltration and demyelination were scored by HE and LFB staining, MBP and GFAP expressions in spinal cord were detected by immunohistochemistry, and the proportion of regulatory T cells and NK cells in the spleen were obtained by flow cytometry. Results: Compared with those of EAE group, neural function defect scale in UCMSC-SPK1 group and UCMSC group significantly reduced, spinal inflammatory cell infiltration score and demyelination score reduced, the proportion of regulatory T cells in the spleen increased and NK cells proportion decreased(P<0.05), and the changes in UCMSC-SPK1 group was more significant(P<0.05). GFAP expression of UCMSC-SPK1 group fell and that of MBP enhanced, IFN-γ,TNF-α,IL-17 levels in peripheral blood decreased and IL-4 level increased when compared with those of EAE group(P<0.05). Conclusion: UCMSC-SPK1 could significantly improve neurological function recovery in EAE mice than UCMSC.
10.13705/j.issn.1671-6825.2017.02.003
*国家自然科学基金青年基金项目 81201760
R744.5+1