参芍口服液对2型糖尿病大鼠肝脏超微结构及氧化应激的影响
贾春新 张红利 李海鸥 张春来
华北理工大学 河北唐山 063000;①唐山工人医院
参芍口服液对2型糖尿病大鼠肝脏超微结构及氧化应激的影响
贾春新 张红利 李海鸥 张春来①
华北理工大学 河北唐山 063000;①唐山工人医院
①目的 探讨参芍口服液对2型糖尿病大鼠肝脏超微结构及氧化应激的影响。②方法 通过高脂饲料及小剂量腹腔注射链佐菌素(STZ)建立2型糖尿病大鼠模型。造模成功后,参芍组及正常+参芍组给予参芍口服液8mL/(kg·d)灌胃,对照组及模型组给予等量生理盐水灌胃,均干预8周。分别于造模前、药物干预前、8周实验末测大鼠空腹血糖及腹主动脉取血测谷草转氨酶(AST)、谷丙转氨酶(ALT)变化及肝脏组织测超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)和丙二醛(MDA)的含量。HE染色观察肝脏形态,透射电镜观察肝细胞超微结构的改变。③结果 参芍口服液能减轻肝脏损伤程度,使肝索排列整齐,脂肪变性减少,保护肝脏超微结构,脂滴减少,线粒体排列规整,线粒体嵴清晰可见;MDA含量减少、SOD、GSH-Px、CAT含量增加。④结论 参芍口服液能抑制2型糖尿病大鼠肝脏氧化应激反应,改善肝脏超微结构,对肝脏具有保护作用。
2型糖尿病 肝损伤 氧化应激 超微结构 参芍口服液
糖尿病(Diabetes Mellitus,DM)是一种以血糖持续升高为主,伴随心、脑、肾、眼、周围神经等多部位、多器官受损的慢性疾病,但糖尿病引起的肝脏病变被大多数临床医生和患者忽略[1]。糖尿病引起的肝损伤主要是肝脏结构和功能的改变,是糖尿病慢性并发症之一,包括非酒精性脂肪肝病(Nonalcoholic fatty liver disease,NAFLD)、肝脏组织纤维化、非特异性肝功能损伤、肝脏体积增大以及口服糖尿病相关降糖药物导致的肝损伤等。肝脏内具有很多抗氧化酶类及抗氧化物质,如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)等内源性抗氧化酶,可清除活性氧及氧化损伤代谢产物丙二醛(MDA)以维持细胞正常的氧化还原状态,是反应细胞受氧化应激损伤的指标之一[2,3]。研究证实,氧化应激与糖尿病及其并发症的发生发展关系密切,氧化和抗氧化系统失衡、慢性炎症反应可能与糖尿病的并发症相关[4,5]。Lemmens等[6]人发现NAFLD患者氧化应激水平显著高于正常人群。
参芍口服液具有活血化瘀、调节脂质代谢、减轻炎症反应、减轻纤维化、清除氧自由基、保护线粒体结构和功能等作用[7]。本实验通过高脂饲料加小剂量链佐菌素(STZ)诱导2型糖尿病大鼠模型,探讨参芍口服液对其肝脏超微结构及氧化应激的影响。
1 材料与方法
1.1 药品与仪器 参芍口服液(10mL/支,河北省唐山工人医院制剂室制备,批准文号:冀药制字Z20050957)。药物组成:丹参250g、黄茂250g、赤芍药150g、当归150g、川芍75g、桃仁125g、红花75g、水蛭187.5g、地龙250g、清半夏125g。STZ为美国Sigma公司产品;SOD、GSH-Px、CAT和MDA、谷丙转氨酶(AST)、谷草转氨酶(ALT)试剂盒均购自南京建成生物工程研究所。莱卡(EG1150G)包埋机,莱卡(Rm2245)切片机;全波段酶标仪(SpectraMax 190)、日立(H-7650)透射电镜;超薄切片机;奥林巴斯BX53全自动显微镜;美国强生血糖分析仪。
1.2 实验动物及分组 大鼠由华北理工大学医学实验动物中心提供,动物证号SCKK(京)2015-0038。将大鼠按照随机数字表法随机分为模型组、对照组、参芍组、对照+参芍组,每组15只。
1.3 模型建立 以标准饮食适应性饲养1周后,模型组及参芍组给予高脂饲料饲养1个月后开始造模。造模前禁食水12小时,测空腹血糖。腹腔注射小剂量STZ 25mg/kg,连续3天血糖值≥11.1mmol/L造模成功。对照组和对照+参芍组等体积注射柠檬酸缓冲液,72h后测血糖值。均<11.1mmol/L。
1.4 药物干预 造模成功后参芍组和对照组+参芍组给予参芍口服液8mL/(kg·d)灌胃治疗,模型组和对照组给予等体积生理盐水灌胃。共8周,实验末测各组大鼠空腹血糖。
1.5 标本采集
1.5.1 血清AST、ALT测定 腹主动脉采血,4℃、3000r/min离心10分钟制备血清,全自动生化分析仪按说明书操作检测肝功能。
1.5.2 肝组织SOD、GSH-Px、CAT、MDA含量测定 制肝脏匀浆,按照试剂说明书操作测定SOD、GSH-Px、 CAT和MDA含量。
1.5.3 HE染色 切取相同的肝脏部位,立即冰生理盐水冲洗,分别放入4%多聚甲醛固定24h,常规脱水、透明,石蜡包埋,切片、脱蜡至水进行HE染色。
1.5.4 肝组织电镜标本制备 切取肝右叶戊二醛固定,送华北理工大学电镜实验室。

2 结果
2.1 各组大鼠造模前后及治疗后空腹血糖 治疗前与对照组、对照+参芍组比较,模型组、参芍组血糖明显升高(P<0.05),说明2型糖尿病模型造模成功。药物治疗8周后参芍组与模型组相比血糖降低,但差异无统计学意义(P>0.05),说明参芍口服液不具有降低血糖作用,见表1。
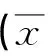
表1 大鼠造模前及药物治疗前后血糖变化±s,mmol/L)
注:与对照组相比,*P<0.05

表2 大鼠血清AST、
注:与对照组相比,*P<0.05;与模型组相比,#P<0,05
2.2 大鼠AST、ALT含量变化 与对照组相比模型组ALT、AST明显升高,差异有统计学意义(P<0.05);与模型组相比参芍组ALT、AST明显降低,差异有统计学意义(P<0.05)。与对照组相比较对照+参芍组AST、ALT含量无明显改变,见表2。
2.3 大鼠肝脏组织SOD、GSH-Px、CAT、MDA含量变化 与对照组相比,模型组抗氧化酶类SOD、GSH-Px、CAT含量明显减低,MDA含量明显升高,差异有统计学意义(P<0.05),说明体内氧化与抗氧化系统失衡,存在氧化应激反应。与模型组相比参芍组SOD、GSH-Px、CAT含量增加,MDA含量减低,差异有统计学意义(P<0.05),说明参芍口服液具有抑制氧化应激反应的作用。与对照组相比对照+参芍组各项指标差异无统计学意义(P>0.05),见表3。

表3 大鼠肝脏组织SOD、GSH-Px、CAT、MDA含量比较
注:与对照组相比,*P<0.05;与模型组相比,#P<0,05
2.4 大鼠肝脏HE染色结果 图A:对照组肝脏HE染色肝小叶结构完整中央静脉结构清晰,无扩张、充血肝索排列整齐,肝窦无扩张,无气球、玻璃样变、脂肪变及间质无水肿,未见炎细胞浸润。图B和图A结果相一致,说明参芍口服液对肝脏结构无损伤作用。图C:模型组可见肝细胞排列紊乱,肝细胞水肿,脂肪变性,肝窦变窄、扩张。图D:参芍组肝细胞脂肪变减少,肝索排列较规则,中央静脉较完整,见图1。

A:对照组(×200) B对照+参芍组(×200)

C:糖尿病模型组(×200) D:参芍组(×200)
图1 大鼠肝脏HE染色(×200)

A:对照组(×4000) B:对照+参芍组(×4000)

C:模型组(×4000) D:参芍组(×4000)
图2 大鼠肝脏超微结构的变化
2.5 大鼠肝脏超微结构的变化 图4对照组肝细胞结构形态基本正常;细胞核圆形,位于细胞的中央,核内染色质分布均匀,核仁居中,细胞质内细胞器丰富。粗面内质网(RER)呈层状排列,其表面有核糖体附着;线粒体形态多为圆形或椭圆形,线粒体嵴稀疏短小,清晰可见;内质网丰富,排列整齐,图B与图A结果一致主,细胞超微结构完整。图C模型组细胞结构不清晰,多数肝细胞胞质内出现肿胀空泡和大量的脂滴,部分肝细胞坏死,胞核皱缩,胞质疏松,细胞器崩解;线粒体肿大,空泡,RER轻度扩张,结构不清晰,肝窦结构紊乱破坏。参芍组肝细胞内脂滴明显减少,可见线粒体分布均匀,线粒体嵴清晰可见,内质网丰富,见图2。
3 讨论
肝脏是人体重要的消化腺,具有调节脂质代谢及血糖(糖原的合成、分解、储存等)作用。糖尿病性肝损伤是指糖尿病所造成的肝脏病理变化及功能减退:NAFLD、肝脏组织纤维化、非特异性肝功能损伤、肝脏体积增大以及口服糖尿病相关降糖药物导致的肝损伤等[8]。肝脏作为长期高血糖累及的靶器官之一,由于其代偿功能较强、早期的肝脏损害常常不明显等原因,糖尿病肝损害不容易引起人们的注意,胰岛素抵抗的患者直到发生糖尿病、高血压、高血脂以及血管疾病时才被发现肝损伤。研究表明糖尿病合并肝脏损伤的高达50%以上[9]。
糖尿病引起的肝损伤的病理变化为肝糖原沉积、脂肪变性、炎症细胞浸润及纤维化,甚至发生脂肪坏死[10~12]。本实验通过高脂饲料喂养及小剂量STZ 25mg/kg腹腔注射建立2型糖尿病大鼠模型,通过实验发现模型组血糖水平明显升高、体重下降、多饮、多尿等表现。实验发现,模型组血清谷AST、ALT升高,提示2型糖尿病大鼠肝脏损伤。HE染色结果显示,模型组肝细胞排列紊乱、水肿、脂肪变性,肝窦间隙变窄,炎症细胞浸润,肝小叶间隔不清。透射电镜显示肝细胞内出现肿胀空泡和大量脂滴,胞器稀疏,部分肝细胞坏死,细胞核皱缩,线粒体肿胀,线粒体嵴模糊、断裂融合,粗面内质网扩张,结构不清晰,高尔基体排列紊乱,与文献报道一致[13~15]。参芍口服液由丹参、黄芪、当归、川芎、赤芍、桃仁、红花、地龙、水蛭、清半夏组成,具有活血化瘀、调节脂质代谢、减轻炎症反应、减轻纤维化、清除氧自由基、保护线粒体结构和功能的作用[16~18]。实验发现参芍口服液治疗后HE结果显示肝细胞脂肪变减轻,肝索排列趋于正常,可分清小叶间隔,透射电镜显示肝细胞内脂滴减少,可见线粒体嵴,高尔基体、内质网排列整齐,糖原颗粒增多。说明参芍口服液能够改善肝脏损伤,可能对肝脏具有保护作用。
糖尿病患者由于胰岛素抵抗及胰岛素分泌不足引起血糖升高,同时由于胰岛素抵抗及胰岛素不充足,导致血糖利用减低,供给能量减少,不能满足机体能量需求,代偿性的导致脂肪分解增加,使体内游离脂肪酸增加,过多的游离脂肪酸进入线粒体发生β氧化,释放大量活性氧自由基(reactive oxygen species,ROS)损伤线粒体膜,损伤肝细胞,影响肝功能。Day等[19]提出了“二次打击”学说,认为初次打击主要是胰岛素抵抗和脂质代谢紊乱,导致肝脏内脂肪堆积造成肝细胞脂肪变性,并增加肝脏对其他有害因素的敏感性;第二次打击主要是氧化应激与脂质过氧化损伤,导致炎性因子释放增多使肝细胞发生炎症、坏死或凋亡,促进有毒物质损伤线粒体或肝细胞,病程进一步发展为脂肪性肝炎,肝纤维化甚至肝硬化[20]。有学者认为,脂肪的过度摄入与氧化应激在其发病过程中起了重要作用,过度的脂肪堆积可直接由脂质过氧化引发氧化应激,并激活炎症反应性信号通路中一些关键因子如核因子(nuclear factor kappa B NF-κB)等,进而激发炎症反应,产生大量的致炎因子,后者又进一步扩大氧化应激反应,导致肝损伤进一步加重[21~24]。CAT是体内重要的自由基清除剂,可分解过氧化氢产生水,减轻或者阻断脂质过氧化的作用[25];SOD是体内抗氧化酶,能够清除超氧阴离子;GSH-Px主要催化过氧化氢转变为水及催化有机氢过氧化物(ROOH)还原为ROH。防止过氧化物对细胞膜结构及功能损伤,防止过氧化物进一步水解产生MDA。MDA是脂质过氧化作用的最终产物,可与机体内多种蛋白质相互作用,破坏组织细胞的结构和功能。实验结果显示模型组肝脏组织MDA明显升高,SOD、GSH-Px、CAT减低,说明肝脏氧化与抗氧化系统失衡,肝脏发生强烈的氧化应激反应,同时透射电镜显示肝细胞中线粒体肿胀,空泡变性,线粒体嵴断裂,内质网扩张,结构不清晰,进而影响了蛋白质的合成,导致细胞凋亡、坏死,肝细胞受损。本组实验结果显示参芍组较模型组MDA含量减低,SOD、CAT、GSH-Px含量升高,透射电镜超微结构的变化说明参芍口服液能抑制氧化应激反应,保护肝细胞重要细胞器免受损伤或减少受损程度,保护肝细胞。
综上所述,高脂饲料及小剂量STZ腹腔注射,能够成功建立2型糖尿病大鼠模型,并且发现高血糖能够引起肝脏的损伤。参芍口服液既往用于冠心病、动脉粥样硬化的治疗,能够调节脂质代谢,减轻血管炎症反应、抗氧化作用。本实验证实参芍口服液能够改善肝脏结构的变化,抑制氧化应激反应,有保护肝脏作用,详细机制尚不明确,可能与参芍口服液抑制氧化应激反应、改善脂质代谢、抗炎、活血化瘀的药理作用相关,具体机制有待进一步探讨。
[1] 熊盛池,熊 利,余登国.糖尿病大鼠肝纤维化对血糖变化的影响及其机制[J].中国医药科学,2013,3(5):34-36
[2] Szuchman-Sapir A,Etzman M,Tamir S.Human atherosclerotic plaque lipid extract impairs the antioxidant defense capacity of monocytes[J].Res Commun,2012,423(4):884-888
[3] Teodoro BG,Natali AJ,Fernandes SA,et al.Improvements of atherosclerosis and hepatic oxidative stress are independent of exercise intensity in LDLr(-/-) mice[J].Peluzio Mdo C.J Atheroscler Thromb,2012,19(10):904-911
[4] Menon V,Ram M,Dom J,et al.Oxidative stress and glscose levels in a population-based sample[J].Diabet Med,2004,21(12):1346-1352
[5] 蒙广星,袁 强,王毅军,等.糖尿病大鼠肝脏β-defenses表达及血清炎症因子的变化[J].第四军医大学学报,2009,30(7):591-594
[6] Lemmens KJ,Van de Wier B,Koek GH,et al.The flavonoid monoHER promotes the adaption to oxidative stress during the onset of NAFLD[J].Biochem Biophys Res Commun,2015,456(1):179-182
[7] 李 霞,贺博然,纪 征,等.宽心合剂对大鼠心脏急性缺血-再灌注损伤后心肌纤维化的影响[J].中国中医基础医学杂志,2010,16(7):599-600
[8] 刘丽丽,杨 成.中西医治疗糖尿病性肝损伤的研究进展[J].中医药临床杂志,2011,23(8):741-743
[9] 高 磊,邹志强,孙荣玲,等.糖尿病在肝损伤患者中的危险性分析[J].中国医药导报,2012,9(30):30-32
[10] Younossi ZM,Gramlich T,Liu YC,et al.Nonalcoholic fatty liver disease:assessment of variability in pathologic interpretations[J].Mod Pathol,1998,11:560-565
[11] Gawrieh S,Knoedler DM,Saeian K,et al.Effects of interventions on intra- and inter observer agreement on interpretation of nonalcoholic fatty liver disease histology[J].Ann Diagn Pathol,2011,15:19-24
[12] Hossain N,Afendy A,Stepanova M,et al.Independent predictors of fibrosis in patients with nonalcoholic fatty liver disease[J].Clin Gastroenterol Hepatol,2009,7:1224-1229
[13] 刘 影,刘 涛,赵晓军,等.地黄寡糖对2型糖尿病大鼠糖脂代谢及肝脏超微结构的影响[J]. 中国现代应用药学,2014,31(11):1312-1316
[14] 张 欣,党双锁,程延安,等.大黄素和黄芪多糖对实验性肝损伤大鼠肝脏超微结构的影响[J].西安交通大学学报(医学版),2009,30(4):502-505
[15] 何 丽,郭 盛,刘昌玉.活血化瘀对营养性肥胖大鼠血脂、脂质过氧化损害及肝脏超微结构的影响[J].中医药学刊,2002,31(4):456-458
[16] 薛忠文.参芍口服液对大鼠主动脉粥样硬化的疗效及其机制[D].石家庄:河北医科大学,2013
[17] 薛忠文,董天崴,张 琦,等.参芍口服液对冠状动脉粥样硬化大鼠主动脉IL-8、VCAM-1和ICAM-1表达的影响[J].中成药,2012,35(11):2077-2081
[18] 张 琦,李映雪,刘晓堃,等.参芍口服液对动脉粥样硬化大鼠血脂和血管活性物质的影响[J]. 中国动脉硬化杂志,2014,22(9):921-924
[19] Day CP,James OF.Steatohepatitis:a tale of two “hits”?[J].Gastroenterology,1998,114(4):842-845
[20] Cai D,YuanM,Frantz DF,et al.Local and systemic insulin resistance resulting from hepatic activation of IKK-beta and NF-kappaB[J].Nat Med,2005,11(2):183-190
[21] Farrell GC,Larter CZ.Nonalcoholic fatty liver disease:from steatosis tocirrhosis[J].Hepatology,2006,43(Suppl 1):S99-5112
[22] Hotamisligil GS.Role of endoplasmic reticulum stress and c-Jun NH2-terminal kinase pathways in inflammation and origin of obesity and diabetes[J].Diabetes,2005,54(Suppl 2):S73-S78
[23] Arkan MC,Hevener AL,Greten FR,et al.IKK-beta links inflammation toobesity-induced insulin resistance[J].Nat Med,2005,11(21):191-198
[24] Ramadori G,Christ B.Cytokines and the hepatic acute-phase response[J].Semin Liver Dis,1999,19(2):141-155
[25] Shah A,Latoo S,Ahmed I,et al.Midline segmental odontomaxillary dysplasia[J].Ann Maxillofac Surg,2012,2(2):185-189
(2016-09-29 收稿)(张爱国 编辑)
Effects of Shenshao oral liquid on liver ultrastructure and oxidative stress in type 2 diabetic rats
JIAChunxin,ZHANGHongli,LIHaiou,etal
(NorthChinaUniversityofScienceandTechnology,Tangshan063000,China)
Objective To explore the effect of Shenshao oral liquid on liver ultrastructure and oxidative stress in type 2 diabetic rats. Methods Establishment of type 2 diabetes mellitus model by high fat diet and low dose intraperitoneal injection of STZ. Treatment group and normal add Shenshao group were given Shenshao oral liquid 8mL/(kg·d), other groups were given equivalent normal salinea total of 8 weeks. Measurement of fasting blood glucose before inducing diabetes,drug intervention,the end of the experiment.Measured serum AST,ALT and liver tissue superoxide dismutase(SOD),glutathione peroxidase(GSH-Px),catalase (CAT) and malondialdehyde (MDA) content. HE staining was used to observe the morphology of liver. The ultrastructural changes of hepatic cells were observed by transmission electron microscope. Results Shenshao oral liquid could reduce the degree of liver injury,hepatic cord arranged in neat rows,fat denaturation,protected the liver ultrastructure,decreased of lipid droplets,mitochondria arranged in neat,mitochondrial crista clearly visible. MDA content decreased with the increase of SOD, GSH-Px and hydrogen peroxide CAT content. Conclusion Shenshao oral liquid can inhibit type 2 diabetic rat liver oxidative stress response and improve the liver ultrastructure, have a protective effect on the liver.
Type 2 diabetes.Hepatic injury.Oxidative stress.Ultrastructural.Shenshao oral liquid
贾春新(1990-),男,硕士研究生。研究方向:糖尿病及并发症。
张春来。
R
A
2095-2694(2017)02-131-6

