系统性硬化症的流行病学研究
陈响响+丁月+邹和建+王久存

摘 要 系统性硬化症是一种罕见的自身免疫病,患者生活质量差,严重者危及生命,但其致病原因尚不明确。本文对系统性硬化症的流行病学研究有助于加深对该病的了解。
关键词 系统性硬化症 流行病学 罕见病
中图分类号:R593.25 文献标识码:A 文章编号:1006-1533(2017)S1-0017-05
Epidemiological study of systemic sclerosis*
CHEN Xiangxiang1**, DING Yue1**, ZOU Hejian2, WANG Jiucun1***
(1.School of Life Sciences, Fudan University, Shanghai 200438, China; 2.Division of Rheumatology, Huashan Hospital, Fudan University, Shanghai 200040, China)
ABSTRACT Systemic sclerosis (SSc) is a rare autoimmune disease, which can result in the poor quality of life to the patients and even threaten their lives if the condition is severe. However, its etiology and pathogenesis are not very clear at present. Thus, the epidemiological study of SSc will be of benefit to deepening understanding of the disease.
KEY WORDS systemic sclerosis; epidemiology; rare disease
系统性硬化症(systemic sclerosis, SSc),即硬皮病,是以小血管功能、结构异常及皮肤、内脏等组织纤维化为特征的自身免疫疾病。在易感基因和外源致病因素(某些病毒感染、粉尘、有机溶剂等)作用下,激活免疫系统,活化或损伤血管内皮细胞,导致成纤维细胞增生,引致胶原和细胞外基质过度生成和沉积,最终可导致多组织多器官纤维化。系统性硬化症主要分为肢端型硬皮病(或称局限型硬皮病,limited cutaneous systemic sclerosis, lSSc)和弥漫型硬皮病(diffuse cutaneous systemic sclerosis, dSSc),前者一般不侵袭内脏,而后者会累及内脏,且因其肺部受累多见,因而病死率高,预后差,近年来越来越受到重视。然而系统性硬化症的发病在不同地区、不同人群中存在差异。本文对系統性硬化症的流行特征、危险因素及三级预防进行阐述,有助于加深对该病的了解,为其病理研究提供线索。
1 流行特征
1.1 地区分布
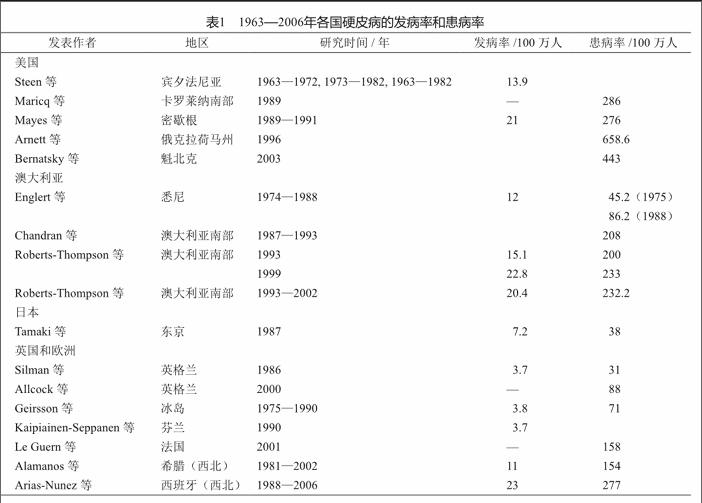
本病的流行表现出地域的差异。发病率和患病率根据地理位置和方法学的不同存在很大的差异,每年发病率在2.3~22.8/100万人范围内波动,患病率在50~300/100万人范围内波动[1]。1980年美国风湿病学会(American College of Rheumatology, ACR)提出了系统性硬化症分类标准来区分SSc和其他结缔组织疾病,之后的研究都通过此项分类标准划分硬皮病。通过多年的研究与完善,2013年ACR和欧洲抗风湿病联盟(European League Against Rheumatism, EULAR)联合制定了2013版系统性硬化症分类标准,为以后系统性硬化症流行病学研究提供了更可靠的依据。
从地域上看,日本和欧洲的系统性硬化症发病率和患病率均低于美国和澳大利亚。2011年阿根廷研究报道,1999—2004年期间对98 642名人员的调查发现其平均发病率为21.1/100万人,患病率为296/100万人;2011年台湾健康保险中心和国家死亡人员登记处共同研究数据表明,台湾地区系统性硬化症的发病率约为10.9/100万人,患病率约为56.3/100万人。表1总结了各国系统性硬化症的发病率和患病率[2]。到目前为止,有关中国SSc患者的流行病学研究资料仍较少,故没有中国系统性硬化症发病率的相关报道。
1.2 时间分布
美国、澳大利亚、欧洲等国不论是系统性硬化症的发病率还是患病率都在呈上升的趋势,女性发病率的上升趋势尤为明显。美国该病的发病率从1947年的0.6/100万人上升到1991年的19/100万人;在澳大利亚,发病率从1982年的12/100万人上升到1999年的22/100万人,接近于2倍的增长趋势,患病率也从1993年的200/100万人上升到2002年的232.2/100万人[3]。患病率上升的原因有可能源于生存率的提高。
2007年Steen和Medsger研究发现[4],生存率的提高归因于诊断技术的提高和有效地治疗硬皮病肾危象,且肺纤维化和肺动脉高压已取代硬皮病肾危象成为系统性硬化症死亡的主要原因。研究发现,近年来硬皮病肾危象在中围人群中明显减少。2010年EULAR和EULAR硬皮病试验研究组(EULAR Scleroderma Trials and Research, EUSTAR)对5 680名系统性硬化症患者的调查发现,有55%的患者因系统性硬化症而死亡,各种死因占比分别为:肺纤维化19%、肺动脉高压14%、系统性硬化症心肌衰弱14%、硬皮病肾危象4%、系统性硬化症胃肠道病变3%[6]。
1.3 人群分布
1.3.1 性别分布
世界各国系统性硬化症发病率和患病率都表现为女性高于男性。SSc发病的男性与女性的性别比在不同研究报道中稍有不同,由1:1到1:14不等,男性与女性的性别比平均为1:3[7]。SSc的女性患者多于男性,可能是由于环境暴露的不同,也有可能是荷尔蒙环境的影响,但确切原因仍不明确。
2006年EULAR研究报道,dSSc中男女患病比为1:4,而在lSSc中为1:11,女性发生雷诺现象的平均时间要比男性早;在自身抗体方面,男性中抗着丝粒抗体(ACA)阳性率低于女性;在lSSc中,女性的ACA阳性率高而男性的抗拓扑异构酶抗体Scl-70(又称ATA)阳性率高[8]。另外,系统性硬化症患者的临床指标也存在着性别差异,如男性患者有更高的血清肌酐、血细胞比容和肌酸磷酸激酶(CPK)含量[2]。
本实验室对中国系统性硬化症的研究资料显示,我国的SSc高发人群也为女性,与国外研究结果一致[9]。
在过去的报道中,恶性肿瘤与硬皮病的相关性研究时而出现矛盾的结果[10]。最近丹麦国家注册中心在1997—2006年期间的一项研究中发现222例系统性硬化症患者被确诊患有癌症,且男性比女性有更高的癌症发病率,而最常见的恶性肿瘤是吸烟相关和酒精相关的癌症[11]。另一项肿瘤相关研究是在英格兰西南部的一个队列研究中,研究者基于区域医疗和年龄分组对同时患有系统性硬化症和恶性肿瘤患者进行了研究,在68名患者中确诊了15名恶性肿瘤患者。虽然系统性硬化症病例总数有限,但其相对危险度高达3.15(95% CI 1.77~5.20),最常见的是血液类恶性肿瘤[10]。男性比女性有更高的癌症发病率这一观点有待进一步研究证实。
1.3.2 年龄分布
系统性硬化症极少在儿童时期发病,疾病高发于中老年时期。Steen等[12]发现,女性生育时期系统性硬化症的发病率高于更大的年龄组别,认为该现象可能与女性荷尔蒙、怀孕有关。
2006年EULAR研究报道[8],在3 656名该病患者中,dSSc患者平均患病年龄比lSSc患者小5.1岁。本项目组对354例中国系统性硬化症患者进行了分析,发现抗U1RNP抗体阳性患者的平均发病年龄明显低于抗U1RNP抗体阴性患者[(35.38±12.45)相对于(39.80±12.81),P<0.01][13]。
1.3.3 种族分布
同一地区不同种族系统性硬化症发病率、死亡率和严重情况均有显著差异。如美国宾夕法尼亚州,黑人女性发病年龄(45~54岁)早于白人女性(55~64岁)[12];2001年一项法国的多种族调查发现,欧洲人患病率为140.2/100万人,而非欧洲人(法国北部民族、撒哈拉沙漠以南的非洲裔、亚洲裔等)患病率为210.8/100万人,约为欧洲人患病率的1.5倍[14]。在抗体方面,白种人患者存在最高的ACA阳性率[15],中国人患者仅为13.4%[9];而ATA阳性率最高的种族为北美印第安人,高达71%[16],中国人為59.9%,美国白人仅为18.7%[9];本项目组研究结果显示中国SSc患者的U1RNP抗体阳性率为18.0%[13],明显高于美国2.8%的阳性率[9],表明差异可能与种族有关。
本项目组于2013年对中国419位系统性硬化症患者的血清学及临床特征进行了分析,并与欧洲裔美国患者进行了比较[13]。与国外资料显示的lSSc多见有所不同的是,在中国系统性硬化症患者中,弥漫型多于肢端型[9, 13]。另外,Low等[5]曾对36例加拿大的华裔系统性硬化症患者进行回顾性分析,并与300例欧裔患者进行对比,发现华裔患者中没有出现硬皮病肾危象者,且病情相对较轻。除此之外,还得出一系列华裔患者与欧裔患者不同临床表现的结论(表2)。中美人群在血清学及临床特征中的差异详见表3。
这些研究都表明与种族相关的遗传因素均潜在影响着系统性硬化症的发病机制。
2 危险因素
目前报道的系统性硬化症危险因素包括环境因素、遗传因素、免疫异常等。
2.1 环境因素
系统性硬化症的发生受环境危险因素的影响,如X射线反复照射有可能会发生特发性硬皮病,二氧化硅、溶剂、氯乙烯、有毒石油、色氨酸、氨苯砜、钆、博来霉素和镇痛剂等亦能导致系统性硬化症相关疾病。
有研究表明,虽然吸烟不是导致SSc的危险因素,但可能促使硬皮病病情加重[2]。2017年1月发表的一篇关于系统性硬化症的职业和环境暴露的研究发现,无论是病例对照研究(总OR 2.81,P<0.001)还是队列研究(总RR 17.52,P<0.001)均显示二氧化硅暴露能够增加系统性硬化症的致病风险。同样,能够增加系统性硬化症的致病风险的环境/职业因素包括溶剂(总OR 2.0,P = 0.001)和环氧树脂(总OR 2.97,P < 0.001)。研究并未发现农药和焊接烟气对系统性硬化症致病风险的影响。但对于女性硅胶移植,病例对照研究和列队研究结果相悖。
2.2 易感基因
基因易感性研究已进行了多年,也取得了较多成果。非环境暴露研究表明,美洲印第安人的特异易感基因分别为Cw4,DRB1 * 1602(DR2)DQA1 * 0501, DQB1* 0301(DQ7)[16]。2011年Bames等[2]发现HLA-DRB1 * 0407和HLADRB1 * 1304为硬皮病肾危象的特异危险因素,他们证实,弥漫型系统性硬化症和抗RNA聚合酶III抗体阳性也是硬皮病肾危象的风险因素;2011年一项GWAS研究表明[2],系统性硬化症易感性以及疾病严重程度受到遗传因素的影响,易感位点存在于HLA / MHC区域以及非MHC区域。截止目前,已有数十个与系统性硬化症发病或亚型相关的HLA及非HLA区域的易感基因被发现。随着高通量测序技术的不断发展,已经有越来越多的系统性硬化症易感基因被不断筛选出来,充分说明遗传因素在系统性硬化症发病过程中的重要作用。
2.3 免疫異常
系统性硬化症是一种自身免疫性疾病,常和其他系统性或器官特异性自身免疫病重叠,最常见的有系统性红斑狼疮、多肌炎,也包括类风湿关节炎、干燥综合征;器官特异性自身免疫疾病有桥本甲状腺炎和原发性胆汁性肝硬化。多数该种硬皮病患者存在伴发疾病特征和特异性的实验室异常,但不足以诊断第二种疾病。系统性硬化症的早期即有免疫学的异常并产生包括抗拓扑异构酶I抗体、抗着丝点抗体等多种自身抗体、T淋巴细胞亚群的分布异常、局部单核细胞浸润等,但确切的作用机制仍不清楚。目前针对系统性硬化症免疫异常的免疫抑制和免疫调控类的药物如伊马替尼、利妥昔单抗等对进展期或前期的患者有较好的治疗效果,因此进一步阐明免疫异常的机理并发现关键的生物标志物有利于制定更有效的治疗方案以及患者的个性化治疗[17]。
2.4 结缔组织生长因子(CTGF)
TGF-β诱导纤维化的发生,而结缔组织生长因子的作用则在于纤维化的维持。正常成纤维细胞中结缔组织生长因子很少表达,而在TGF-β的诱导后高度表达;早期非纤维化及萎缩消退期硬皮病患者皮损处CTGF不表达,而在全身性硬化症患者的皮肤,尤其是深部真皮的硬化病变斑块成纤维细胞中,结缔组织生长因子高水平表达[18]。此外,硬皮病患者血浆CTGF表达水平与患者皮肤硬化程度及肺纤维化存在相关性。综上可见,CTGF与纤维化的维持及疾病严重程度关系密切。
2.5 血管异常
系统性硬化症患者有广泛的血管病变,包括中动脉、小动脉、微动脉和毛细血管,偶有累及大动脉,使皮肤、胃肠道、肺、心、肾和指趾端动脉均受累,因而有人认为该病是一种血管内皮病变的结果,即原发的血管损害为明显的内膜增生,细胞在其中呈同心圆状排列,称内皮细胞纤维黏液性变[19]。
3 三级预防
3.1 高危人群
高危人群是指从事煤矿、金属矿、硅矿和化工等工作的人群,应加强这类人员的防护意识,做好劳动保护,定期查体。
3.2 个人预防
3.2.1 一级预防
多数人认为该病很可能是遗传因素、加之持久的慢性感染而造成的一种自身免疫病。部分病例常与系统性红斑狼疮、桥本甲状腺炎、类风湿关节炎、舍格伦综合征等相重叠,因而有上述危险因素的更应注意预防。措施为: ①去除感染病灶,注意卫生,加强身体锻炼,提高自身免疫功能。②生活规律,劳逸结合,心情舒畅,避免强烈精神刺激。③加强营养,禁食生冷,注意温补。
3.2.2 二级预防
1)早期诊断:可根据典型的皮肤硬化及系统性损害作出诊断。
2)早期治疗:可用糖皮质激素或其混悬液等作皮损内注射。坚持体疗和物理治疗,如音频、蜡疗等,以改善肢体挛缩,增加肢体功能,或长期口服维生素E。
3.2.3 三级预防
1)进行性系统性硬化症,进展缓慢,有些有自行缓解倾向,不要轻易停止或放弃治疗。
2)注意锻炼身体,合理的生活规律,避免情绪刺激及变化。
3)目前无特效药物治疗本病,在整个病程中,中医药疗法对该病的控制很重要。
4)有雷诺现象的患者,应注意保温,避免冷刺激。5)禁止吸烟。
4 结语
系统性硬化症因其发病率极低和临床表现的多样性,给其流行病学研究带来巨大的挑战。研究人员应该倡导及时建立多中心多国家研究,共同为该病的致病机理研究贡献力量,尽早为患者带来福音。
参考文献
[1] Gabrielli A. Scleroderma[J]. N Engl J Med, 2009, 360(19): 1989-2003.
[2] Barnes J, Mayes MD. Epidemiology of systemic sclerosis: incidence, prevalence, survival, risk factors, malignancy, and environmental triggers[J]. Curr Opin Rheumatol, 2012, 24(2): 165-170.
[3] Ranque B, Mouthon L. Geoepidemiology of systemic sclerosis[J]. Autoimmun Rev, 2010, 9(5): A311-A318.
[4] Steen VD, Medsger TA. Changes in causes of death in systemic sclerosis, 1972-2002[J]. Ann Rheum Dis, 2007, 66(7): 940.
[5] Low AH, Johnson SR, Lee P. Ethnic influence on disease manifestations and autoantibodies in Chinese-descent patients with systemic sclerosis[J]. J Rheumatol, 2009, 36(4): 787-793.
[6] Tyndall AJ, Bannert B, Vonk M, et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research(EUSTAR) database[J]. Ann Rheum Dis, 2010, 69(10): 1809.
[7] Chifflot H, Fautrel B, Sordet C, et al. Incidence and prevalence of systemic sclerosis: a systematic literature review[J]. Semin Arthritis Rheum, 2008, 37(4): 223-235.
[8] Walker UA, Tyndall A, Czirják L, et al. Clinical risk assessment of organ manifestations in systemic sclerosis: a report from the EULAR Scleroderma Trials And Research group database[J]. Ann Rheum Dis, 2007, 66(6): 754-763.
[9] Wang J, Assassi S, Guo G, et al. Clinical and serological features of systemic sclerosis in a Chinese cohort[J]. Clin Rheumatol, 2013, 32(5): 617-621.
[10] Siau K, Laversuch CJ, Creamer P, et al. Malignancy in scleroderma patients from south west England: a population-based cohort study[J]. Rheumatol Int, 2011, 31(5): 641-645.
[11] Olesen AB, Svaerke C, Farkas DK, et al. Systemic sclerosis and the risk of cancer: a nationwide population-based cohort study[J]. Br J Dermatol, 2010, 163(163): 800-806.
[12] Steen VD, Oddis CV, Conte CG, et al. Incidence of systemic sclerosis in Allegheny County, Pennsylvania. A twenty-year study of hospital-diagnosed cases, 1963-1982[J]. Arthritis Rheum, 1997, 40(3): 441-445.
[13] 丁月, 张辉, 屠文震, 等. 抗U1RNP抗体在系统性硬化症中的临床意义[J]. 复旦大学学报(医学版) , 2015, 42(6): 702-708.
[14] Guern VL, Mahr A, Mouthon L, et al. Prevalence of systemic sclerosis in a French multi-ethnic county[J]. Rheumatology (Oxford), 2004, 43(9): 1129-1137.
[15] Reveille JD. Ethnicity and race and systemic sclerosis: How it affects susceptibility, severity, antibody genetics, and clinical manifestations[J]. Curr Rheumatol Rep, 2003, 5(2): 160-167.
[16] Arnett FC, Howard RF, Tan F, et al. Increased prevalence of systemic sclerosis in a Native American tribe in Oklahoma. Association with an Amerindian HLA haplotype[J]. Arthritis Rheum, 1996, 39(8): 1362-1370.
[17] Fuschiotti P. Current perspectives on the immunopathogenesis of systemic sclerosis[J]. Immunotargets Ther, 2016, 5: 21-35.
[18] Kubo M, Ihn H, Yamane K, et al. Upregulated expression of transforming growth factor-beta receptors in dermal fibroblasts of skin sections from patients with systemic sclerosis[J]. J Rheumatol, 2002, 29(12): 2558-2564.
[19] 周茂松,嚴煜林. 硬皮病病因及发病机制的研究进展[J]. 医学综述, 2008, 14(1): 88-89.

