miR-125b在年龄相关性白内障患者晶状体前囊膜中的表达及对人晶状体上皮细胞凋亡的影响
王建民,袁祥文,刘杰慧,李建平
(1莱芜市人民医院,山东莱芜271100;2山东大学附属济南市中心医院)
miR-125b在年龄相关性白内障患者晶状体前囊膜中的表达及对人晶状体上皮细胞凋亡的影响
王建民1,袁祥文1,刘杰慧2,李建平2
(1莱芜市人民医院,山东莱芜271100;2山东大学附属济南市中心医院)
目的观察miR-125b在年龄相关性白内障(ARC)患者晶状体前囊膜中的表达变化,及miR-125b对晶状体上皮细胞凋亡的影响。方法收集ARC患者术中获取的晶状体前囊膜标本40例份为ARC组,以正常人眼晶状体前囊膜标本20例份为对照组,采用实时荧光定量PCR法检测两组的miR-125b。体外培养人晶状体上皮细胞(HLEC)-SRA01/04,将细胞分为实验组、凋亡模型组和正常组,实验组和凋亡模型组采用紫外线照射法制备晶状体上皮细胞凋亡模型。采用实时荧光定量PCR法检测凋亡模型组和正常组细胞中的miR-125b。分别将hsa-miR-125b mimics及阴性对照mimics-NC转染实验组和凋亡模型组细胞,转染后48 h采用实时荧光定量PCR法检测细胞中的miR-125b,用流式细胞仪测算细胞凋亡率,以ELISA法检测细胞中Caspase3/7活性。结果ARC组与对照组晶状体前囊膜中miR-125b相对表达量分别为0.37±0.08、1.02±0.04,两组相比,P<0.01。凋亡模型组与正常组细胞中miR-125b的相对表达量分别为0.45±0.09、1.04±0.03,两组相比,P<0.01。转染后48 h实验组与凋亡模型组细胞凋亡率分别为18.7%±1.89%、52.27%±3.14%,两组相比,P<0.01。转染后48 h实验组与凋亡模型组Caspase-3/7活性分别为168.21±27.36、359.89±36.45,两组相比,P<0.01。结论ARC患者晶状体前囊膜中miR-125b呈低表达。过表达的miR-125b能够抑制晶状体上皮细胞凋亡,降低凋亡相关酶的活性。
微小RNA125b;白内障;年龄相关性白内障;晶状体上皮细胞;细胞凋亡
年龄相关性白内障(ARC)是致盲性眼病,发病率呈逐年上升趋势[1]。ARC的发病机制目前尚未完全明确,老龄、紫外线、糖尿病、药物、辐射等因素参与了ARC的发生发展。ARC尚无有效的药物防治手段[2],因此探讨ARC发生发展的分子生物学机制,可能为白内障的预防及治疗提供新的思路。晶状体上皮细胞位于晶状体前囊膜及赤道部囊膜下,为单层立方上皮。研究[3]表明,晶状体上皮细胞凋亡是除先天性白内障以外其他所有类型白内障形成的细胞学基础。微小RNA(miRNA)是一类存在于生物体中能够调控基因表达的内源性非编码小分子RNA,可通过降解靶基因mRNA或阻止其蛋白翻译从而对下游靶基因起到调节作用,广泛参与机体细胞增殖、代谢、分化、凋亡等过程[4]。近年研究[5]发现miRNA表达在眼部呈细胞和组织特异性,在白内障的发生发展过程中起着重要的调控作用[6]。miR-125b是miRNAs家族成员之一,在多种组织中起调节细胞凋亡的作用[7,8]。目前有关miR-125b与ARC发病关系的研究甚少,为此,本研究观察了miR-125b在ARC患者晶状体前囊膜中的表达变化,及miR-125b对晶状体上皮细胞凋亡的影响。
1 材料与方法
1.1 主要实验材料 收集2016年4~7月在山东大学附属济南市中心医院眼科住院治疗的ARC患者超声乳化白内障吸除术中获取的晶状体前囊膜标本40例份(40眼)作为ARC组,患者中男15例(15眼)、女25例(25眼),年龄(59.8±12.7)岁。收集角膜移植术后正常供体眼球晶状体前囊膜标本20例份(20眼)作为对照组,患者中男7例(7眼)、女13例(13眼),年龄(54.0±10.4)岁。两组标本来源患者性别、年龄等基线资料差异无统计学意义。本研究经医院伦理委员会批准,研究对象均签署知情同意书。人晶状体上皮细胞(HLEC)-SRA01/04购自中国典型培养物保藏中心,细胞复苏后接种至含10%新生胎牛血清、1%青链霉素的a-MEM基础培养基,置于37 ℃、5% CO2、饱和湿度条件下的细胞培养箱中培养,取对数期细胞进行后续实验。hsa-miR-125b mimics及阴性对照mimics-NC均购自广州锐博生物科技公司;TRIzol试剂和LipofectamineTM2000试剂均购自Invitrogen公司;RNA逆转录试剂盒及实时荧光定量PCR试剂盒购自大连宝生生物工程公司;miR-125b和U6引物由上海吉凯生物制药公司设计合成;Anexin-FITC/PI双染细胞凋亡检测试剂盒购自南京凯基生物公司;po-ONE Homogeneous Caspase3/7检测试剂盒购自Promega公司。
1.2 ARC患者晶状体前囊膜中miR-125b表达观察 采用实时荧光定量PCR法。用TRIzol试剂提取晶状体前囊膜组织总RNA,测RNA浓度,以1 μg总RNA按逆转录试剂盒操作说明书进行反转录得到cDNA。配置实时荧光定量PCR体系,扩增条件为95 ℃ 15 s,60 ℃ 1 min,40个循环。实验重复3次,以U6作为内参,miR-125b的相对表达量以2-ΔΔCt表示。
1.3 miR-125b对晶状体上皮细胞凋亡的影响观察
1.3.1 细胞分组及晶状体上皮细胞凋亡模型制作 将HLEC-SRA01/04分为实验组、凋亡模型组、正常组。实验组和凋亡模型组参考文献[9]方法制作晶状体上皮细胞凋亡模型。取对数期的HLEC-SRA01/04,将培养液吸净,PBS冲洗2次后置于紫外灯下照射25 min,强度360 μW/cm2,光谱280~320 nm,峰值312 nm。将各组细胞以不含EDTA的胰蛋白酶消化,离心收集细胞制成单细胞悬液,每组取细胞悬液5 mL置于流式管中,依次加入5 μL的Annexin V-FITC和5 μL的PI,避光反应15 min后加入300 μL的结合缓冲液后立即送流式细胞仪测算细胞凋亡率。凋亡模型组细胞凋亡率明显高于正常组,表明晶状体上皮细胞凋亡模型制作成功。
1.3.2 细胞凋亡模型中miR-125b检测 采用实时荧光定量PCR法检测凋亡模型组与正常组细胞中的miR-125b。方法同“1.2”。
1.3.3 hsa-miR-125b mimics转染 将实验组和凋亡模型组细胞接种于96孔板,当细胞密度为30%~50%时进行转染。参照LipofectamineTM2000试剂盒说明书,分别将hsa-miR-125b mimics及阴性对照mimics-NC转染实验组和凋亡模型组细胞。经实时荧光定量PCR检测实验组和凋亡模型组细胞中miR-125b相对表达量分别为5.78±0.31、1.02±0.04,实验组细胞中miR-125b相对表达量高于凋亡模型组(P<0.01),证明转染成功。
1.3.4 各组细胞凋亡率测算 取转染后48 h的细胞进行流式细胞术检测,计算细胞凋亡率。方法同“1.3.1”。
1.3.5 Caspase-3/7活性检测 取转染后48 h的细胞,将底物与缓冲液按试剂盒说明书混合后,每孔加入100 μL的Caspase试剂混合液,摇床轻摇混匀30 s,室温避光孵育2 h,采用ELISA平板计数器测定490 nm波长处的细胞荧光强度,代表Caspase-3/7活性。
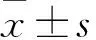
2 结果
2.1 ARC组与对照组晶状体组织中miR-125b表达比较 ARC组与对照组晶状体前囊膜中miR-125b相对表达量分别为0.37±0.08、1.02±0.04,两组相比,P<0.01。
2.2 凋亡模型组与正常组细胞中miR-125b表达比较 凋亡模型组与正常组细胞中miR-125b的相对表达量分别为0.45±0.09、1.04±0.03,两组相比,P<0.01。
2.3 实验组与凋亡模型组细胞凋亡率比较 转染后48 h实验组与凋亡模型组细胞凋亡率分别为18.7%±1.89%、52.27%±3.14%,两组相比,P<0.01。
2.4 实验组与凋亡模型组Caspase-3/7活性比较 转染后48 h实验组与凋亡模型组Caspase-3/7活性分别为168.21±27.36、359.89±36.45,两组相比,P<0.01。
3 讨论
白内障是晶状体衰老的一种表现,是多种因素作用共同作用的结果,如氧化损伤、长期紫外线照射、辐射等。晶状体上皮细胞的活性状态与晶状体的透明性密切相关,晶状体上皮细胞衰老凋亡使得其抗氧化能力下降,清除晶状体内自由基的能力下降,进而使得晶状体产生氧化损伤,导致晶状体浑浊[10]。晶状体上皮细胞凋亡在除先天性白内障之外的众多类型白内障发生过程中占有重要地位[3],但具体机制尚不完全明确。
近期研究[11]表明,miRNAs在眼部生长、发育、功能调节等方面发挥重要作用。Kubo等[12]研究发现,白内障大鼠晶状体中有100种miRNA表达水平异于正常。现已证实多种miRNA在ARC的发生发展过程中起着重要作用。miRNA在晶状体细胞增殖、分化、凋亡等过程中的调控作用对白内障发生发展的影响受到研究者的关注。Cvekl等[13]发现miR-204在促进黄斑区发育和维持晶状体透明中发挥重要作用。Wu等[14]报道高表达的miR-184与维持人类晶状体的透明性密切相关。Nishino等[15]发现高表达的let-7b可导致晶状体上皮细胞凋亡,从而可能引发白内障。黎清兰等[16]发现过表达miR-34a能够促进HLEC衰老,可能与ARC的形成有关。miR-125b有调控多种肿瘤细胞凋亡的作用[7,8],但其与晶状体上皮细胞凋亡的关系尚不明确。本研究发现,ARC患者晶状体前囊膜标本中miR-125b表达水平低于正常,提示miR-125b在ARC的发生发展中可能起到一定作用。我们通过紫外线照射制备晶状体上皮细胞凋亡模型,发现miR-125b在晶状体上皮细胞凋亡模型中的表达水平较正常晶状体上皮细胞明显降低,提示miR-125b表达异常可能与晶状体上皮细胞凋亡有关。
为进一步研究miR-125b在晶状体上皮细胞凋亡中的作用,我们将miR-125b mimics转染HLEC凋亡模型,提高细胞中miR-125b的表达水平,流式细胞术检测显示转染后细胞的凋亡率明显下降,且细胞内凋亡相关酶活性下降,进一步证实miR-125b与HLEC的凋亡有关,miR-125b表达异常在白内障的发病过程中可能起重要作用。miR-125b有望成为ARC治疗的新靶点。miR-125b调控晶状体上皮细胞凋亡的具体分子生物学机制尚不明确。Le等[7]在人神经母细胞瘤和肺成纤维细胞实验中发现miR-125b能够通过下调p53表达从而抑制细胞凋亡。Shi等[8]对雄激素受体阳性的前列腺癌细胞进行研究发现,miR-125b可通过下调促凋亡基因BAK1表达从而抑制肿瘤细胞凋亡。miR-125b在不同的组织细胞中有着不同的上游和下游调控网络,miR-125b对晶状体上皮细胞的促凋亡作用具体机制有待我们在以后实验中进一步探索。
[1] Resnikoff S, Keys TU. Future trends in global blindness[J]. Indian J Ophthalmol, 2012,60(5):387-395.
[2] Resnikoff S, Pascolini D, EtyaaleD, et al. Global data on visual impairment in the year 2002[J]. Bull World Health Organ, 2004,82(11):844-851.
[3] Bianchi E, Scarinci F, Grande C, et al. I mmunohistochemical profile of VEGF, TGF-β and PGE in human pterygium and normal conjunctiva: experimental study and review of the literature [J]. Int J Immunopathol Pharmacol, 2012,25(3):607-615.
[4] Bartel DP. MicroRNAs: genomics,biogenesis,mechanism,and function[J]. Cell, 2004,116(2):281-297.
[5] Xu S, Witmer PD, Lumayag S, et al. MicroRNA (miRNA) transcriptome of mouse retina and identification of a sensory organ-specific miRNA cluster[J]. J Biol Chem, 2007,282(34):25053-25066.
[6] Li Y, Liu S, Zhang F, et al. Expression of the microRNAs hsa-miR-15a and hsa-miR-16-1 in lens epithelial cells of patients with age-related cataract[J]. Int J Clin Exp Med, 2015,8(2):2405-2410.
[7] Le MT, Teh C, Shyh-Chang N, et al. MicroRNA-125b is a novel negative regulator of p53[J]. Genes Dev, 2009,23(7):862-876.
[8] Shi XB, Xue L, Yang J, et al. An androgen-regulated miRNA suppresses Bak1 expression and induces androgen-independent growth of prostate cancer cells[J]. Proc Natl Acad Sci U S A, 2007,104(50):19983-19888.
[9] 谭钢,吴安花,邵毅,等.miR-210靶向沉默Bcl-2诱导人晶状体上皮细胞凋亡[J].眼科新进展,2016,36(8):701-708.
[10] Qi B, Ji Q, Wen Y, et al. Lyciumbarbarumpolysaccharides protect human lens epithelial cells against oxidative stress-induced apoptosis and senescence[J]. PLoS One, 2014,9(10):e110275.
[11] Zhao JJ, Yang J, Lin J, et al. Identification of miRNAs associated with tumorigenesis of retinoblastoma by miRNA microarray analysis[J]. Childs Nerv Syst, 2009,25(1): 13-20.
[12] Kubo E, Hasanova N, Sasaki H, et al. Dynamic and differential regulation in the microRNA expression in the developing and maturecataractous rat lens[J]. J Cell Mol Med, 2013,17(9):1146-1159.
[13] Cvekl A, Mitton KP. Epigenetic regulatory mechanisms in vertebrate eye development and disease[J]. Heredity (Edinb), 2010,105(1):135-151.
[14] Wu C, Lin H, Wang Q, et al. Discrepant expression of microRNAs in transparent and cataractous human lenses[J]. Invest Ophthalmol Vis Sci, 2012,53(7):3906-3912.
[15] Nishino J, Kim I, Chada K, et al. Hmga2 promotes neural stem cell self-renewal in young but not old mice by reducing p16Ink4a andp19Arf Expression[J]. Cell, 2008,135(2):227-239.
[16] 黎清兰,郭海科,张洪祥.MicroRNA-34a对人晶状体上皮细胞衰老的影响[J].眼科新进展,2016,36(4):323-326.
10.3969/j.issn.1002-266X.2017.39.009
R776.1
A
1002-266X(2017)39-0033-03
2017-05-03)

