高糖高脂、PAF对肾小球系膜细胞PKCβI mRNA表达的影响及阿托伐他汀干预作用观察
肖艳华,何笑云,韩晴,胡小文,周素娴
(1桂林医学院,广西桂林541000;2桂林医学院附属医院)
高糖高脂、PAF对肾小球系膜细胞PKCβI mRNA表达的影响及阿托伐他汀干预作用观察
肖艳华1,何笑云1,韩晴1,胡小文1,周素娴2
(1桂林医学院,广西桂林541000;2桂林医学院附属医院)
目的观察阿托伐他汀对高糖高脂、血小板活化因子(PAF)诱导下蛋白激酶C-βI(PKCβI)mRNA表达的影响。方法取培养好的、分化成熟的人肾小球系膜细胞(HMCs)细胞分为A 正常对照组、B 高糖高脂+PAF组、C高糖高脂+PAF+PKCβI抑制剂LY333531组、D高糖高脂+PAF+阿托伐他汀组共4个组。A组加入5.5mmol/L的D-葡萄糖; B组加入30 mmol/L的D-葡糖糖、20 mg/L的溶血磷脂酰胆碱(LPC)和2×10-8mol/L的PAF C-16;C组经2×10-7mol/L的LY333531预处理1 h后,加入30 mmol/L的D-葡萄糖、20 mg/L的LPC、2×10-8mol/L的PAF C-16;D组经10 μmol/L的阿托伐他汀处理1 h后,加入30 mmol/L的D-葡萄糖、20 mg/L的LPC、2×10-8mol/L的PAF C-16。各组细胞培养24 h后,提取细胞RNA。采用实时荧光定量PCR法检测细胞中的PKCβI mRNA。结果A、B、C、D组细胞中PKCβI mRNA相对表达量分别为1.00±0.00、3.59±0.41、2.76±0.57、1.02±0.00。B组细胞中PKCβI mRNA相对表达量高于其余三组,D组PKCβI mRNA相对表达量低于B组和C组(P均<0.05)。结论高糖、高脂、PAF诱导下肾小球系膜细胞中PKCβI mRNA表达上调,阿托伐他汀作用后可抑制PKCβI mRNA表达。
肾小球系膜细胞;血小板活化因子;蛋白激酶C-βI;阿托伐他汀
有20%~40%的糖尿病患者并发糖尿病肾病(DN)[1]。系膜细胞是肾小球滤过屏障主要的组成部分,其形态或功能异常与肾功能损害密切相关[2]。蛋白激酶C(PKC)是一种能影响细胞多条信号通路的蛋白激酶[3],与细胞生长、分化、凋亡、细胞因子活化及细胞外基质合成密切相关[3]。前期细胞实验发现系膜细胞在高糖、高脂刺激下可大量分泌血小板活化因子(PAF)[4],PAF通过激活PKCβI促进细胞外基质(ECM)分泌[5],诱导肾小球硬化的发生。研究还发现HMG-CoA还原酶抑制剂阿托伐他汀不仅可下调高糖、高脂环境下系膜细胞中PAF的表达,还能有效抑制ECM的分泌,延缓肾小球硬化发展[5]。阿托伐他汀对肾脏的保护作用是否与其抑制PAF分泌、降低PKCβI表达、减少ECM分泌有关,目前尚未见报道。为此,本研究观察了高糖、高脂、PAF诱导下肾小球系膜细胞中PKCβI mRNA的表达变化,及阿托伐他汀作用后PKCβI mRNA的表达变化,进一步研究阿托伐他汀对肾脏的保护作用机制。
1 材料与方法
1.1 主要实验材料 人肾小球系膜细胞(HMCs)由东南大学孙子林教授赠予,复苏后配制成细胞悬液,分种4个培养瓶中,置于37 ℃、5%CO2的无菌培养箱中培养。D-葡萄糖购自Biomol公司,溶血卵磷脂购自Sigma公司,人Ⅳ型胶原ELISA试剂盒购自bluegene公司,人纤维连接蛋白ELISA试剂盒购自深圳晶美生物公司,PKCβI引物及逆转录试剂盒购自TaKaRa公司,GAPDH引物购自上海生工生物工程公司,小牛血清购自GIBCO公司。
1.2 高糖高脂联合PAF诱导及阿托伐他汀给药方法 预实验已筛选最适高糖、高脂浓度、最适PAF浓度、PKCβI抑制剂LY333531最适浓度和阿托伐他汀最适浓度及最适处理时间。取培养好的、分化成熟的HMCs细胞分为A、B、C、D共4个组。A组加入5.5mmol/L的D-葡萄糖;B组加入30 mmol/L的D-葡糖糖、20 mg/L的溶血磷脂酰胆碱(LPC)和2×10-8mol/L的PAF C-16;C组经2×10-7mol/L的LY333531预处理1 h后,加入30 mmol/L的D-葡萄糖、20 mg/L的LPC、2×10-7mol/L的PAF C-16;D组经10 μmol/L的阿托伐他汀处理1 h后,加入30 mmol/L的D-葡萄糖、20 mg/L的LPC、2×10-7mol/L的PAF C-16。各组细胞再置于37℃、5%CO2的无菌培养箱中培养24 h。实验重复3次。
1.3 系膜细胞中PKCβI mRNA检测 将6孔板中的细胞收集于EP管中,溶解细胞后提取细胞总RNA,并依据逆转录说明书将RNA反转录为cDNA。PKCβI mRNA上游引物序列为5′-GGGGGCGACCTCATGTAT-3′,下游引物序列为5′-GCAATTTCTGCAGCGTAAAA-3′。内参GAPDH上游引物序列为5′-GCCAAAAGGGTCATCATCTC-3′,下游引物序列为5′-GTAGAGGCAGGGATGATGTTC-3′。实时荧光定量PCR反应条件:预变性95 ℃ 10 min,变性95 ℃、10 s,退火56 ℃、20 s,延伸72 ℃、15 s,重复40次。以2-ΔΔCt表示PKCβI mRNA的相对表达量。
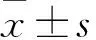
2 结果
A、B、C、D组细胞中PKCβI mRNA相对表达量分别为1.00±0.00、3.59±0.41、2.76±0.57、1.02±0.00。B组细胞中PKCβI mRNA相对表达量高于其余三组,D组PKCβI mRNA相对表达量低于B组和C组(P均<0.05)。
3 讨论
DN为糖尿病患者慢性并发症之一,且为不可逆性病变,随着病情加重,将对患者的生活质量造成严重影响。因此,研究延缓DN发病的药物对糖尿病患者至关重要。糖尿病被认为是一种慢性炎症[6,7],高糖高脂环境中ECM分泌量大大增加,而PAF作为重要的促炎症因子可进一步促进ECM分泌。PKCβI是细胞质中调控信号通路的丝氨酸/苏氨酸蛋白激酶,与细胞的分化、凋亡、促进ECM合成等密切相关[8]。PKCβI作为促进肾小球ECM形成通路中重要的一员[7],其表达量的多少与DN进展密切相关。
本研究结果显示,高糖高脂联合PAF处理可进一步促进PKCβI表达。既往体外细胞实验发现高糖可诱导PKCβI表达[9],激活PKCβI/TGF-β1途径,进而促进肾小系膜细胞分泌纤黏连蛋白和Ⅳ型胶原蛋白等ECM[10],同时活化的PKCβI通过阻断胰岛素PI3K通路中胰岛素受体底物的自身磷酸化,导致胰岛素抵抗及肾小球足细胞损伤[11]。动物实验结果显示链脲佐菌素(STZ)诱导的肾小球硬化SD大鼠糖尿病模型中PKCβI mRNA及蛋白表达也相应增加,予PKC-β抑制剂LY333531治疗后PKCβI表达显著下降,同时观察到该组大鼠24 h尿微量白蛋白水平明显下降[12]。体内实验进一步表明PKCβI表达增加与肾功能损害密切相关。
他汀类药广泛应用于临床,具有降低血脂、抗炎[13]、抗氧化[14]、内皮修复等多效性。目前关于阿托伐他汀对DN肾脏的保护机制尚未明确。Han等[15]研究显示使用阿托伐他汀可显著延缓DN患者GRF的下降速度。既往研究表明阿托伐他汀通过降低高糖、高脂环境下系膜细胞中PAF表达及ECM分泌,从而延缓肾小球硬化[16,17]。李文桐等[18]通过诱导大鼠2型糖尿病的实验发现阿托伐他汀可降低大鼠心肌细胞及主动脉中PKCβI的表达,认为阿托伐他汀具有保护血管内皮的作用。另有研究[19]表明阿托伐他汀可通过抑制PKC的表达以减轻内皮细胞在高糖诱导下的氧化应激反应。上述研究均阐明阿托伐他汀保护血管内皮细胞的作用与抑制PKCβ表达有关。我们前期实验已得知PAF、高糖、高脂通过激活PKCβI促进ECM分泌,导致肾小球硬化的发生;而LY333531则通过抑制PAF表达及高糖高脂诱导下PKCβI的表达,对DN具有保护作用[20]。本研究结果显示,经阿托伐他汀预处理(D组)后的系膜细胞中PKCβI mRNA表达量较除A组外的其他各组均显著降低,提示阿托伐他汀对系膜细胞的保护作用可能与抑制PKCβI表达有关。
综上所述,高糖高脂联合PAF诱导下肾小球系膜细胞中PKCβI mRNA表达上调,阿托伐他汀作用后可抑制PKCβI mRNA表达,从而发挥对肾小球系膜细胞的保护作用。然而目前临床糖尿病患者多应用他汀类药物降脂,阿托伐他汀对延缓DN发生是否具有积极意义仍需进一步探索和研究。
[1] 翁建平.中国2型糖尿病防治指南 (2013 年版)[J].中华糖尿病杂志,2014,7(4):4.
[2] 张婧,何风霞,邱文,等.RNA干扰沉默p300基因对亚溶解型 C5b-9诱导大鼠肾小球系膜细胞凋亡和ATF3乙酰化的影响[J].南京医科大学学报(自然科学版),2017,37(3):275-280.
[3] Geraldes P, King GL. Activation of protein kinase C isoforms and its impact on diabetic complications[J]. Circul Res, 2010,106(8):1319-1331.
[4] 周素娴,雷闽湘,赵晋晋,等.高糖高脂对系膜细胞产生细胞外基质及PAF的影响[J].中国病理生理杂志,2009,25(10):2056-2057.
[5] 何笑云,欧春麟,肖艳华,等.阿托伐他汀对高糖高脂下系膜细胞的影响[J]安徽医科大学学报,2016,51(9):1375-1377.
[6] Wang S, Li Y, Fan J, et al. Interleukin-22 ameliorated renal injury and fibrosis in diabetic nephropathy through inhibition of NLRP3 inflammasome activation[J]. Cell Death Dis, 2017,8(7):e2937.
[7] Jha JC, Banal C, Okabe J, et al. NADPH oxidase-nox5 accelerates renal injury in diabetic nephropathy[J]. Diabetes, 2017: db161585.
[8] Kawanami D, Matoba K, Utsunomiya K. Signaling pathways in diabetic nephropathy[J]. Histol Histopathol, 2016,31(10):1059-1067.
[9] Meier M, Park JK, Overheu D, et al. Deletion of protein kinase C-beta isoform in vivo reduces renal hypertrophy but not albuminuria in the streptozotocin-induced diabetic mouse model[J]. Diabetes, 2007,56(2):346-354.
[10] Nishikawa T, Edelstein D, Du XL, et al. Normalizing mitochondrial superoxide production blocks three pathways of hyperglycaemic damage[J]. Nature, 2000,404(6779):787-790.
[11] Geraldes P, King GL. Activation of protein kinase C isoforms and its impact on diabetic complications[J]. Circul Res, 2010,106(8):1319-1331.
[12] Kelly DJ, Zhang Y, Hepper C, et al. Protein kinase C β inhibition attenuates the progression of experimental diabetic nephropathy in the presence of continued hypertension[J]. Diabetes, 2003,52(2):512-518.
[13] Maraqa AD. Effect of atorvastatin on interleukins and prostaglandin E2 in the kidney of type 1 diabetic rats[J]. Eur Cytokine Netw, 2016,27(4):97-101.
[14] Saito Y. Pitavastatin: an overview[J]. Atheroscler Suppl, 2011,12(3):271-276.
[15] Han E, Kim G, Lee JY, et al. Comparison between Atorvastatin and Rosuvastatin in Renal Function Decline among Patients with Diabetes[J]. Endocrinol Metab (Seoul), 2017,32(2):274-280.
[16] 周素娴,雷闽湘,赵晋晋,等.阿托伐他汀对高糖高脂环境下人脐静脉内皮细胞与人肾小球系膜细胞相互作用的影响[J].基础医学与临床,2010,30(10):1076-1080.
[17] 傅增泮,刘丽秋.阿托伐他汀对肾小球硬化大鼠肾脏保护作用的研究[J].中国实验诊断学,2004,8(5):529-532.
[18] 李文桐,邹俊杰,石勇铨,等.通络方药对糖尿病和肥胖大鼠心肌与主动脉内皮细胞的保护作用及其机制研究[J].第二军医大学学报,2008,4(2):56.
[19] 柴大军,宁若冰,祝江,等.阿托伐他汀通过抑制PKC的激活对抗高糖诱导的人脐静脉内皮细胞氧化应激反应[J].中国病理生理杂志,2012,28(9):1537-1542.
[20] 何笑云,欧春麟,肖艳华,等.LY333531对高糖高脂下系膜细胞分泌细胞外基质的影响[J].安徽大学学报(自然科学版),2016,40(4):87-91.
EffectsofhighglucoseandlysophosphatidylcholineandPAFonPKCβImRNAexpressionofglomerularmesangialcellsandtheinterventioneffectofatorvastatin
XIAOYanhua1,HEXiaoyun,HANQing,HUXiaowen,ZHOUSuxian
(1GuilinMedicalUniversity,Guilin541000,China)
ObjectiveTo investigate the effect of atorvastatin on the PKCβI mRNA expression of high glucose and lysophosphatidylcholine (LPC) and platelet activating factor (PAF)-induced mesangial cells.MethodsHuman glomerular mesangial cells (HMCs) were divided into four groups: the normal control group (group A), high glucose and LPC+PAF group (group B), high glucose and LPC+PAF+LY333531 group (group C), and high glucose and high LPC + PAF+ atorvastatin group (group D). We added 5.5 mmol/L D-glucose to group A; group B was treated with 30 mmol/L D-glucose, 20 mg/L LPC, and 2×10-8mol/L PAF C-16; group C was pretreated with 2×10-7mol/L LY333531 for 1 h, and then was added with 30 mmol/L D-glucose, 20 mg/L LPC, and 2×10-8mol/L PAF C-16; group D was pretreated with 10 μmol/L atorvastatin for 1 h, and then was added with 30 mmol/L D-glucose, 20 mg/L LPC, 2×10-8mol/L PAF C-16. At 24 h after culture, RNA was extracted. The expression of PKCβI mRNA in the mesangial cells was detected by real-time fluorescence quantitative PCR.ResultsThe relative expression of PKCβI-mRNA in the groups A, B, C, and D was 1.00±0.00, 3.59±0.41, 2.76±0.57, and 1.02±0.00, respectively. The expression of PKCβI-mRNA in the group B group was higher than that of the other three groups, and the expression of PKCβI-mRNA in the group D was significantly lower than that of the groups B and C (allP<0.05).ConclusionsThe expression of PKCβI mRNA in high glucose and LPC and PAF-induced glomerular mesangial cells is up-regulated, and atorvastatin can inhibit the PKCβI expression.
glomerular mesangial cells; platelet-activating factor; protein kinase C-βI; atorvastatin
10.3969/j.issn.1002-266X.2017.39.007
R692.6
A
1002-266X(2017)39-0027-03
国家自然科学基金资助项目(81560148,81260134)。
肖艳华(1991-)女,硕士,主要研究方向为糖尿病肾病。E-mail: 770400919@qq.com
周素娴(1976-),女,硕士,博士生导师,主任医师,主要研究方向为糖尿病肾病。E-mail: zoe_doctor@163.com
2017-06-03)

