基于溶藻效果的溶藻细菌A21培养基成分优化
李文利++傅以钢++刘征宇++章忠辉++陆雅雅


摘要:蓝藻“水华”的暴发对人体健康、水产养殖等造成了严重影响,微生物法是一种安全、有效的水华防治方法。通过碳源及氮源的单因素试验、Plackett-Burman试验设计、响应面试验分析对A21菌株的培养基进行优化,最佳培养基配方为蔗糖6.5 g/L、酵母膏13 g/L、NaCl 0.5 g/L、K3PO4 0.5 g/L、MgSO4·3H2O 0.5 g/L、FeSO4·7H2O 0.2 g/L、CaCl2 0.15 g/L、MnSO4 0.5 g/L、pH值8.2。该培养基使A21菌株对铜绿微囊藻的叶绿素a(叶绿素a)清除效率提高了5.18%。
关键词:蓝藻;溶藻细菌;培养基;优化;Plackett-Burman试验;响应面分析
中图分类号: S182文献标志码: A
文章编号:1002-1302(2016)12-0516-05
收稿日期:2015-04-08
基金项目:国家自然科学基金(编号:21277101);上海海洋大学横向课题(编号:D-8006-13-0117)。
作者简介:李文利(1988—),女,江苏徐州人,硕士,主要从事食品微生物研究。E-mail:1067349333@qq.com。
通信作者:李晓晖,博士,副教授,主要从事食品生物技术研究。E-mail:xhli@shou.edu.cn。
人为因素导致太湖水体富营养化进程加速,于2007年暴发了大规模“水华”,给当地居民带来了恐慌[1]。近年来的监测结果显示,60%太湖水域的营养化水平处于中度污染以上,东莱水系等甚至达到重度污染,其余水域均为轻度污染[2-4]。微囊藻是太湖蓝藻“水华”的优势藻类,铜绿微囊藻(Microcstis aeruginosa)是其代表藻株,其细胞内含有多种色素蛋白,生长速度极快,并产生对人体有害的微囊藻毒素[5-6]。水体富营养化水平持续偏高带来的“水华”现象令人堪忧,寻求一种高效、环保的抑藻物质迫在眉睫。
从“水华”暴发水体中分离安全、有效的溶藻细菌是一种有效的防治手段和途径,为水污染治理提供了新的研究思路[7-9]。现已报道多株分离自太湖水域的溶藻细菌,为抑制蓝藻“水华”现象提供了良好基础,但大多处于分离鉴定阶段,对于抑藻物质制备成本高、生物活性低且不稳定、二次污染等生物安全性问题尚有待进一步研究,以期实现溶藻微生物在治理“水华”中的应用[10]。
本研究通过优化溶藻菌株A21的培养基成分,提高对M. aeruginosa 905生物量的清除率。在单因素试验的基础上进行Plackett-Burman(PB)设计,选择出溶藻菌株A21溶藻效果的主要影响成分;根据PB试验结果进行响应面试验设计(response surface methodology,RSM),建立预估模型,得到估算的最佳培养基配方;根据实际情况进行调整,得到溶藻菌株A21的最佳培养基配方。
1材料与方法
1.1材料
1.1.1藻种和菌种
铜绿微囊藻905(M. aeruginosa 905)购自中国科学院水生生物种质库淡水藻种库,转接至新鲜的BG11培养基中,于25 ℃、光照度2 000 lx、光—暗周期14 h—10 h条件下培养[11]。溶藻菌株A21由笔者所在实验室利用原位取样法[12]从太湖暴发蓝藻“水华”的水域分离得到,经鉴定为芽孢杆菌属。
1.1.2主要试剂
溶藻菌株A21的基础培养基成分为碳源5 g/L、氮源10 g/L、NaCl 0.5 g/L、K3PO4 0.5 g/L、MgSO4·3H2O 0.5 g/L、FeSO4·7H2O 0.2 g/L、CaCl2 0.15 g/L、MnSO4 0.5 g/L,采用1 mol/L HCl或1 mol/L NaOH将pH值调至70。营养琼脂和营养肉汤用于A21菌株的活化和培养;鲁格氏碘液用于藻细胞固定;丙酮用于铜绿微囊藻细胞叶绿素的提取。
1.1.3主要仪器
SPX-250PG型智能型光照培养箱(上海天恒医疗机械有限公司),SQ-UV2300型紫外可见分光光度计(北京宇艾奇电子科技有限公司),CX21型光学显微镜(OLYMPUS 奥林巴斯),藻类计数框(新科仪器,计数区 20 mm×20 mm,100个小格),TDZ5-WS型多管架自动平衡离心机(湘潭湘仪仪器有限公司)等。
1.2方法
1.2.1溶藻试验
A21菌株经营养琼脂活化后接种在新鲜的基础培养基中,于37 ℃、180 r/min条件下培养12 h。将菌液以4 000 r/min离心10 min,取0.5 mL上清液与4.5 mL生长对數期的M. aeruginosa 905藻液进行混合,同时取0.5 mL灭菌的基础培养液与4.5 mL生长对数期的M. aeruginosa 905藻液混合作为对照组,置于25 ℃、光照度2 000 lx、光—暗周期14 h—10 h条件下培养5 d。
1.2.2碳源和氮源的单因素选择
根据微生物营养代谢方式的不同,选择可溶性淀粉、葡萄糖、乳糖、蔗糖、果糖、乙酸钠等为碳源,选择硝酸钾、硫酸铵、蛋白胨、牛肉膏、酵母膏、尿素为氮源。采用不同的碳源、氮源分别培养菌株A21后进行溶藻试验。
1.2.3Plackett-Burman设计变量
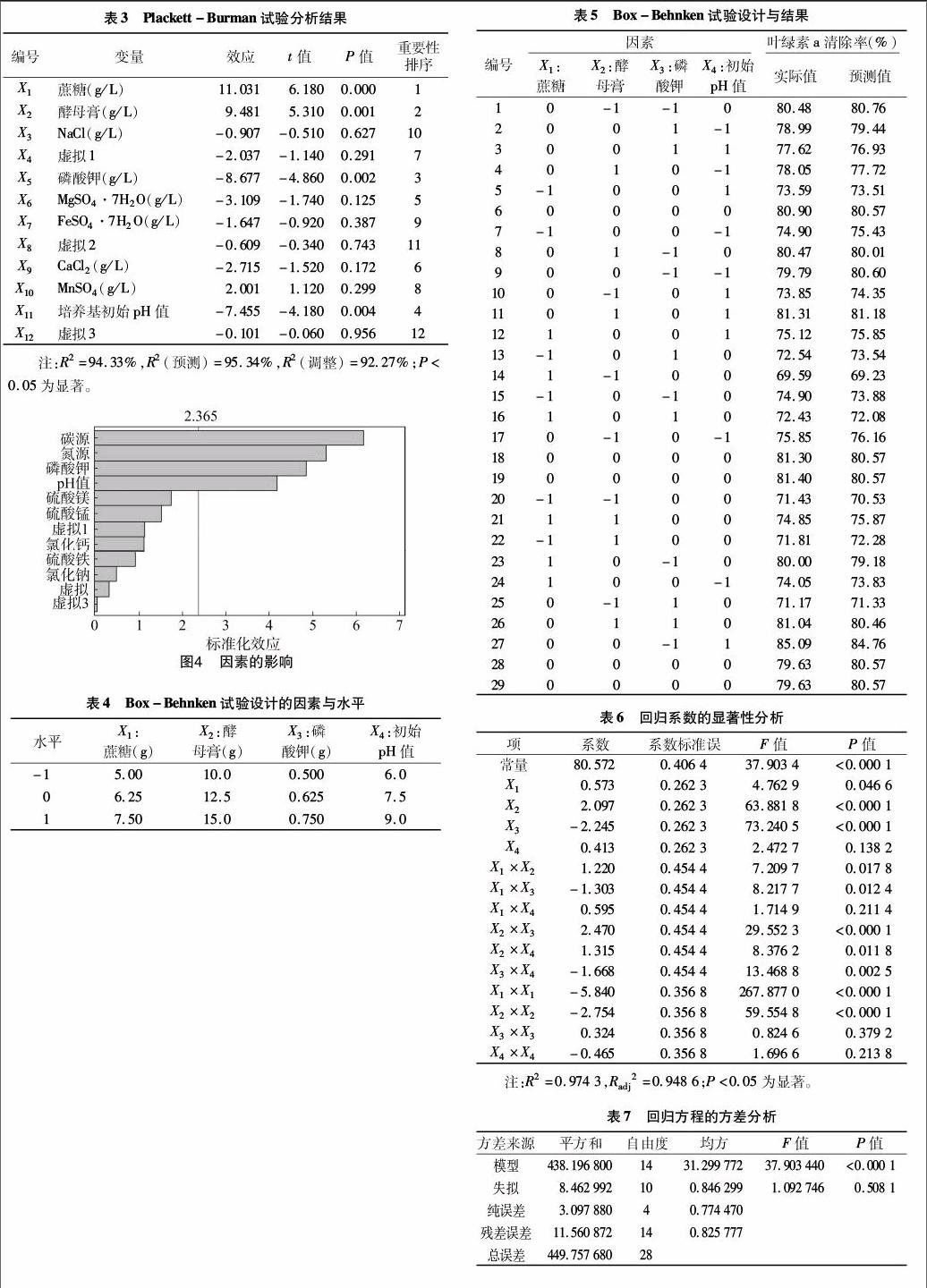
采用Mintab 16软件进行Plackett-Burman(PB)设计,对影响A21菌株生长的9个培养基成分进行考察,即碳源、氮源、NaCl、K3PO4、MgSO4·7H2O、FeSO4·7H2O、CaCl2、MnSO4、培养基初始pH值。每个因素取高水平和低水平2个水平,高水平为低水平的1.5倍。另设X4、X8、X12为虚拟列,在试验中为空,以考察试验误差。以叶绿素a清除率(%)为响应值,设定3个平行试验,试验设计见表1。
1.2.4响应面试验设计在Plackett-Burman试验的基础上确定响应面分析的因素与水平,采用Box-Behnken中心组合设计4因素3水平共29个试验点进行试验。优化A21菌株的培养基成分,并在最佳培养基成分配比下对铜绿微囊藻叶绿素a清除率进行3次平行试验,证实响应面分析法的可靠性。
1.2.5M. aeruginosa 905生物量指标叶绿素a浓度的测定在超声条件下使M. aeruginosa 905藻细胞破碎并释放出叶绿素a,利用丙酮于低温黑暗条件下萃取12 h后离心,分别于630、647、664、750 nm下测定上清液的吸光度[11-13]。根据公式(1)计算叶绿素a含量:
C(mg/L)=11.85(D664 nm- D750 nm)-1.54(D647 nm- D750 nm)-008(D630 nm- D750 nm)。[JY](1)
式中,D664 nm、D647 nm、D630 nm、D750 nm分别表示波长为664、647、630、750 nm 时提取液的吸光度。
根据公式(2)计算A21菌株的叶绿素a清除率(A):
[JZ(]A=(1-Dt/Dc)×100%。[JZ)][JY](2)
式中,Dt(mg/L)、Dc(mg/L)分别为试验组、对照组的叶绿素a浓度。
1.2.6数据处理利用Mintab 16、Design-expert 8.0、Excel 2010软件对试验数据进行分析处理。
2结果与分析
2.1碳源及氮源的选择结果
将A21菌株接种于营养肉汤中,于37 ℃下培养12 h,离心去除菌体后与铜绿微囊藻液混合,5 d后溶藻试验结果见图1。可见其溶藻能力较好,经计算得到叶绿素a清除率为80.34%。
[FK(W10][TPLWL1.tif]
以蛋白胨为氮源选择不同碳源,其他成分与基础培养基一致,试验结果见图2。以蔗糖为碳源选择不同氮源,其他成分与基础培养基一致,试验结果见图3。以蔗糖为碳源时,A21菌株对叶绿素a的清除率最高,为79.21%;以酵母膏为氮源时,A21菌株对叶绿素a的清除率最高,为81.27%。
2.2Plackett-Burman试验设计结果
利用Mintab 16软件进行Plackett-Burman设计,对影响
[TPLWL2.tif]
A21菌株生长的9个培养基成分进行考察,即蔗糖、酵母膏、NaCl、K3PO4、MgSO4·7H2O、FeSO4·7H2O、CaCl2、MnSO4、培養基初始pH值。在单因素试验的基础上,采用Plackett-Burman设计创建试验次数n=20的试验,对12个因素(9个实际因素、3个虚拟因素)进行考察。每个因素取高水平和低水平2个水平,以叶绿素a清除率(%)为响应值,试验设计及试验结果见表2。利用Mintab 16软件对试验结果进行分析(表3、图4),可见培养基中蔗糖、酵母膏、磷酸钾、初始pH
[TPLWL3.tif]
值对菌株A21的溶藻效果影响显著(P<0.05)。R2为9433%,R2(预测)为95.34%,表明该结果的可信度较高。
2.3响应面试验设计与结果
在PB试验设计的基础上确定4个主要影响因素,根据Box-Behnken中心组合设计原理,利用Design-Export 8.0软件对蔗糖、酵母膏、磷酸钾、初始pH值进行4因素3水平的响应面分析试验,试验设计与结果见表4、表5。
该响应面试验设置4个中心点,共有29个处理,重复3次以评估试验误差。采用Design-Export 8.0数据处理软件
对表6中的数据进行二次多元回归拟合,以叶绿素a清除率(Y,%)为因变量,以蔗糖(X1,g)、酵母膏(X2,g)、磷酸钾(X3,g)、[JP2]初始pH值(X4)为自变量建立回归方程。根据表6中各因素的P值去除回归方程中影响不显著的因子,对二次回归方程进行优化得到回归方程:Y=80.485 2+0.572 5X1+2.096 7X2-2.245X3+0.412 5X4+1.22X1X2-1.302 5X1X3+2.47X2X3+1.315X2X4-1.667 5X3X4-5.839 75X12-2753 5X22。
由表6、表7可知,A21菌株培养基成分优化回归模型的P值<0.000 1,失拟的P值为0.508 1,表明回归模型高度显著(P<0.05),失拟检验不显著(P>0.05)。桑叶黄A21菌株培养基成分优化回归模型的校正确定系数R2为0.948 6,表明模型能解释约94.86%响应值的变化,仅有5.14%的总变异不能用该模型解释。确定系数R2为0.974 3,表明模型拟合程度良好、试验误差小,该回归模型可用来分析和预测A21菌株培养基成分优化的情况。
响应面3D图和等高线(图5)可直观反映各因素间的交互作用及其强弱[14-15]。
2.4最佳培养基配方与验证试验
采用Design-Expert V8.0.6软件预测A21菌株的最佳培养基配方为蔗糖6.475 g/L、酵母膏13.025 g/L、磷酸钾 0.5 g/L、pH值8.2,此时A21菌株培养液的叶绿素a清除效率为85153 4%。根据实际情况进行调整,最佳试验配方为蔗糖6.5 g/L、酵母膏13 g/L、NaCl 0.5 g/L、K3PO4 0.5 g/L、MgSO4·3H2O 0.5 g/L、FeSO4·7H2O 0.2 g/L、CaCl2 0.15 g/L、MnSO4 0.5 g/L、pH值8.2。进行多次验证试验,菌株A21培养液的叶绿素a清除效率为84.5%,相对误差为07%。通过对培养基成分的优化,菌株A21的叶绿素a清除效率提高了518%。
3结论
菌株A21是一株高效、安全的溶藻细菌,细菌中的某些代谢产物可促使藻细胞死亡。为进一步提高菌株A21的溶藻能力,通过碳源和氮源的单因素选择试验、PB试验设计、响应面试验设计对菌株A21的培养基成分和配比进行研究,得到该菌株的最佳培养基配方,其叶绿素a清除效率由8034%提高至84.50%。[CM(21*2/3]本研究结果为菌株A21及其发酵产物在蓝藻“水华”治理中的应用提供依据。
参考文献:
[1]Ding L,Wu J Q,Pang Y,et al. Simulation study on algal dynamics based on ecological flume experiment in Taihu Lake,China[J]. Ecological Engineering,2007,31(3):200-206.
[2]李娟英,曹宏宇,崔昱,等. 太湖流域主要水系水环境特征分析与富营养化评价[J]. 水生态学杂志,2012,33(4):7-13.
[3]钱益春,何平.1998—2006年太湖水质变化分析[J]. 江西农业大学学报,2009,31(2):370-374.
[4]Chen Y,Qin B,Teubner K,et al. Long-term dynamics of phytoplankton assemblages:Microcystis domination in Lake Taihu,a large shallow lake in China[J]. Journal of Plankton Research,2003,25(4):445-453.
[5]陳水勇,吴振明,俞伟波,等. 水体富营养化的形成、危害和防治[J]. 环境科学与技术,1999,2(2):12-16.
[6]孔繁翔,高光. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J]. 生态学报,2005,25(3):589-595.
[7]Imamura N,Motoike I,Shimada N,et al. An efficient screening approach for anti-Microcystis compounds based on knowledge of aquatic microbial ecosystem[J]. Journal of Antibiotics,2001,54(7):582-587.
[8]van Hannen E J,Zwart G,van Agterveld M P,et al. Changes in bacterial and eukaryotic community structure after mass lysis of filamentous cyanobacteria associated with viruses[J]. Applied and Environmental Microbiology,1999,65(2):795-801.
[9]赵传鹏. 环境溶藻细菌的检测与评价[D]. 南京:东南大学,2005.
[10]倪兆林,申元英. 溶藻类细菌的研究现状[J]. 现代生物医学进展,2013,13(15):2997-3000.
[11]Shao J H,Li R H,Joe E L,et al. Potential for control of harmful cyanobacterial blooms using biologically derived substances:problems and prospects[J]. Journal of Environmental Management,2013,125(1):149-155.
[12]Hu X,Liu Y G,Zeng G M,et al. Effects of limonene stress on the growth of and microcystin release by the fr-eshwater cyanobacterium Microcystis aeruginosa FACHB-905[J]. Ecotoxicology and Environmental Safety,2014,105(1):121-127.
[13]安鑫龙,李豫红,赵艳珍,等. 溶藻微生物的研究方法[J]. 水利渔业,2005,25(2):17-18.
[14]周得庆,徐士菊. 微生物学[M]. 北京:化学工业出版社,2007:134-142.
[15]Tahmouzi S. Optimization of polysaccharides from Zagros oak leaf using RSM:antioxidant and antimicrobial activities[J]. Carbohydrate polymers,2014,106:238-246.
[16]姜绍通,汪洪普,潘丽军. 响应面法优化微波辅助提取芋头多糖工艺研究[J]. 食品工业科技,2013,34(3):215-219.

