胰腺假性囊肿的诊疗进展
黄斯诚,黄湘秦 综述 孙维佳 审校
(1.中南大学湘雅医院 普通外科,湖南 长沙 410008;2.中南大学湘雅医学院,湖南 长沙 410013)
胰腺假性囊肿(pancreatic pseudocyst,PPC)约占胰腺囊肿75%以上,是急慢性胰腺炎的常见局部并发症之一,也可以继发于胰腺术后、胰腺外伤,偶见继发于胰腺恶性肿瘤或无明显原因。PPC多无症状,早期也无需治疗,但随着病情进展,可以引发一系列并发症。开放式手术和经皮穿刺置管引流术(percutaneous catheter drainage,PCD)是其主要的外科治疗方法,近年来,超声内镜(EUS)、胰管镜、胰腺导管内超声(IEUS)、腹腔镜技术、内镜下逆行性胰胆管造影(ERCP)及介入等新技术的不断发展,为PPC的诊断和治疗提供了更多的个性化的选择。本文结合近年文献就PPC的研究进展作一综述。
1 定义及分类
PPC在组织学的定义及实质是指在胰腺内或其周围由缺乏上皮细胞的纤维囊壁包裹外漏的丰富的胰液或胰酶的囊肿,囊内不包含气体或固体等胰腺坏死组织。其囊壁由纤维肉芽组织、腹膜、网膜等无上皮细胞组成[1-2]。
PPC最常见于急慢性胰腺炎之后,由于胰腺炎、胰管狭窄、结石、栓子阻塞胰管,胰液排出受阻,从而导致胰管压力升高、胰管破裂[3],液体在胰腺周围异常积聚(罕见有部分或全部在胰腺实质内)。通常在急性胰腺炎发病后4周,炎性纤维组织等非上皮组织构成的假性囊壁完全包裹住积聚的液体,最终形成成熟的PPC。
2012版急性胰腺炎亚特兰大标准[4],将PPC定义为:间质水肿性胰腺炎的急性胰周液体积聚(acute peripancreatic fluid collection,APFC)未被完全吸收,并常在4周后形成囊壁包裹。囊内无非液体成分,若存在明显的实性坏死组织时,则应归为急性坏死性积聚(acute necrotic collection,ANC)或包裹性坏死(walled-off necrosis,WON)(表1)。
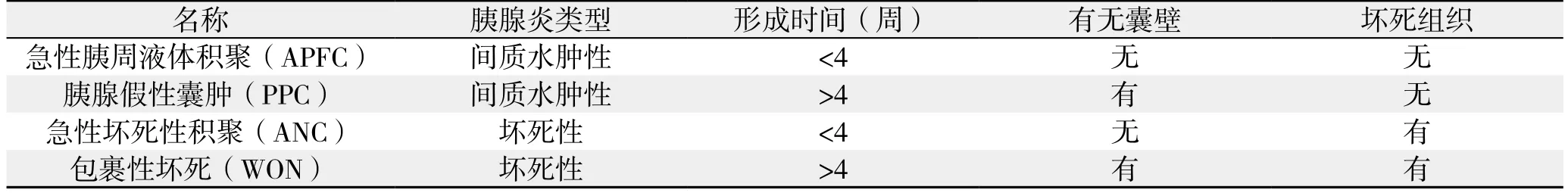
表1 4种胰腺及胰周积聚简单对比(2012版亚特兰大分类标准)Table 1 Brief comparison of 4 types of pancreatic and peripancreatic collections (2012 Atlanta Classi fication)
2 病因和发病率
PPC常见病因为急慢性胰腺炎,此外,胰腺外伤、手术及肿瘤等也可引起。其形成机制为胰管破裂和/或炎性渗出。胰腺肿瘤导致PPC则可能是因局部肿块压迫并阻塞胰管后发生胰腺潴留性囊肿或继发性胰腺炎性渗出。
Lerch等[5]研究1975—2008年间PubMed数据库中有关PPC的文章,结果显示,急性胰腺炎中PPC的发病率为6%~18.5%,慢性胰腺炎性中PPC的发病率20%~40%,其中酒精性CP引起PPC占70%~78%,特发性CP性PPC占6%~16%,胆源性胰腺炎占6%~8%。Khanna等[6]的研究中,手术和外伤引起的PPC约占3%~8%,高脂血症型胰腺炎则很少形成假性囊肿。而林辉等[7]的研究显示,胆源性的发病率43.2%,特发性21.6%,术后1.9%,其他原因10.3%。
3 分 型
3.1 根据PPC所在位置分型
PPC可分为胰周假性囊肿和胰腺外假性囊肿,前者约80%,后者约20%。胰周假性囊肿可分为胰头、胰体、胰尾和全胰假性囊肿,并可据此预估并发症和选择治疗方法。胰腺外的假性囊肿相对罕见[8-10],常无腹痛、腹胀等症状,诊疗较难。少数因囊肿压迫、出血、破裂、感染等而确诊。据Malka等[11]和Heider等[12]的研究显示,其发病率只占所有假性囊肿的1%~5.9%,且多见于CP,AP并发脾周假性囊肿更加罕见[13]。
3.2 根据AP的大小分型
PPC的临床表现和自然转归取决于其本身的物理特性,如部位、数量和大小,其中,囊肿的大小起到基础作用。直径>10 cm的囊肿称为巨大PPC。巨大PPC多来自重症急性胰腺炎(SAP),且可出现危及生命的早期并发症。因此,根据囊肿大小可早期对并发症的发生及风险作出评估,以便早期治疗。
3.3 根据PPC的数量分型
根据囊肿数量,可分为单发型和多发型(≥2个)。多发型囊肿的临床表现更为复杂,其治疗也更为困难,往往需要联合多种治疗方法或者不同方法序贯治疗。
3.4 根据PPC与主胰管的关系分型
PPC是否与胰管相通分为交通型与非交通型。不同分型在治疗及预后有较大差别,明确囊肿与胰管关系十分重要。
Nealon等[14]将假性囊肿与胰管解剖结构的情况分为7型:I型,胰管结构正常,与囊肿无交通;II型,胰管结构正常,与囊肿形成交通;III型,胰管狭窄,与囊肿无交通;IV型,胰管狭窄,与囊肿交通;V型,胰管完全阻塞;VI型,慢性胰腺炎,胰管与囊肿无交通;VII型,慢性胰腺炎,胰管与囊肿交通。
3.5 其他分型
Pan等[15]依据2012版亚特兰大标准筛选893例符合PPC诊断的患者进行回顾性分析,依据囊肿大小、位置、临床表现和囊肿与胰管的关系,将PPC分为5类(表2),并提出不同的治疗建议。

表2 PPC分类方法[15]Table 2 Classi fication of PPC[15]
4 临床表现和诊断
4.1 临床表现
直径<6 cm的PPC可无任何临床症状,仅能通过影像学并结合病史进行诊断。对于>6 cm的囊肿可表现为:⑴ 腹部隐痛、持续的饱胀感或进食后早饱感、触及腹部包块等。⑵ 局部压迫症状,当压迫胃肠道时,可引起进食后恶心、呕吐;当压迫胆管则可引起近端胆管扩张和梗阻性黄疸。⑶ 囊肿并发症引起的症状,如囊肿破裂,含有大量胰酶的囊液流入腹腔引起腹痛等腹膜炎症状;囊肿感染引起畏寒、发热等(表3)。
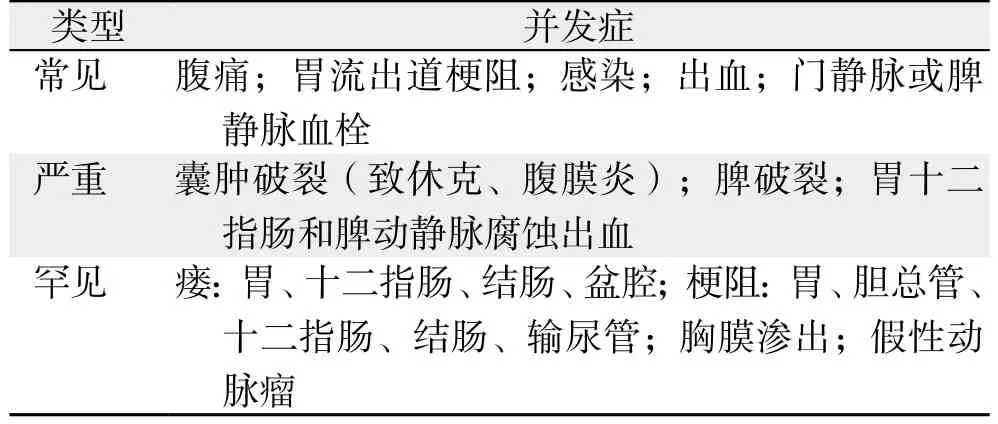
表3 PPC并发症Table 3 Complications of PPC
4.2 辅助检查及诊断
4.2.1 超声检查 超声检查是诊断和复查PPC的首选。主要表现为:胰腺或胰周边界清晰的无回声暗区,有时可见囊内分隔,但无气体或固体组织;多普勒超声可显示囊壁上的血流信号。
4.2.2 高分辨率CT(HRCT) 能清楚显示胰腺及其周围有均质低密度软组织影、周边有强化,合并坏死感染时可见囊壁增厚且异常强化、囊内出现气体;尚可提供囊肿的大小、位置、囊壁及囊内容物,是必选的检查方法。
4.2.3 EUS和IEUS 融合内镜和超声的优点,不但可以内镜下直视囊肿压迫胃肠壁而形成的突起,还可以超声评估囊壁的厚度、血管以及囊内液体的情况,既可辅诊,还可在其引导下进行诊断性和治疗性穿刺。
4.2.4 ERCP 主要显示胰胆管的结构,判断是否有胆道梗阻、囊肿是否与胰管相通。此外还有胰管镜等检查方法。
4.2.5 MRI和磁共振胰胆管造影(MRCP) 对囊肿的大小、位置、形态显示与CT相似,显示囊内积液情况(T2WI高信号)要优于CT;MRCP与ERCP同样可显示胆胰管情况,同时具有无创、并发症少的优点,但MRCP无法引导介入治疗。
4.3 诊断与鉴别诊断
根据临床表现、病史和影像学检查,多数PPC的诊断并无困难。但是,仍需注意与其它胰腺囊性疾病(肿瘤)鉴别,临床上误诊病例并非罕见[16-17]。
5 病程和治疗指征
急性胰腺炎引起的直径<6 cm、持续时间<6周的PPC自行消退率约45%~65%[18],非保守治疗指征有:⑴ 胃肠道压迫症状;⑵ 囊肿破裂、感染、出血;⑶ 梗阻性黄疸;⑷ 直径>6 cm且持续时间>6周或近期影像学显示囊肿不断增大等[19]。该指证也适用于APFC、ANC和WON。
6 治疗方法
大部分PPC经保守治疗可自行消退,保守方法包括饮食控制、营养支持、病因治疗及抑制胰腺外分泌和胰酶抑制剂的应用等措施。但对于>6cm的囊肿,经保守治疗自行吸收的概率较低。而当囊肿未能吸收,持续存在时间超过6周,则几乎不可能通过保守治疗自愈,此时便需要外科干预。
6.1 外科开放手术
Guenther等[20]统计近30年PPC外科手术情况,其成功率可达83%,略低于内镜治疗的85%,明显高于PCD的67%。但高并发症率(45%)、恢复慢、创伤大、短期内生活质量差、花费高等是其缺点,现在外科手术更多的是用作补救措施、复杂性PPC和严重并发症(破裂、出血等)的治疗手段。手术治疗分为:外引流、内引流、手术切除等几种方式,其中,内引流是最常用的术式[21]。
6.1.1 外引流术 外引流适应证:囊壁不成熟、坏死性胰腺炎的清创引流、联合内引流处理复杂性囊肿以及假性囊肿突发破裂、出血等紧急情况。此外,外引流可以和内引流结合进行序贯治疗,其将引流管穿过胃和腹壁引出,经过胃的导管无侧孔,囊肿只与外界相通。此法的优点在于,即使发生胰瘘,拔管后胰液会流入胃内而非体外,形成内引流,避免因迁延不愈的经皮胰瘘,但指征是假性囊肿与胃壁距离不能太远。同理,引流管也可借道空肠行外内序贯引流。
6.1.2 内引流术 内引流术是通过改道,将PPC内的液体引流至胃肠道而被吸收、排出。根据与假性囊肿吻合的不同器官分为:囊肿-胃吻合内引流术、囊肿-十二指肠吻合内引流术、囊肿-空肠Roux-en-Y吻合内引流术。通常根据囊肿的解剖位置决定手术方式,例如囊-胃吻合适用于靠近胃后壁的PPC;囊-十二指肠吻合适用于胰腺头部和钩突部的PPC;囊-空肠Roux-en-Y则可适用于所有类型,因此也成为最常用的内引流术式。囊壁成熟是内引流的指征,而吻合口>3 cm、引流口低位及去除囊隔等则为内引流的注意事项。
6.1.3 手术切除 外科切除的指征:怀疑囊性肿瘤、胰体尾部多发小囊肿、累及脾静脉、上消化道出血以及其他引流方式有困难的位于胰头钩突部的囊肿。胰尾部的PPC约10%~20%伴上消化道出血或者侵犯脾静脉,术中常需要一并切除周边胰腺或脾脏等器官。具体术式如下:当胰尾部PPC与胃肠道间隔<1 cm,可选择内镜囊-胃或囊-十二指肠内引流;当间隔>1 cm则应考虑手术切一并除胰尾、囊肿及脾;此外还有胰十二指肠切除术、保留十二指肠的胰头切除术、胰尾切除+胰管空肠侧侧吻合、胰头部分切除+胰管空肠侧侧吻合术等[15]。
6.2 腹腔镜手术
腹腔镜手术与开放手术类似,同样可行内引流、外引流、手术切除。腔镜手术具有高清术野、微创、成功率高、低病死率和复发率[22]等优点。
6.3 PCD
PCD是在B超或者CT引导下经过皮肤穿刺囊肿,将囊液引流至体外。有经腹腔和腹膜后两种入路,也可经肝、胃、十二指肠等方式进入囊肿。应根据囊肿的位置、数量以及内容物的黏稠度选择引流管的种类、尺寸和数量[20]。但BruennlerT等[23]则认为疗效与PCD引流管的尺寸无明显关系。据Walser等[24]统计,PCD平均带管52 d,当影像学证明囊肿塌陷,且每日引流量<10 mL即可拔管,拔管后48 h建议复查影像学检查。PCD具有创伤小、恢复快、操作简便、无需考虑囊壁成熟与否等优点,故其适用范围广泛,对于AP(SAP)后的APFC、ANC、PPC、WON均适用。引流管堵塞、需反复冲洗或反复穿刺置管调整位置、胰瘘及出血等是其缺点。PCD适用于大部分PPC且疗效确切,对于治疗胰周积液持续存在或增加的、临床表现无缓解的、SIRS及器官衰竭持续进展加重的重症急性胰腺炎患者,早期行PCD的意义更大[25]。
6.4 内镜介入治疗
1996年Baron等[26]率先报道使用内镜治疗PPC,在内镜引导下将管径10 F的鼻胰引流管置入腹膜后,可通过胃和经十二指肠置入,成功率可达80%。内镜介入治疗拥有成功率高、并发症少、复发率低、后续再次治疗少、创伤小等优点[27-28],成为治疗PPC的首要选择。
6.4.1 内镜引导下经胃肠壁置入支架引流 该术式指征:⑴ 囊壁成熟;⑵ 囊壁与消化道壁间距<1 cm;⑶ 排除囊性肿瘤和假性动脉瘤。若在囊壁未成熟或间距>1.5 cm的条件下穿刺,穿孔发生率将明显提高[29]。另外,静脉曲张、大血管介入、多囊腔、凝血功能障碍等是内镜的相对禁忌证。内镜在进入后,应选择膨出最明显的部位进行穿刺,穿刺点可以是胃壁、十二指肠壁及空肠壁;进入囊腔后,先抽取囊液送检,再经导丝置入支架。此时,可选择原位或另选穿刺点置入鼻囊管辅助引流(多路径引流技术[30],multiple transluminal gateway technique,MTGT)。MTGT比内镜引导下经胃肠壁引流即单路径透壁引流(conventional transmural drainage,CTD)有更高的治愈率,再次介入治疗的概率也较低。相较PCD而言,内镜介入引流更加彻底,需要后续干预治疗的概率较低,但支架留置的时间明显较PCD留置引流管的时间长[31]。
6.4.2 EUS引导下经胃肠壁置入支架引流 EUS是在内镜的基础上融合超声定位引导的功能。当囊肿未对消化道形成明显压迫时,传统的内镜较难观察到消化道明显的膨凸,盲目穿刺的风险较大[32]。超声内镜可评估囊壁的厚度、囊内容物的性质、发现周边的血管,可准确找到最佳的穿刺点,从而减小了出血、穿孔等的风险[20,33]。在一项Meta分析的文章中[34],EUS在技术成功率较传统内镜要高,但在不良事件上两者无显著区别。除出血、穿孔等并发症,传统内镜和超声内镜还共同面对支架堵塞、异位脱落等问题[35]。
支架相关的并发症率可达17.7%[33],不同材质的支架与疗效和并发症的发生有关。双猪尾巴塑料导管因价廉曾广泛使用,但因其直径较小,引流效果一般。而能自动扩张、管径大、不易堵塞的钛金支架(covered self-expanding metal stent,CSEMS)在扩张时产生的径向力可以压迫囊壁的出血点,是更加安全可靠的支架[36-37]。但CSEMS最初设计是用来行胆道引流的,缺少对囊肿和消化道壁的固定,易致囊液流入腹腔、支架移位的问题。最新的双腔金属支架(lumen-apposing metal stent,LAMS)是专门为内镜引流PPC而设计的支架,LAMS支架长度短,两端有凸缘用于固定,形似哑铃。与CSEMS类似,LAMS的管径粗,内镜可直接通过,对于WON患者后期还可行内镜下坏死组织清创[38]。相比猪尾巴导管,LAMS的异位率低,平均操作时间短,需要较少的支架[37]。总体来说,因猪尾巴导管异位率较高,两种金属支架(CSEMS和LAMS)的一次支架置入后引流成功率较猪尾巴导管高,但猪尾巴导管经重复置管调整后,三者最终引流成功率无明显区别[38]。
随着新兴支架的使用,超声内镜引导下介入治疗PPC的成功率高,并发症率低,在满足使用的基本条件下,应作为PPC的首选治疗手段。
6.4.3 内镜引导下经十二指肠乳头引流 该法是在ERCP的引导下,向胰管内放置支架,将假性囊肿内的液体经支架引流到十二指肠。置入的支架必须跨过胰管断裂处,且末端放至囊腔内,起到支撑、修复胰管的作用,并在不改变原有解剖结构的情况下进行引流。经乳头引流除要求囊壁成熟外,还须满足PPC与胰管相通的条件。据统计,PPC与胰管交通的发生率为22%~57%,继发于慢性胰腺有的假性囊肿约有49%与胰管相通,而继发于急性胰腺炎的假性囊肿中约有20%与胰管相通。因此,疑有胰管损伤的患者建议常规行ERCP以评估胰管情况[32]。Yang等[39]的研究结果显示,单纯的超声内镜下透壁引流(TMD)与在TMD基础下行ERCP引导经乳头引流相结合治疗(CD)的疗效、并发症与复发情况无显著区别,反而是经乳头引流(TPD)的PPC与其经治疗后的远期影像学情况呈负相关。另外,因为胰管完全中断、管腔阻塞、手术改变胰管解剖结构等原因,在PPC患者中成功置入胰管支架的仅有40.2%,而WON仅有17.5%[40-41]。
6.5 双镜联合技术治疗PPC
为降低单纯腹腔镜、单纯内镜及开放式手术治疗PPC具有较高的复发率和并发症,近年腹腔镜+内镜双镜联合治疗PPC的技术和方法得到应用,取得更发的临床疗效。李成军等[42]采用双镜联合技术治疗重症胰腺炎后PPC 31例,并与开放式治疗21例进行比较分析,无论在治疗时间、术中出血量均明显优于开腹组患者,提示双镜技术具有较高的安全性和显著的疗效。
6.6 达芬奇机器人手术系统的应用
达芬奇机器人手术系统因具有多个能在7个自由度作最高540°旋转的工作臂,其灵活操作程度远远超过人手及一般机械臂,甚至能进行人手难以完成的精细操作;此外,达芬奇机器人手术系统配备了3D高清影像系统,为术者提供真实立体的术野和10~15倍的高分辨率的三维图像,显著提高包括PPC在内的复杂的胰腺手术的精准度、手术效果和安全性,同时更具微创性。在周宁新等[43]的报告中,成功运用了达芬奇机器人对PPC患者行囊肿-空肠吻合术,疗效确切,随着机器人的普及,相信不久的将来有望成为胰腺外科手术的主流[44-46]。
7 总结与展望
由于HRCT、MRI、ERCP、EUS等影像技术的发展和应用,PPC的确诊率显著提高,更因这些兼具治疗作用的影像技术引导或介入,使PPC的外科治疗跨越传统开放式的巨创手术发展到通过腔镜、内镜、EUS介入的内引流和经皮穿置管引流等微创手段,各种治疗方法和术式均有其手术应证和指征,应该根据具体病情采取个体化治疗方案。随着医学科学的进步和观念的更新、双镜融合技术及达芬奇机器人手术系统的应用,使PPC的治疗更趋多样化和精准性及安全性。
参考文献
[1]Ahn JY,Seo DW,Eum J,et a1.Single-Step EUS-Guided Transmural Drainage of Pancreatic Pseudocysts:Analysis of Technical Feasibility,Efficacy,and Safety[J].Gut Liver,2010,4(4):524–529.doi:10.5009/gnl.2010.4.4.524.
[2]Palanivelu C,Senthilkumar K,Madhankumar MV,et a1.Management of pancreatic pseudocyst in the era of laparoscopic surgery--experience from a tertiary centre[J].Surg Endosc,2007,21(12):2262–2267.
[3]Habashi S,Draganov PV.Pancreatic pseudocyst[J].World J Gastroenterol,2009,15(1):38–47.
[4]Banks PA,Bollen TL,Dervenis C,et al.Classification of acute pancreatitis--2012:revision of the Atlanta classification and de finitions by international consensus[J].Gut,2013,62(1):102–111.doi:10.1136/gutjnl–2012–302779.
[5]Lerch MM,Stier A,Wahnschaffe U,et al.Pancreatic pseudocysts:observation,endoscopic drainage,or resection?[J].Dtsch Arztebl Int,2009,106(38):614–621.doi:10.3238/arztebl.2009.0614.
[6]Khanna AK,Tiwary SK,Kumar P.Pancreatic pseudocyst:therapeutic dilemma[J].Int J Inflam,2012,2012:279476.doi:10.1155/2012/279476.
[7]林辉,湛先保,郭杰芳,等.胰腺假性囊肿的病因分析[J].中华胰腺病杂志,2010,10(3):171–173.doi:10.3760/cma.j.issn.1674–1935.2010.03.008.Lin H,Zhan XB,Guo JF,et al.Etiology of pancreatic pseudocyst[J].Chinese Journal of Pancreatology,2010,10(3):171–173.doi:10.3760/cma.j.issn.1674–1935.2010.03.008.
[8]Bhasin DK,Rana SS,Nanda M,et al.Endoscopic managementof pancreatic pseudocysts at atypical locations[J].Surg Endosc,2010,24(5):1085–1091.doi:10.1007/s00464–009–0732–8.
[9]Bhasin DK,Rana SS,Rao C,et al.Clinical presentation,radiological features,and endoscopic management of mediastinal pseudocysts:experience of a decade[J].Gastrointest Endosc,2012,76(5):1056–1060.doi:10.1016/j.gie.2012.06.021.
[10]Rana SS,Chaudhary V,Sharma V,et a1.Infected pancreatic pseudocyst of spleen successfully treated by combined endoscopic transpapillary stent placement and transmural aspiration[J].Gastrointest Endosc,2014,79(2):360–361.doi:10.1016/j.gie.2013.10.011.
[11]Malka D,Hammel P,Lévy P,et al.Splenic complications in chronic pancreatitis:prevalence and risk factors in a medical-surgical series of 500 patients[J].Br J Surg,1998,85(12):1645–1649.
[12]Heider R,Behrns KE.Pancreatic pseudocysts complicated by splenic parenchymal involvement:results of operative and percutaneous management[J].Pancreas,2001,23(1):20–25.
[13]Hastings OM,Jain KM,Khademi M,et al.Intrasplenic pancreatic pseudocyst complicating severe acute pancreatitis[J].Am J Gastroenterol,1978,69(2):182–186.
[14]Nealon WH,Walser E.Main pancreatic ductal anatomy can direct choice of modality for treating pancreatic pseudocysts (surgery versus percutaneous drainage)[J].Ann Surg,2002,235(6):751–758.
[15]Pan G,Wan MH,Xie KL,et al.Classification and Management of Pancreatic Pseudocysts[J].Medicine (Baltimore),2015,94(24):e960.doi:10.1097/MD.0000000000000960.
[16]胡俊,黄强,林先盛,等.胰腺囊性肿瘤40例诊疗分析[J].中国普外基础与临床杂志,2014,21(10):1250–1253.Hu J,Huang Q,Lin XS,et al.Diagnosis and Treatment of 40 Cases of Pancreatic Cystic Neoplasms[J].Chinese Journal of Bases and Clinics In General Surgery,2014,21(10):1250–1253.
[17]王克,单云峰.胰腺囊性肿瘤临床诊治特征分析:附112例报告[J].中国普通外科杂志,2015,24(3):398–401.doi:10.3978/j.issn.1005–6947.2015.03.018.Wang K,Shan YF.Clinical diagnosis and treatment characteristics of pancreatic cystic neoplasms:a report of 112 cases[J].Chinese Journal of General Surgery,2015,24(3):398–401.doi:10.3978/j.issn.1005–6947.2015.03.018.
[18]Mouli VP,Sreenivas V,Garg PK.Efficacy of conservative treatment,without necrosectomy,for infected pancreatic necrosis:a systematic review and meta-analysis[J].Gastroenterology,2013,144(2):333–340.doi:10.1053/j.gastro.2012.10.004.
[19]Holt BA,Varadarajulu S.The endoscopic management of pancreatic pseudocysts(with videos)[J].Gastrointest Endosc,2015,81(4):804–812.doi:10.1016/j.gie.2014.12.026.
[20]Guenther L,Hardt PD,Collet P.Review of current therapy of pancreatic pseudocysts[J].Z Gastroenterol,2015,53(2):125–135.doi:10.1055/s–0034–1385713.
[21]Behrns KE,Ben-David K.Surgical therapy of pancreatic pseudocysts.J Gastrointest Surg 2008; 12:2231–2239.
[22]Hamza N,Ammori BJ.Laparoscopic drainage of pancreatic pseudocysts:a methodological approach[J].J GastrointestSurg,2010,14(1):148–155.doi:10.1007/s11605–009–1048–7.
[23]Bruennler T,Langgartner J,Lang S,et al.Outcome of patients with acute,necrotizing pancreatitis requiring drainage-dose drainage size matter?[J].World J Gastroenterol,2008,14(5):725–730.
[24]Walser EM,Nealon WH,Marroquin S,et al.Sterile fluid collections in acute pancreatitis:catheter drainage versus simple aspiration[J].Cardiovasc Intervent Radiol,2006,29(1):102–107.
[25]Babu RY,Gupta R,Kang M,et al.Predictors of surgery in patients with severe acute Pancreatitis managed by the stepup approach[J].Ann Surg,2013,257(4):737–750.doi:10.1097/SLA.0b013e318269d25d.
[26]Baron TH,Thaggard WG,Morgan DE,et al.Endoscopic therapy for organized pancreatic necrosis[J].Gastroenterology,1996,111(3):755–764.
[27]Puri R,Thandassery RB,Alfadda AA,et al.Endoscopic ultrasound guided drainage of pancreatic fluid collections:Assessment of the procedure,technical details and review of the literature[J].World J Gastrointest Endosc,2015,7(4):354–363.doi:10.4253/wjge.v7.i4.354.
[28]Akshintala VS,Saxena P,Zaheer A,et al.A comparative evaluation of outcomes of endoscopic versus percutaneous drainage for symptomatic pancreatic pseudocysts[J].Gastrointest Endosc,2014,79(6):921–928.doi:10.1016/j.gie.2013.10.032.
[29]Varadarajulu S,Christein JD,Wilcox CM.Frequency of complications during EUS-guided drainage of pancreatic fluid collections in 148 consecutive patients[J].J Gastroenterol Hepatol,2011,26(10):1504–1508.doi:10.1111/j.1440–1746.2011.06771.x.
[30]Varadarajulu S,Phadnis MA,Christein JD,et al.Multiple transluminal gateway technique for EUS-guided drainage of symptomatic wall-off pancreatic necrosis[J].Gastrointest Endosc,2011,74(1):70–80.doi:10.1016/j.gie.2011.03.1122.
[31]Keane MG,Sze SF,Cieplik N,et al.Endoscopic versus percutaneous drainage of symptomatic pancreatic fluid collections a 14-year experience from a tertiary hepatobiliarycentre[J].Surg Endosc,2016,30(9):3730–3740.doi:10.1007/s00464–015–4668–x.
[32]Singhal S,Rotman SR,Gaidhane M,et al.Pancreatic fluid collection drainage by endoscopic ultrasound:an update[J].Clin Endosc,2013,46(5):506–514.doi:10.5946/ce.2013.46.5.506.
[33]Gornals JB,De la Serna-Higuera C,Sánchez-Yague A,et al.Endosonography-guided drainage of pancreatic fluid collections with a novel lumen-apposing stent[J].Surg Endosc,2013,27(4):1428–1434.doi:10.1007/s00464–012–2591–y.
[34]Panamonta N,Ngamruengphong S,Kijsirichareanchai K,et al.Endoscopic ultrasound-guided versus conventional transmural techniques have comparable treatment outcomes in draining pancreatic pseudocysts[J].Eur J Gastroenterol Hepatol,2012,24(12):1355–1362.doi:10.1097/MEG.0b013e32835871eb.
[35]Okabe Y,Tsuruta O,Kaji R,et al.Endoscopic retrieval of migrated plastic stent into bile duct or pancreatic pseudocyst[J].Dig Endosc,2009,21(1):1–7.doi:10.1111/j.1443–1661.2008.00818.x.
[36]Fabbri C,Luigiano C,Cennamo V,et al.Endoscopic ultrasoundguided transmural drainage of infected pancreatic fluid collections with placement of covered self-expanding metal stents:a case series[J].Endoscopy,2012,44(4):429–433.doi:10.1055/s–0031–1291624.
[37]Penn DE,Draganov PV,Wagh MS,et al.Prospective evaluation of the use of fully covered self-expanding metal stents for EUS-guided transmural drainage of pancreatic pseudocysts[J].Gastrointest Endosc,2012,76(3):679–684.doi:10.1016/j.gie.2012.04.457.
[38]Ang TL,Kongkam P,Kwek AB,et al.A two-center comparative study of plastic and lumen-apposing large diameter self-expandable metallic stents in endoscopic ultrasound-guided drainage of pancreatic fluid collections[J].Endosc Ultrasound,2016,5(5):320–327.
[39]Yang D,Amin S,Gonzalez S,et al.Transpapillary drainage has no added bene fit on treatment outcomes in patients undergoing EUS-guided transmural drainage of pancreatic pseudocysts:a large multicenter study[J].Gastrointest Endosc,2016,83(4):720–729.doi:10.1016/j.gie.2015.10.040.
[40]Trevino JM,Tamhane A,Varadarajulu S.Successful stenting in ductal disruption favorably impacts treatment outcomes in patients undergoing transmural drainage of peripancreatic fluid collections[J].J Gastroenterol Hepatol,2010,25(3):526–531.doi:10.1111/j.1440–1746.2009.06109.x.
[41]Varadarajulu S,Bang JY,Phadnis MA,et al.Endoscopic transmural drainage of peripancreatic fluid collections:outcomes and predictors of treatment success in 211 consecutive patients[J].J Gastrointest Surg,2011,15(11):2080–2088.doi:10.1007/s11605–011–1621–8.
[42]李成军,李金骁.内镜联合腹腔镜治疗重症急性胰腺炎并发胰腺假性囊肿的临床疗效观察[J].中国普通外科杂志,2015,24(3):389–392.doi:10.3978/j.issn.1005–6947.2015.03.016.Li CJ,Li JX.Clinical efficacy of endoscopic plus laparoscopic treatment for severe acute pancreatitis complicated with pancreatic pseudocyst[J].Chinese Journal of General Surgery,2015,24(3):389–392.doi:10.3978/j.issn.1005–6947.2015.03.016.
[43]周宁新,陈军周,刘全达,等.“达芬奇”机器人普通外科手术180例:中国单中心报道[J].中国普外基础与临床杂志,2011,18(7):698–704.Zhou NX,Chen JZ,Liu QD,et al.One Hundred Eighty Cases of General Surgeries Under da Vinci Surgical System in Single Institute in China[J].Chinese Journal of Bases and Clinics in General Surgery,2011,18(7):698–704.
[44]曹月敏,王春城,暴雷,等.da Vinci 外科手术系统在胰腺肿瘤外科应用的优势及现状[J].中国微创外科杂志,2016,16(9):769–773.doi:10.3969/j.issn.1009–6604.2016.09.001.Cao YM,Wang CC,Bao L,et al.The Current Status and Advantages of the da Vinci Robotic Surgical System in Pancreatic Tumor Surgery[J].Chinese Journal of Minimally Invasive Surgery,2016,16(9):769–773.doi:10.3969/j.issn.1009–6604.2016.09.001.
[45]Qin H,Qiu J,Zhao Y,et al.Does minimally-invasive pancreaticoduodenectomy have advantages over its open method?A meta-analysis of retrospective studies[J].PLoS One,2014,9(8):e104274.doi:10.1371/journal.pone.0104274.
[46]Svoboda S,Qaqish TR,Wilson A,et al.Robotic single-site cholecystectomy in the obese:outcomes from a single institution[J].Surg Obes Relat Dis,2015,11(4):882–885.doi:10.1016/j.soard.2014.11.016.

