新生儿期母子隔离与抚触刺激对成年后大鼠社会交往行为的影响
安勇博 梁文英 李轶雯 刘璐 王冬青 戴笑颜 马驰 钱驿 马瑞 丁瞳 张嵘
童年期遭遇负面生活经历会增加日后患精神疾病(如抑郁症、焦虑症)的可能[12]。孤独症谱系综合征是一类永久性精神发育障碍,症状体现在不同程度的交流困难及重复刻板行为。2009年统计美国的孤独症谱系综合征患病率为1/110[3],而2015年已增至1/45[4]。ASD的病因及发病机制仍在探索中。目前认为,该疾病是由于一系列遗传因素加环境危险因素导致。关于社会环境因素,儿童成长过程中的家庭因素是极其重要的。孤儿较正常儿童明显更容易有认知功能障碍以及心理发育缺陷[5]。家庭因素的负面影响对中国农村地区的儿童也尤为明显。中国经济等方面的高速发展吸引了许多外地农村人口大量涌入大城市,鉴于这类人群无条件令自己的孩子在大城市和自己生活,他们只能将孩子留在家乡让其他亲戚抚养。这些儿童被称为留守儿童。2000—2013年,中国留守儿童的数量从2千万增至6千万以上[6]。而与双亲隔离使得留守儿童成为精神发育障碍相关疾病的易患人群[7],因此,社会环境因素对社会行为以及精神健康的影响受到越来越多的关注[6]。
为了探究不同家庭生活背景对孤独症发病的影响,本研究以大鼠新生儿期隔离(neonatal isolation,NI)作为动物模型来模拟儿童早期被忽视的逆境,以新生儿抚触刺激(neonatal tactile stimulation,NTS)来模拟儿童早期温和的社会环境,之后对大鼠成年后的社会行为进行观察,以揭示早期处理的影响。常用的NI模型是每日母鼠与子鼠隔离3 h,先前研究结果表明,此操作会增加大鼠幼年时期焦虑水平[89],损害认知功能[10],以及增加大鼠幼年期、成年期的侵略性。异常行为改变常常伴随神经内分泌系统的异常,比如下丘脑垂体肾上腺轴(HPA轴)调节功能异常。然而,母子隔离对子鼠的长期影响因子鼠性别及隔离处理细节的不同呈现不一样的结果[11]。NTS是另一种对大鼠的新生儿期社会环境模拟处理,这类处理将帮助子鼠更加适应压力环境,并能降低子鼠成年后HPA轴的兴奋水平[12]。Todeschin等[13]研究显示,NTS降低雄性子鼠成年后的社交能力。本实验室调查研究发现,孤独症儿童比正常儿童幼年遭遇与父母的隔离的比率更高(181%和65%),且孤独症儿童与父母的亲密亲子互动显著低于正常儿童(218%和478%),提示亲密的亲子关系也许具有潜在的预防与治疗效果,其背后蕴藏的机理仍不明确(待发表)。
催产素(oxytocin,OXT)和精氨酸后叶加压素(arginine vasopressin,AVP)是下丘脑室旁核(paraventricular nucleus,PVN)与视上核(supraoptic nucleus,SON)产生的2种神经肽。2种肽类物质对调节哺乳动物社交行为有重要作用。PVN与SON中的大细胞神经元的轴突会延续至垂体后叶,在那里将OXT与AVP释放入外周血液循环。PVN中的小细胞性神经元则会将两种神经肽释放至杏仁核、海马、伏隔核等脑区。对动物而言,这两种神经肽对于社会识别、记忆、配对有重要作用。对人类而言,2种神经肽对调控焦虑、信任、社会识别具有重要作用[14]。研究还发现,童年期有被忽视经历的儿童较正常家庭抚养的儿童AVP水平低,正常家庭抚养的儿童在与母亲亲密接触后OXT水平会增高[15]。NI与NTS会影响子鼠成年后的焦虑水平,但是对于子鼠成年后社交能力的影响暂不明确。OXT与AVP是调节社会行为、社会识别的重要因子,且会被社会环境所影响[1316]。本研究分析子鼠早期接受NI与NTS对其成年后(90天)社会交往与焦虑水平的影响,并初步探索其机制。
对象与方法
一、对象
6只SD孕鼠均来自北京大学医学部实验动物部。初始重量220~250 g。6只孕鼠各自分笼喂养,食水充足,昼夜12 h循环(早7点至晚7点日光灯照明),室内温度(24±1)℃,湿度50%。孕鼠均自然生产,共产78只子鼠,以出生日记作出生后第0天(postnatal day 0,PND0)。78只子鼠被随机分配入3组。NI组28只,雄性13只,雌性15只;NI+NTS组27只,雄性13只,雌性14只;正常对照(standard facility rearing,SFR)组23只,雄性8只,雌性15只。并将子鼠连续编号(178),号码标记在大鼠的身体及尾巴上。断奶(PND 28)后,子鼠按性别每4只/笼喂养。该研究方案经大学研究伦理委员会(LA 201380)批准,并符合实验动物研究NIH指南要求。
二、方法
1新生儿期隔离(NI)与新生儿期抚触刺激(NTS):NI组子鼠在PND 1—PND 28每日与母鼠隔离3 h(17:30—20:30)。隔离的流程如下,将母鼠从笼中移出,随即将子鼠从笼中移出并分别单独置入另准备的小纸杯中(纸杯充满垫料),环境温度维持在36℃。3 h隔离结束后,所有子鼠移回笼中,最后将母鼠也移回笼中。NTS组子鼠除经历与NI组相同的隔离处理之外,每日在3 h隔离期间有15 min的抚触刺激。抚触刺激具体措施如下,实验者戴上毛绒手套温柔触摸子鼠。为了持续抚触刺激对子鼠的影响,将每日抚触15 min的这项处理一直延续至子鼠成年(PND 90),而非停止在断奶后(PND 28)。
SFR组母鼠与子鼠在PND 1—PND 28一直生活在一起。实验设计见图1。
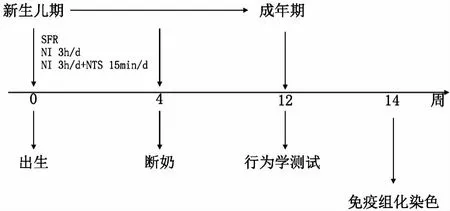
图1 实验设计图 SFR:正常对照;NI:新生儿期隔离;NTS:新生儿期抚触刺激
2社会交往测试(三室实验):大鼠成年后(PND 90)进行社会交往行为测试。社会交往测试方法参考先前研究[10]。测试装置由3个有机玻璃小室(40 cm×34 cm×24 cm)串联构成。两边的小室通过中间走廊(10 cm×10 cm×15 cm)与中间的小室相通。子鼠在正式测试前一天放入装置15 min熟悉环境。交往对象鼠被放入3个小室中边侧1个小室的小笼中,另一边侧小室放入一个同样大小的空的小笼。接受测试鼠可以自由在三室装置中活动15 min,每个过道设有红外线探测仪可探测到过往物体,以此可测定计算出实验鼠在每个小室中度过的时间。测试鼠在有社交对象鼠的边侧小室中度过的时间被定义为社交时间。实验选取的交往对象鼠与所有测试鼠同龄且实验前保持互相陌生。所有行为学测试时间为夜间(19:30熄灯后)。每次测试后实验鼠都放回笼中,并将装置彻底清洁除味。
3环境所导致焦虑水平测试(黑白箱探索实验):实验装置由三室实验装置改装而成。将三室中的一个边侧小室与另两小室隔挡,将余下的两个小室其中一个装上黑色不透光的天花板,作黑箱;另一个小室装上透明天花板作白箱。实验开始时将实验鼠放入黑箱,实验鼠可以自由穿梭于黑白箱中,记录其在每个箱中的时间。焦虑水平测试中,子鼠在黑箱中度过的时间反映其环境导致的焦虑水平。在黑箱中所处时间越长表示测试鼠的焦虑水平越高。每次测试后实验鼠都放回笼中,并将装置彻底清洁除味。
4对PVN和SON中OXT和AVP免疫组化染色:在行为学实验后,用10%水合氯醛(300 mg/kg体重)腹腔注射,对大鼠进行麻醉。先后使用生理盐水和4%多聚甲醛(pH 74)经心脏对大鼠灌注固定,取脑,在相同固定液中4℃固定24 h。之后以30μm为厚度连续切片,-20℃保存在具有防冻功能的固定液中。
采用抗生物素生物素过氧化酶法(avidin biotin peroxidase complex,ABC)对 OXT和 AVP阳性细胞进行免疫组化染色。具体方法如下,室温下将冰冻切片用001 M PBS于摇床上洗3遍,置于甲醛固定10 min。再用001 M PBS洗3遍后,03%过氧化氢溶液室温孵育脑片30 min以清除内源过氧化酶活性。001 M PBS洗3遍后,用10%山羊血清和003%Triton X100(001M PBS)在37℃温箱中封闭30 min。之后加入兔源抗大鼠OXT或AVP单克隆抗体(Abcam,USA,1∶2 000稀释于含1%山羊血清和03%TritonX100的001 M PBS溶液)于37℃温箱震荡孵育2 h,之后置于4℃冰箱继续孵育48 h。用001 M PBS洗3遍,每次15 min后加入二抗(用生物素标记的山羊源抗兔 IgG,Vectastain,USA,1∶200稀释),37℃震荡孵育30 min。PBS洗3遍后,用加链酶亲和素生物素过氧化物酶复合物(Vectastain,USA,1∶200稀释)于37℃孵育 45 min。PBS洗 3遍后用含 005 M Tris HCl(pH 76)的 05 mg/ml二氨基联苯胺和 003%过氧化氢溶液显色10 min。可见神经元细胞内出现棕色反应产物。对脑片进行贴片、烤干,之后用酒精梯度脱水,二甲苯透明,树脂封片。
因NI和NTS干预后雌鼠表现出显著行为学改变,故以下实验聚焦于雌鼠。每组挑选有明显行为改变的5只雌鼠,通过测量PVN和SON免疫组化阳性的大细胞和小细胞神经元数量,研究雌鼠OXT和AVP表达水平的改变。
5细胞计数和数据分析:本研究使用Olympus显微镜和Canon相机对免疫组化阳性细胞观察、照相和计数。在显微镜下,PVN和SON区域的神经元细胞核呈棕色染色即为OXT或AVP免疫组化阳性细胞。本研究所涉及的所有大脑核团命名和定位均依据1997年Paxinos和Watson的文章。在计数方面,本研究在距大鼠前囟(bregma)-092~-140 mm的范围每隔三张脑片对双侧免疫组化染色阳性神经元进行计数,取数量最多的平面进行统计。对于大、小细胞区域的界定依据1982年Swanson等[17],本研究所取平面也与该文章类似(图 2)。
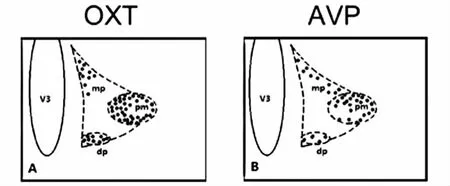
图2 计数平面
以上2个示意图显示了本研究所选计数平面中OXT(A)和AVP(B)染色阳性细胞在PVN的分布情况。pm posterior magnocellular后部大细胞区域;dp dorsal parvocellular背侧小细胞区域;mp medial parvocellular内侧小细胞区域
6统计学处理:采用Prism 50统计软件。计量资料以(均数±标准差)表示,三组比较采用单因素方差分析(one way ANOVA),两两比较采用非配对t检验。p<005为差异有统计学意义。
结 果
一、社会交往测试
1同性交往(测试鼠与社交对象鼠为同一性别):NI组的子鼠社交时间百分比为(6298±299)%,少于 SFR组(7301±197)%及 NTS组(7259±276)%差异均有统计学意义,见图3A。
2异性交往(测试鼠与社交对象鼠为不同性别):NI、NTS、SFR组子鼠社交时间百分比分别为(6867±307)%、(6893±284)%、(7271±193)%,三组比较差异无统计学意义,见图3B。
3雄性子鼠交往时间(测试鼠为雄鼠,社交对象鼠为雄鼠或雌鼠):NI、NTS、SFR组雄鼠子鼠社交时间百分比分别为(6826±372)%、(7157±314)%、(7421±258)%,三组比较差异均无统计学意义,见图3C。
4雌性子鼠交往时间(测试鼠为雌鼠,社交对象鼠为雄鼠或雌鼠):NI组的雌性子鼠社交时间百分比为(6372±241)%,少于 SFR组(7214±160)%及 NTS组(7000±251)%,差异均有统计学意义,见图3D。
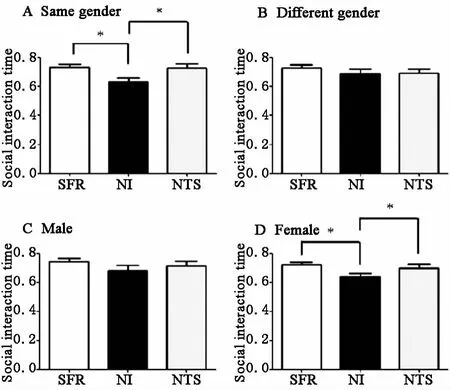
图3 NI与NTS对子鼠成年后社会交往的影响(三室实验) A同性交往;B异性交往;C雄鼠;D雌鼠。 p<005。SFR:正常对照;NI:新生儿期隔离;NTS:新生儿期抚触刺激
二、焦虑水平测试(黑白箱测试)
NI、NTS、SFR组雌鼠在黑箱中度过的时间百分比分别为(6290±284)%、(5514±250)%、(6256±264)%,雄鼠在黑箱中度过的时间百分比分别为(7035±540)%、(6993±588)%、(6635±907)%,全部子鼠在黑箱中度过的时间百 分 比 分 别 为 (6636±297)%、(6226±338)%、(6388±349)%。三组不同性别子鼠焦虑水平无差异,见图4,说明NI或NTS对环境所导致的焦虑水平无影响。
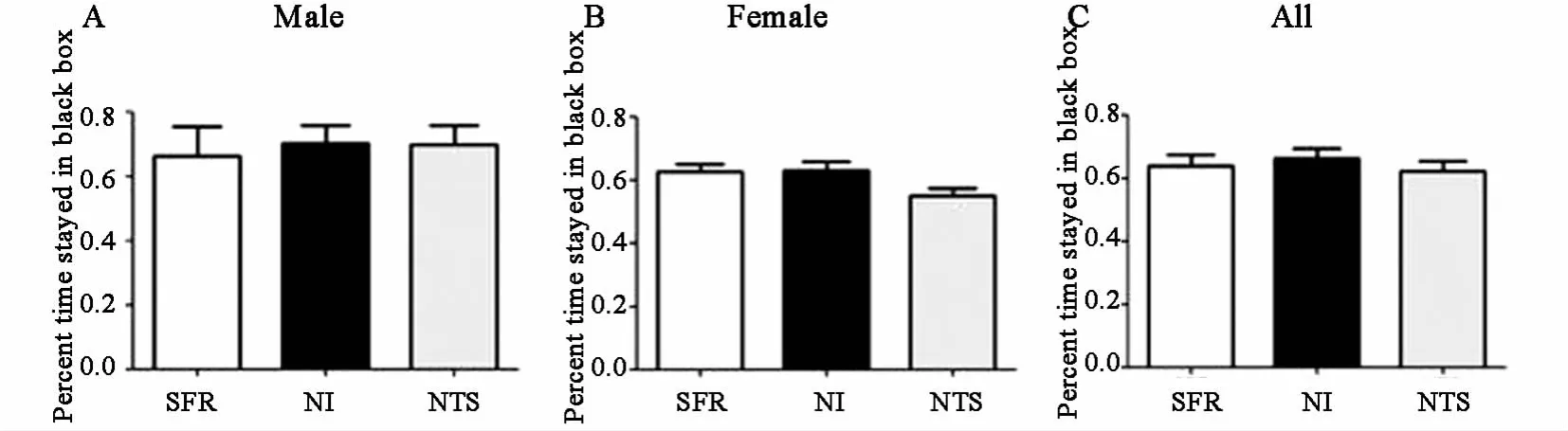
图4 NI与NTS对子鼠成年后环境所导致焦虑水平的影响(黑白箱实验) A雄鼠;B雌鼠;C雌雄鼠合计。SFR:正常对照;NI:新生儿期隔离;NTS:新生儿期抚触刺激
三、OXT在PVN和SON的表达
在PVN中(图5A、C),NI组 OXT阳性的大细胞神经元数目为(366±531),较 SFR组(662±749)和 NTS组(714±986)减少,差异均有统计学意义;NI、NTS、SFR组OXT阳性的小细胞神经元数目分别(220±689)、(302±531)、(296±605),三组比较差异无统计学意义,见图5E、F。在PVN中,NI、NTS、SFR组OXT阳性的细胞神经元数目分别为(882±140)、(668±149)、(1010±158);在 SON中(图 5B、D),NI、NTS、SFR组 OXT阳性的细胞神经元数目分别为(914±774)、(898±589)、(890±373),三组比较差异均无统计学意义,见图5G、H。
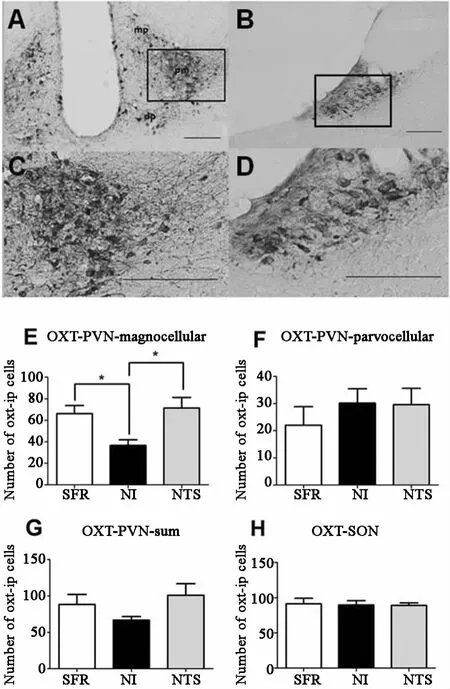
图5 雌性成年大鼠OXT阳性细胞图和在各组中的表达 APVN(免疫组化,×20);BSON(免疫组化,×20);CPVN(免疫组化,×50);DSON(免疫组化,×50)。pm posterior magnocellular后部大细胞区域;dp dorsal parvocellular背 侧 小 细 胞 区 域;mp medial parvocellular内侧小细胞区域,比例尺=200μm。成年雌性大鼠PVN(E,F,G)和SON(H)中OXT阳性细胞数目。 p<005
四、AVP在PVN和SON中的表达
在PVN中(图6A、C),AVP阳性的大细胞神经元的变化与 OXT表达类似,NI组(3343±320)较SFR组(672±1454)和 NTS组(642±696)减少,差异均有统计学意义;NI组AVP阳性的小神经元(88±196)也较 SFP组(344±1061)减少,差异有统计学意义,见图6E、F。在PVN中,NI组阳性神经元(416±382)较 SFP组(1016±2457)减少,差异有统计学意义,见图6G;在SON中(图6B、D),NI、NTS、SFR组 AVP阳性神经元数量分别为(8640±1901)、(9400±2183)、(11600±2607),三组比较差异无统计学意义,见图6H。
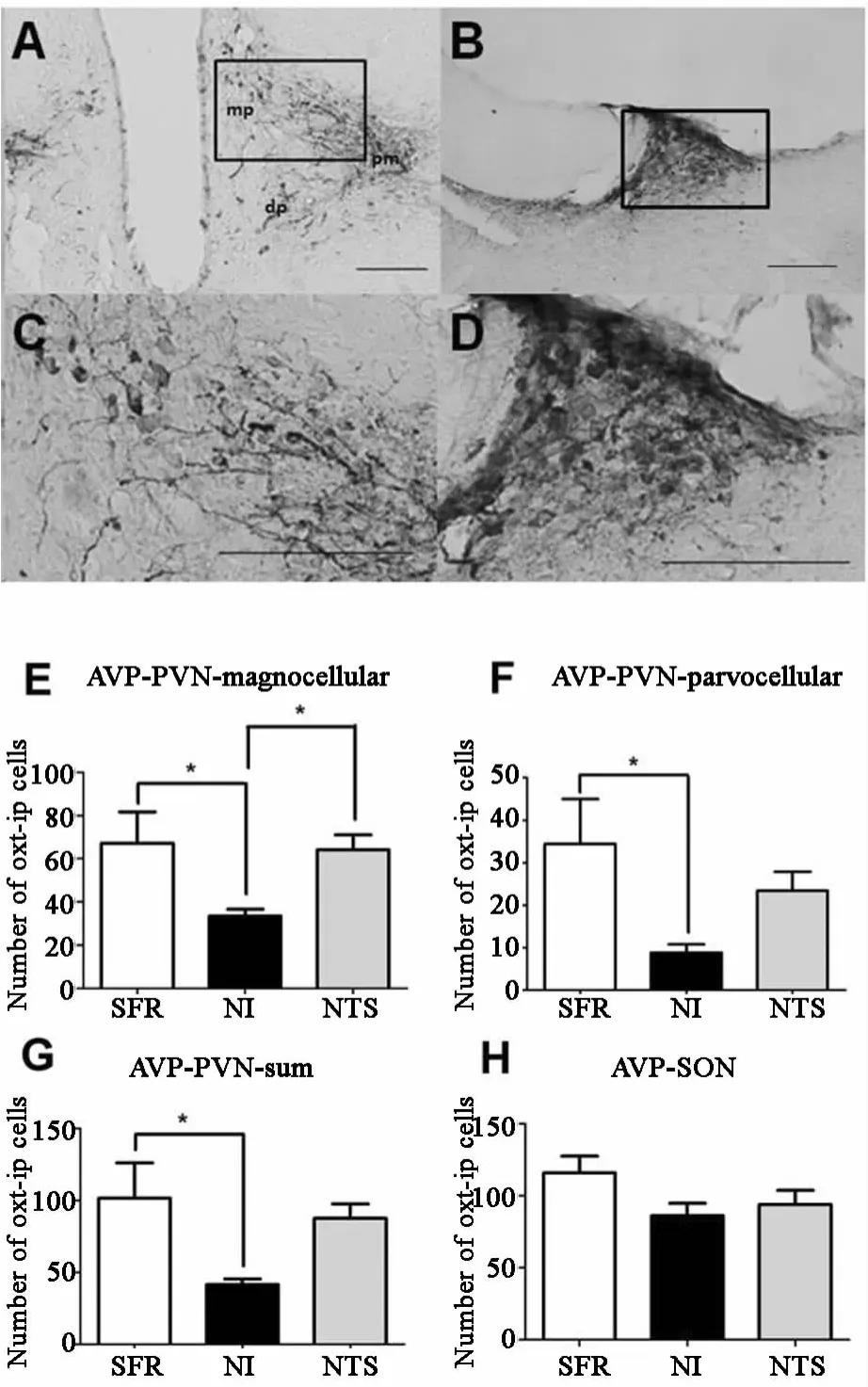
图6 雌性成年大鼠AVP阳性细胞图和在各组中的表达 APVN(免疫组化,×20);BSON(免疫组化,×20);CPVN(免疫组化,×50);DSON(免疫组化,×50)。pm posterior magnocellular后部大细胞区域;dp dorsal parvocellular背 侧 小 细 胞 区 域;mp medial parvocellular内侧小细胞区域,比例尺=200μm。成年雌性大鼠PVN(E,F,G)和SON(H)中OXT阳性细胞数目。 p<005
五、行为学测试结果与OXT、AVP水平相关性分析
雌性子鼠社交测试结果与其脑内PVN中OXT、AVP免疫组化阳性细胞水平的相关性见图7。雌鼠PVN中OXT、AVP免疫组化阳性的总细胞数目(大小细胞总合)与其同性交往时间呈正相关(r2=0277,P=0044;r2=0325,P=0017)。雌鼠 PVN中AVP免疫组化阳性的大细胞数目与同性交往时间呈正相关(r=0372,P=0009),而雌鼠 PVN中OXT免疫组化阳性的大细胞数目与同性交往时间无相关性(r=0191,P=0103)。
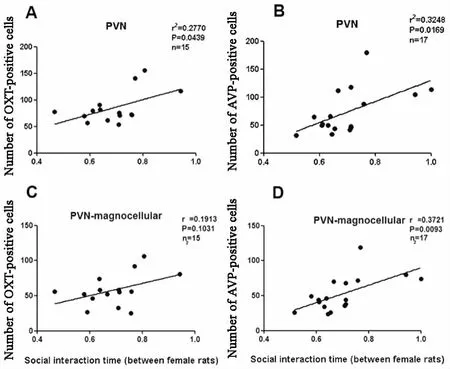
图7 雌性子鼠社交测试与其脑内PVN中OXT、AVP免疫组化阳性细胞水平的相关性 雌鼠PVN中OXT(A)、AVP(B)阳性的总细胞数目,AVP(D)阳性的大细胞数目与其同性交往时间正相关;雌鼠PVN中OXT(C)阳性的大细胞数目与其同性交往时间无关
讨 论
本研究利用新生儿期间母子隔离(NI)和抚触刺激(NTS)的大鼠模型研究早期社会环境对成年后社交行为的影响。三室实验的结果显示,NI组与社交对象鼠相处时间较对照组少,说明NI对大鼠的社交发展有不良影响。而在NI后进行了NTS的大鼠成年后社交行为与同一母鼠抚养的对照组无差异,说明抚触刺激部分逆转了母子隔离的不良作用。本研究结果与之前婴儿期短期抚触刺激对成年社交行为有不良影响的报道不符[13],可能与抚触刺激方式不同有关,后者为短期干预。来自异种生物的短期抚触可能对动物是一种应激刺激,导致对社交行为发展产生不良影响。在本实验条件下,反复进行的人为抚触刺激,导致动物已经适应,且皮肤刺激对于OXT、AVP的产生有刺激作用,最终逆转了母子隔离所致的不良社交影响。因此,本研究结果提示,婴儿期长期抚触刺激可能对成年期的社交行为有积极作用,即抚触刺激在我们实验中可能模仿了母子接触,从而产生治疗作用。
社交减少可能源于焦虑水平增加。在黑白箱实验中,三组无差异说明亲子隔离对大鼠成年后的焦虑水平无影响。因此,本研究认为,NI和NTS仅特异性地影响社交行为,而对焦虑水平无影响。
PVN合成的OXT与社交行为和雌雄配对有关,且有报道显示PVN小细胞神经元的OXT阳性细胞减少与亲近社交行为减少有关[13],也曾有报道称NI可导致 PVN小细胞神经元 OXT表达下降[18]。本研究中,NI组PVN处的大细胞神经元OXT表达下降且NTS可使OXT恢复,而小细胞神经元无明显改变。这些不同的结果可能由于PVN的大、小细胞神元均合成OXT。德国科学家指出,OXT和AVP由两类神经元合成,一类是PVN和SON的大细胞神经元,另一类是PVN的小细胞神经元;大细胞神经元的下游也有2条通路,一个是通过轴突投射到垂体后叶,另一个是通过树突释放到细胞外区域;而后者不仅影响局部OXT含量,还可以扩散到大脑的远隔区域;小细胞神经元的下游通路为通过轴突投射到其他大脑区域,如杏仁核、海马等[19]。因此,大、小细胞神经元均可以合成OXT并对特定的大脑区域发挥作用。据此推测,早期的社会环境可能对PVN中这两类神经元OXT的表达均有影响。本研究也显示,PVN处总OXT阳性神经元的数目与雌性大鼠同性社会交往有关,说明OXT可能是介导NI或NTS影响社交行为的途径之一。
很多综述总结了OXT在社交行为上的作用[2021]。OXT可增加理解他人情绪的能力,并可使个体更愿意接受有风险的合作或信任行为,从而提高社交行为[19]。近期的功能磁共振(functional magnetic resonance imaging,fMRI)研究绘制了可能介导OXT影响社交行为的相关脑区。大部分已发表的文章显示,经鼻OXT吸入可影响杏仁核和其下游脑区,如脑干[22]。但是,具体的分子机制仍不清楚。
本实验也发现,NI可导致雌鼠PVN的AVP阳性神经元减少,这与既往研究[16]类似。本研究中NTS对PVN的AVP阳性神经元的影响,与之前研究所报道的因NI而降低的AVP阳性神经元数目可通过NTS升高一致[23]。本实验还分析了雌鼠AVP阳性神经元数目和社交能力的相关性,发现PVN的AVP阳性神经元数目与同性交往水平正相关。该结果支持AVP可促进社交能力且受NI或NTS影响的假设。
AVP的功能可能来源于其在“社交行为神经网络”中的作用。此概念由Newman在1999年提出,强调该网络中的各个成分彼此相互影响,共同调控很多社交行为[24]。AVP和AVP受体(V1a受体等)也在整个网络中广泛存在[25]。现有研究指出,AVP可调节对感觉信息的接收,影响社交决策并促进社交行为相关运动神经元的输出[25]。但是,其具体分子机制仍不明确。
另外,NI和NTS对大鼠社交行为的影响有性别特异性。本研究中,NI对社交的负面影响在雌鼠中更加明显,这与之前的报道一致[26]。由于雌激素可影响雌鼠情绪和焦虑水平,且具有浓度依赖性,为了消除波动的雌激素水平对社交行为的影响,Tsuda等[9]进一步探究了NI对切除卵巢雌鼠的作用,仍发现类似的结果,即NI可降低雌鼠社交行为。
近期由Dumais和Veenema总结的OXT和AVP系统的性别差异提出新的观点[27]。越来越多的结果证明,这两个系统在合成、受体分布及行为功能上存在性别差异[27]。典型的性别特异性是指在一种性别中的影响大于另一种性别,即不同性别对OXT和AVP这两个系统的敏感性存在差异[28]。且这种性别差异还可能表现为,这两个系统在不同性别之间存在相反的作用[29]或仅在一种性别起作用[30],还可能不存在性别差异[31]。
OXT系统在大鼠社交行为的影响。一方面,Lukas等[32]研究显示,经脑脊液注射OXT可缓解成年雄鼠因社交缺陷导致的社交回避,而对雌鼠无影响[33]。而另一方面,经脑脊液注射OXT受体拮抗剂可损伤雄鼠[34]和雌鼠的社会认知能力[35]。可能OXT系统在两种性别的社会认知能力中有类似的作用,但雄性对OXT更加敏感,而雌性已达到天花板效应[27]。Rilling等[36]通过研究人经鼻吸入 OXT后社会认知能力的改变发现,OXT可增加男性壳核和尾状核的反应,却降低女性该区域的反应。因此,本研究所观察到的性别特异性可能源于两性别的不同敏感性或OXT下游靶点。
对AVP在人类社交行为中作用的研究,大多以男性为研究对象,导致难以进行性别差异的分析。少数几个包括女性的研究均显示不同性别存在行为差异。在面对不熟悉的同性面孔时,男性经鼻吸入AVP可刺激争胜性面部运动模式,而在女性则可刺激亲近性面部运动模式[37]。该正常人群中的研究结果与本研究结果类似。此外,经鼻吸入AVP可增加男性纹状体、前脑基底层、脑岛、杏仁核和海马的活性,而在女性中则降低或不起作用[36]。该结果提示AVP作用的性别差异很可能与AVP激活不同脑区有关。
本研究发现另一个性别相关的结果是,NI对于同性大鼠间的交往影响更大。类似的结果之前亦有报道[9],但具体机制仍不清楚。
本研究存在以下几点不足。(1)PVN中OXT和AVP阳性神经元数目的改变并不完全等同于分子功能的改变。因此,通过功能磁共振对OXT和AVP功能从受体水平进行分析,可更加准确测定OXT和AVP功能上的改变。(2)其他母亲来源的因素亦可影响本实验结果。环境因素如NI和NTS亦可通过改变母亲养育行为而导致子鼠出现分子和行为水平的改变。(3)未来的研究对象应包括两种性别,并需要考虑雌鼠所处的月经周期,这样才能更加准确地反映性别差异。
总之,经历NI的幼鼠成年后社交能力下降,且在雌鼠及同性交往中更加显著。NTS可部分逆转NI对社交行为的不良影响。因此,NTS可能对社交能力有积极作用。NI降低PVN中OXT和AVP阳性神经元的数量,且这种改变与社交行为正相关。提示幼鼠早期经历的不良社会环境如NI可能通过诱导与哺乳动物社会联系有关区域的形态学改变,从而引起长期的行为改变,且NTS可有效逆转这种不良反应。因此,建立一个良好的亲子关系对于预防儿童行为障碍性疾病(如孤独症)有重要作用。
致谢:感谢创新人才培养计划基金(J1030831/J0108)对北京大学基础医学院的支持,以及 the Research Special Fund for Public Welfare Industry of Health of China(20130200211)对张嵘教授与韩济生院士的支持。特别感谢韩松平教授对本研究的指导与建议。
1 Agid O,Shapira B,Zislin J,et al.Environment and vulnerability to major psychiatric illness:a case control study of early parental loss in major depression, bipolar disorder and schizophrenia. Mol Psychiatry,1999,4:163172.
2 Heim C,Nemeroff CB.The role of childhood trauma in the neurobiology of mood and anxiety disorders:preclinical and clinical studies.Biol Psychiatry,2001,49:10231039.
3 Kogan MD,Blumberg SJ,Schieve LA,et al.Prevalence of parent reported diagnosis of autism spectrum disorder among children in the US,2007.Pediatrics,2009,124:13951403.
4 Zablotsky B,Black LI,Maenner MJ,et al.Estimated Prevalence of Autism and Other Developmental Disabilities Following Questionnaire Changes in the 2014 National Health Interview Survey.National Health Statistics Reports,2015,87:121.
5 Rutter M,Andersen Wood L,Beckett C,et al.Quasi autistic patterns following severe early global privation.English and Romanian Adoptees(ERA)Study Team.JChild Psychol Psychiatry,1999,40:537549.
6 Zhao X,Chen J,Chen MC,et al.Left behind children in rural China experience higher levels of anxiety and poorer living conditions.Acta Paediatr,2014,103:665670.
7 Ge Y,Se J,Zhang J.Research on relationship among internet addiction,personality traits and mental health of urban left behind children.Glob JHealth Sci,2015,7:41315.
8 Daniels WM,Pietersen CY,Carstens ME,et al.Maternal separation in rats leads to anxiety like behavior and a blunted ACTH response and altered neurotransmitter levels in response to a subsequent stressor.Metab Brain Dis,2004,19:314.
9 Tsuda MC,Ogawa S.Long lasting consequences of neonatal maternal separation on social behaviors in ovariectomized female mice.PLoS One,2012,7:e33028.
10 Hulshof HJ,Novati A,Sgoifo A,et al.Maternal separation decreases adult hippocampal cell proliferation and impairs cognitive performance but has little effect on stress sensitivity and anxiety in adult Wistar rats.Behav Brain Res,2011,216:552560.
11 Vetulani J.Early maternal separation:a rodent model of depression and a prevailing human condition.Pharmacol Rep,2013,65:14511461.
12 Imanaka A,Morinobu S,Toki S,et al.Neonatal tactile stimulation reverses the effect of neonatal isolation on open field and anxiety like behavior,and pain sensitivity in male and female adult Sprague Dawley rats.Behav Brain Res,2008,186:9197.
13 Todeschin AS,Winkelmann Duarte EC,Jacob MH,et al.Effects of neonatal handling on social memory,social interaction,and number of oxytocin and vasopressin neurons in rats.Horm Behav,2009,56:93100.
14 Harony H,Wagner S.The contribution of oxytocin and vasopressin to mammalian social behavior:potential role in autism spectrum disorder.Neurosignals,2010,18:8297.
15 Wismer Fries AB,Ziegler TE,Kurian JR,et al.Early experience in humans is associated with changes in neuropeptides critical for regulating social behavior.Proc Natl Acad Sci USA,2005,102:1723717240.
16 Lukas M,Bredewold R,Landgraf R,et al.Early life stress impairs social recognition due to a blunted response of vasopressin release within the septum of adult male rats.Psychoneuroendocrinology,2011,36:843853.
17 Sawchenko PE,Swanson LW.Immunohistochemical identification of neurons in the paraventricular nucleus of the hypothalamus that project to the medulla or to the spinal cord in the rat.J Comp Neurol,1982,205:260272.
18 Veenema AH,Bredewold R,Neumann ID.Opposite effects of maternal separation on intermale and maternal aggression in C57BL/6 mice:link to hypothalamic vasopressin and oxytocin immunoreactivity.Psychoneuroendocrinology,2007,32:437450.
19 Meyer Lindenberg A,Domes G,Kirsch P,et al.Oxytocin and vasopressin in the human brain:social neuropeptides for translational medicine.Nat Rev Neurosci,2011,12:524538.
20 Heinrichs M,Von Dawans B,Domes G.Oxytocin,vasopressin,and human social behavior.Front Neuroendocrinol,2009,30:548557.
21 Shahrestani S,Kemp AH,Guastella AJ.The impact of a single administration of intranasal oxytocin on the recognition of basic emotions in humans:a meta analysis.Neuropsychopharmacology,2013,38:19291936.
22 Kanat M,Heinrichs M,Domes G.Oxytocin and the social brain:neural mechanisms and perspectives in human research.Brain Res,2014,1580:160171.
23 Wei B,Tai F,Xiao L,et al.Neonatal tactile stimulation alleviates the negative effects of neonatal isolation on novel object recognition,sociability and neuroendocrine levels in male adult mandarin voles(Microtus mandarinus).Physiology&Behavior,2013,112:1422.
24 Newman SW.The medial extended amygdala in male reproductive behavior.A node in the mammalian social behavior network.Ann N Y Acad Sci,1999,877:242257.
25 Albers HE.The regulation of social recognition,social communication and aggression:vasopressin in the social behavior neural network.Horm Behav,2012,61:283292.
26 Spivey JM,Padilla E,Shumake JD,et al.Effects of maternal separation,early handling,and gonadal sex on regional metabolic capacity of the preweanling rat brain.Brain Res,2011,1367:198206.
27 Dumais KM,Veenema AH.Vasopressin and oxytocin receptor systems in the brain:Sex differences and sex specific regulation of social behavior.Front Neuroendocrinol,2015.
28 Liu Y,Curtis JT,Wang Z.Vasopressin in the lateral septum regulates pair bond formation in male prairie voles(Microtus ochrogaster).Behav Neurosci,2001,115:910919.
29 Miller M,Bales KL,Taylor SL,Yoon J,Hostetler CM,Carter CS,Solomon M.Oxytocin and vasopressin in children and adolescents with autism spectrum disorders:sex differences and associations with symptoms.Autism Res,2013,6:91102.
30 Bredewold R,Smith CJ,Dumais KM,et al.Sex specific modulation of juvenile social play behavior by vasopressin and oxytocin depends on social context.Front Behav Neurosci,2014,8:216.
31 Tabak BA,Meyer ML,Castle E,et al.Vasopressin,but not oxytocin,increases empathic concern among individuals who received higher levels of paternal warmth: A randomized controlled trial.Psychoneuroendocrinology,2015,51:253261.
32 Lukas M,Toth I,Reber SO,et al.The neuropeptide oxytocin facilitates pro social behavior and prevents social avoidance in rats and mice.Neuropsychopharmacology,2011,36:21592168.
33 Lukas M,Neumann ID.Social preference and maternal defeat induced social avoidance in virgin female rats:sex differences in involvement of brain oxytocin and vasopressin.J Neurosci Methods,2014,234:101107.
34 Lukas M,Toth I,Veenema AH,et al.Oxytocin mediates rodent social memory within the lateral septum and the medial amygdala depending on the relevance of the social stimulus:male juvenile versus female adult conspecifics.Psychoneuroendocrinology,2013,38:916926.
35 Engelmann M,Ebner K,Wotjak CT,et al.Endogenous oxytocin is involved in short term olfactory memory in female rats.Behav Brain Res,1998,90:8994.
36 Rilling JK,Demarco AC,Hackett PD,et al.Sex differences in the neural and behavioral response to intranasal oxytocin and vasopressin during human social interaction.Psychoneuroendocrinology,2014,39:237248.
37 Thompson RR,George K,Walton JC,et al.Sex specific influences of vasopressin on human social communication.Proc Natl Acad Sci USA,2006,103:78897894.

