初中化学“无明显现象”实验的教学研究
刘智俊


1 引言
化学是一门以实验为基础的自然科学。“无明显现象”实验探究试题最能体现化学学科的特点,此类试题设计难度大,考生失分率较高。为了提高学生的设计能力和解题能力,教师在实验教学中加强培养学生进行实验设计的能力。下面就将课本中的“无明显现象”实验分为两类:一类是无新物质生成,实验根本未发生的;另一类是有新物质生成,实验确实发生了的。那么验证化学反应是否发生的依据是什么呢?化学变化的基本特征是有新物质生成,而且还伴随着能量的变化,这种能量变化常表现为吸热、放热、发光等,这些现象常常可以帮助我们判断物质是否发生了化学变化。如果酸碱盐溶液中任意两种物质混合后“无明显现象”,该如何知道反应是否发生了呢?下面将这两类“无明显现象”实验的教学研究进行归纳总结。
2 物理变化——无新物质生成,实验根本未发生
如果酸碱盐溶液中的几种离子混合后,离子的数目、离子的浓度都不发生变化,那么证明反应的确没有发生。
案例1:怎样验证碳酸钾和硫酸钠溶液混合后是否发生了反应
探究方案见表1。
反应原理:
K2CO3+2HCl=2KCl+H2O+CO2↑;
CO2+Ca(OH)2=CaCO3↓+H2O;
Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3。
通过实验分析得出:碳酸钾和硫酸钠溶液混合前后,离子的数目、离子的浓度都不发生变化,证明反应没有发生。
3 化學变化——有新物质生成,实验确实发生了
如果溶液中的几种离子混合后使其离子数目减少、离子浓度降低,那么反应就沿着离子数目减少、离子浓度降低的方向进行,则证明反应确实发生了。
3.1 案例2:如何用实验证明CO2与NaOH发生了反应
(1)密闭体系中反应物状态的变化引起压强差来证明反应确实发生了
设计原理:由于二氧化碳可与氢氧化钠溶液反应(CO2+2NaOH=Na2CO3+H2O),二氧化碳气体体积减少,造成密闭体系内压强减少,外界大气压大于瓶内的气压。根据反应前后压强的变化可以设计不同的实验装置。
设计一:取2个相同体积的软塑料瓶分别收集满CO2,将等体积的水和NaOH溶液分别倒入两个软塑料瓶中,盖上瓶盖后震荡,如图1所示。倒入NaOH溶液的软塑料瓶比倒入水的软塑料瓶变瘪的现象更明显。通过“对比实验”证明CO2与NaOH溶液反应的确发生了。
设计二:将等体积的水和浓NaOH溶液分别倒入2个相同的烧杯中,再取2支相同体积的试管分别收集满CO2,同时将收集满CO2的试管倒扣在2个烧杯中,如图2所示。倒扣在浓NaOH溶液里的试管上升的液面明显高于装水的烧杯里面的试管的液面。通过“对比实验”再次证明CO2与NaOH溶液发生了反应。
设计三:将300 mL浓NaOH溶液倒入收集满CO2的广口瓶中,将煮熟去壳的鸡蛋放在广口瓶口,出现了“瓶吞鸡蛋”的现象,证明发生了反应。
设计四:将100 mL浓NaOH溶液倒入收集满CO2的广口瓶中,用一个带有U型管的橡皮塞塞紧瓶口,如图3所示。U型管的液面左侧上升右侧下降且液体进入广口瓶中,证明CO2与NaOH发生了反应。
设计五:按如图4所示装置设计一个“喷泉实验”,将胶头滴管里的浓NaOH溶液挤压到圆底烧瓶中,再打开止水夹。广口瓶中的红色液体沿着玻璃管进入圆底烧瓶,形成美丽的红色喷泉。右侧广口瓶中的稀盐酸倒流入左侧的广口瓶中,红色逐渐变为无色,证明发生了反应。
设计六:将200 mL浓NaOH溶液倒入收集满CO2的锥形瓶中,然后用一个带有玻璃管的双孔橡皮塞塞紧,玻璃管的下端系上一个气球,如图5所示。将胶头滴管里的浓氢氧化钠溶液滴入锥形瓶中,气球迅速膨胀,证明反应发生了。
设计七:先用止水夹夹住玻璃导管中的乳胶管,集气瓶里装满水,再将注射器里的浓NaOH溶液注入装满二氧化碳的圆底烧瓶中,最后打开止水夹。集气瓶里的水倒流入圆底烧瓶中,如图6所示,证明发生了反应。
(2)验证生成物Na2CO3的性质来证明反应的确发生了
方法一:将CO2气体通入NaOH溶液中,再滴加稀盐酸(或稀硫酸或稀硝酸),如图7所示。刚开始无明显现象,是酸与过量的氢氧化钠反应,继续滴加足量的稀盐酸,看到有大量气泡产生,将气体通入澄清的石灰水中,澄清石灰水变浑浊。说明溶液中含有CO2-3,证明CO2与NaOH发生了反应。
反应原理:
CO2+2NaOH=Na2CO3+H2O;
HCl+NaOH=NaCl+H2O;
Na2CO3+2HCl=2NaCl+H2O+CO2↑;
CO2+Ca(OH)2=CaCO3↓+H2O。
向碳酸钠和氢氧化钠溶液中滴加稀盐酸时,不会立即产生气泡,只有酸碱中和反应结束后,才会发生稀盐酸与碳酸钠的反应。即,当OH-和CO2-3同时与H+反应时,只有当OH-反应完了以后,才会和CO2-3反应生成H2O和CO2。
方法二:将CO2气体通入NaOH溶液中,再滴加Ca(OH)2或Ba(OH)2或CaCl2或BaCl2或Ca(NO3)2或Ba(NO3)2或AgNO3溶液,有白色沉淀(CaCO3或BaCO3或Ag2CO3)产生,证明CO2与NaOH发生了反应。
反应原理:
CO2+2NaOH=Na2CO3+H2O;
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓。
证明CO2能与NaOH溶液反应的实验设计原理是:①根据反应前后压强的变化(瓶吞鸡蛋、气球膨胀、喷泉实验、液面差实验等)来设计的探究实验;②根据生成物盐Na2CO3的化学性质设计的探究实验;③反应的本质都是溶液中的离子数目减少、离子浓度降低生成了气体或沉淀或水。
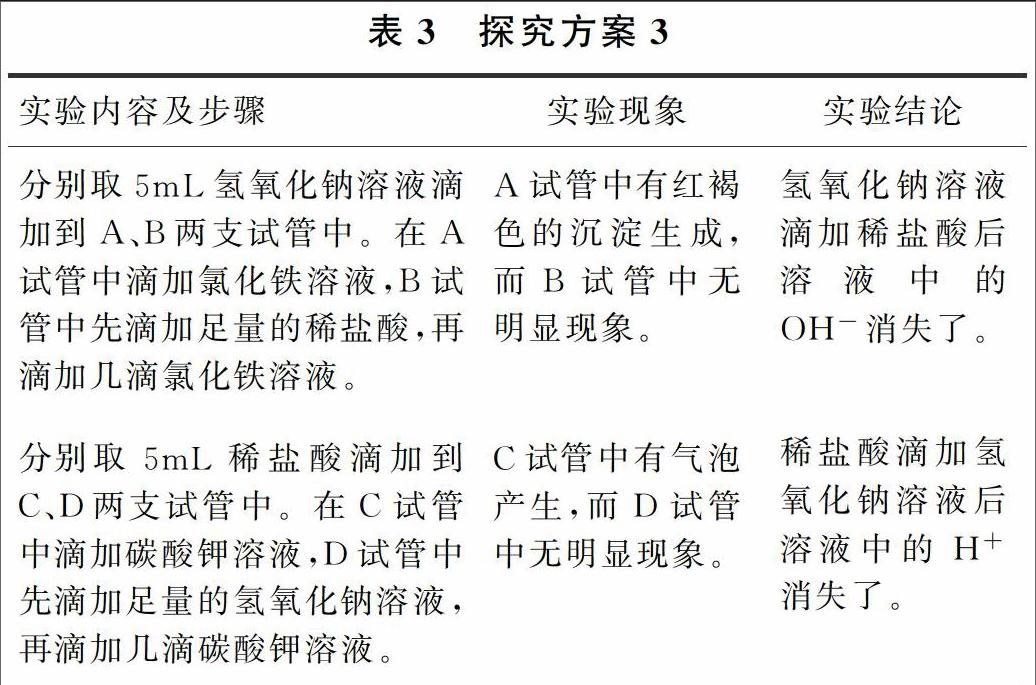
3.2 案例3:怎样验证稀盐酸和氢氧化钠溶液混合后是否发生反应
(1)借助酸碱指示剂证明反应物的性质加以验证。探究方案见表2。
(2)添加其他试剂使其反应物中的离子数目减少、离子浓度降低加以验证。探究方案见表3。
方案3中的氯化铁溶液也可以替换成含(Fe3+或Cu2+或Mg2+或NH4+)盐溶液;碳酸钾溶液也可以替换成单质金属镁、锌或金属氧化物氧化铜、氧化铁或盐碳酸钙、碳酸钠、碳酸氢钠。
方案2和方案3通过溶液中某些离子明显减少来证明已经发生了反应(有新物质生成),而方案1则是通过溶液中某些离子没有明显减少来证明没有发生反应(无新物质生成)。
(3)通过中和反应的热效应来证明反应的发生
方法一:用双手直接触摸稀盐酸和氢氧化钠溶液的试管外壁,感觉温度明显升高,证明发生了反应。
方法二:用温度计测试反应后溶液的温度。
方法三:按如图8所示装置设计并完成實验,看到U型管右侧的红墨水上升,左侧红墨水下降。证明中和反应放热,锥形瓶内空气体积膨胀,瓶内压强大于外界压强。
3.3 案例4:如何证明CO2与H2O是否反应
实验步骤:取4朵用石蕊溶液染成紫色的干燥纸花。第1朵纸花喷上稀醋酸,第2朵纸花喷上水,第3朵纸花直接放入盛满二氧化碳的集气瓶中,第4朵纸花喷上水后,再放入盛满二氧化碳的集气瓶中,观察4朵纸花的颜色变化,如图9所示。
提出问题:紫色石蕊溶液遇到什么物质变红?
猜想与假设:①CO2;②H2O;③CO2和H2O反应的生成物碳酸。
实验现象见表4。
实验结论:二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊溶液变成红色。
化学方程式:CO2+H2O=H2CO3。
[BFQ]案例1没有新物质生成,所以碳酸钾和硫酸钠溶液没有发生反应,而案例2、案例3、案例4都有新物质生成,所以都发生了化学反应。判断“无明显现象”实验,是否发生了化学反应的依据,是看是否有新物质生成。若是酸碱盐溶液混合,是看是否离子减少生成了气体或沉淀或水(即复分解反应发生的条件);其他物质混合,是看是否有新物质生成(比如二氧化碳与水反应有新物质H2CO3生成)。[BF]
提出问题:其他酸性氧化物都能与水反应吗?如何书写化学方程式?书写酸性氧化物与可溶性碱的化学方程式是整个初中的最难点,如何引导书写呢?其实可以分3步进行(以酸性氧化物分别与NaOH反应为例)。
(1)酸性氧化物+H2O=酸
CO2+H2O=H2CO3;SO2+H2O=H2SO3;SO3+H2O=H2SO4
注意:SiO2既不溶于水也不与水反应,SiO2对应的水化物是硅酸(H2SiO3),H2SiO3也难溶于水。
(2)酸+碱=盐+H2O
H2CO3+2NaOH=Na2CO3+2H2O;H2SO3+2NaOH=Na2SO3+2H2O;H2SO4+2NaOH=Na2SO4+2H2O
(3)酸性氧化物+碱=盐+H2O(碱可溶)
CO2+2NaOH=Na2CO3+H2O;SO2+2NaOH=Na2SO3+H2O;
SO3+2NaOH=Na2SO4+H2O;SiO2+2NaOH=Na2SiO3+H2O
探究实验是化学教学中的灵魂。在新课教学过程中,应抓住“无明显现象”实验的教学研究为契机,引导学生通过设置实验来达到判断反应是否发生的目的,从而培养学生的探究精神和发展学生的思维能力。在复习教学过程中,更应抓住出题热点,精选实验习题,既要重视夯实基础,又要加强综合题的训练。要理清物质间的关系,将实验知识结构化、具体化、系统化,掌握科学的学习方法,提高解决实验问题的能力,这样既有助于学生取得优异成绩,又有利于学生化学科学素养的提升。

