硫铁矿烧渣铁系氧化物的酸溶特性
詹 咏, 张焕焕, 疏 醒, 沈丹妮, 董 滨
(1.上海理工大学 环境与建筑学院,上海 200093; 2.上海纺织建筑设计研究院,上海 200060;3.同济大学 环境科学与工程学院,上海 200092)
(1.School of Environment and Architecture,University of Shanghai for Science and Technology,Shanghai 200093,China; 2.Institute of Shanghai for Textile and Architectural Design,Shanghai 200060,China; 3.School of Environmental Science and Engineering,Tongji University,Shanghai 200092,China)
硫铁矿烧渣铁系氧化物的酸溶特性
詹 咏1, 张焕焕1, 疏 醒1, 沈丹妮2, 董 滨3
(1.上海理工大学 环境与建筑学院,上海 200093; 2.上海纺织建筑设计研究院,上海 200060;3.同济大学 环境科学与工程学院,上海 200092)
为了改善硫铁矿烧渣酸溶工艺,提高铁的浸取率,研究了在70 ℃,反应3 h,酸过量系数为1.2的条件下,不同质量分数的盐酸、硫酸以及两者混合后硫铁矿烧渣中铁系氧化物的酸溶特性.通过酸溶效果的数值模拟分析可知,盐酸酸溶效果优于硫酸酸溶.由混酸实验结果发现,混酸溶解效果优于相同H+浓度的单酸.此外,为了更准确地说明酸溶特性,对酸溶后的残渣进行了ICP,XRD和SEM表征.结果发现:原矿渣中主要含有的Fe3O4含量明显减少,表面呈现复杂结构的团块状也被分解成不同形状的小颗粒;且硫酸在酸溶过程中与矿渣中的金属形成新的晶体化合物,阻碍溶解.
硫铁矿烧渣; 酸溶; 混酸; 数值模拟; 结晶
硫铁矿烧渣是以硫铁矿或含硫尾砂为原料生产硫酸过程中所排出的废渣,我国每年产生硫铁矿烧渣约有1 000 万t,占工业固体废弃物的1/3左右[1-2].长期以来我国一般采用堆填处置,不仅浪费资源,而且对大气、水体、土壤都有不同程度的污染[3-5].硫铁矿烧渣富含Fe2O3和Fe3O4,含铁量为20%~60%,是非常重要的铁矿资源[6-7].因此,硫铁矿烧渣中铁的回收利用已成为一种废物资源化趋势,对于环境保护和资源的可持续利用具有十分重要的意义.
近年来,国内外对硫铁矿烧渣回收利用进行了一系列研究,如姜凌等[8]用硫铁矿烧渣制取聚合硫酸铁;Alp等[9]研究在工业规模下利用硫铁矿烧渣为铁系原料制备硅酸盐水泥熟料.从研究中发现,硫铁矿烧渣回收利用的关键步骤是提高铁的资源化[10-12].回收烧渣中的铁,主要有焙烧法和酸溶法等[13-15],焙烧法工艺复杂、耗能高,不适合工业生产.酸溶法工艺简单,但铁提取率较低,因此,需深入探讨硫铁矿烧渣中铁氧化物的酸溶特性,进而提高铁的溶解率.
本文在不同研究者对硫铁矿烧渣回收利用研究的基础上,以安徽某厂的硫铁矿烧渣为原料,通过正交实验探索硫铁矿烧渣的酸溶条件,在此条件下进一步探讨硫铁矿烧渣在不同酸种类、不同酸质量分数下,铁系氧化物的酸溶动力学和相应未溶解残渣表征.本文的研究结果可以为改善酸溶工艺、提高铁的浸取率、实现硫铁矿烧渣的资源化利用提供一定的参考.
1 实验材料和方法
1.1 实验试剂与仪器
试剂:硫酸(分析纯,98%);盐酸(分析纯,36%);磷酸(分析纯,>85%);重铬酸钾(分析纯);二苯胺磺酸钠指示剂(分析纯,5 g/L);二氯化锡溶液(分析纯,50 g/L);二氯化汞(分析纯,饱和溶液).
仪器:SHZ-C型水浴摇床,MP5002型电子天平,MP-3SP2行星球磨机,DHG-9140A型烘箱,TG1650-WS型离心机,恒温干燥器,三口烧瓶.
1.2 原料成分分析方法
原料取自于安徽某硫酸厂的硫铁矿烧渣,在105 ℃的烘箱干燥2 h,经球磨机研磨后过0.075 mm的筛孔,装袋备用.采用ICP-OES(电感耦合等离子体发射光谱仪)测定样品中多种元素含量,通过XRD(X射线衍射)对其物相组成进行分析,并用SEM(扫描电子显微镜)观察样品的表面形貌.
1.3 酸溶实验
1.3.1 酸溶条件选择
硫铁矿烧渣的酸溶反应属于液固相反应,铁的浸取率受到酸质量分数、酸过量系数、反应温度T、酸浸时间t的影响[16],且从已有研究结果得出[17-18],酸量越多,对矿渣中的铁浸取效果越好,但会导致浸取液中含有大量的酸,对后续的资源化利用产生不利的影响.因此,本实验选取酸过量系数为1.2.设计四因素三水平正交实验L9(34),如表1所示,实验中均称取10 g硫铁矿烧渣,每组做3组平行样.
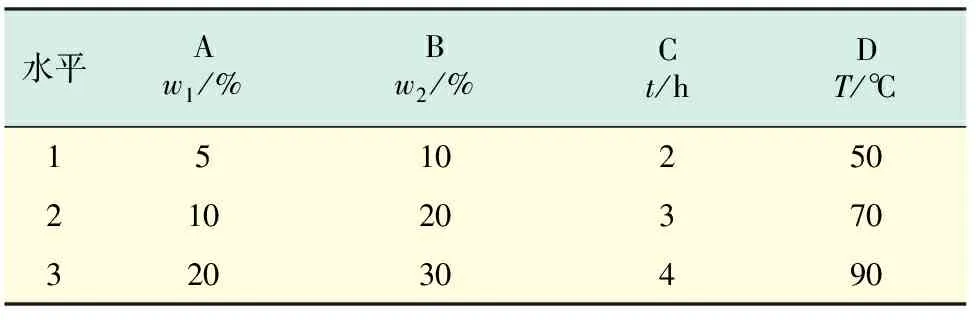
表1 实验因素和水平
1.3.2 酸溶实验
为了进一步探究烧渣铁系氧化物的酸溶特性,设计了单酸与混酸实验.在单酸实验中,称取10 g烧渣,分别加入盐酸质量分数w1为10%,15%,20%,25%,30%,35%,硫酸质量分数w2为10%,20%,30%,40%,50%于三口烧瓶中,加酸量为理论值的1.2倍.根据正交实验结果,在一定温度下搅拌反应一定时间,反应停止后,离心得到残渣和浸取液,用氯化亚锡-氯化汞-重铬酸钾法测定浸取液中全铁含量.
根据单酸实验最优结果进行混酸实验,称取10 g硫铁矿烧渣,分别加入一定质量分数的盐酸和硫酸的混酸溶液,盐酸和硫酸的物质的量比n1∶n2分别为3∶1,2∶1,1∶1,1∶2,1∶3,为了保证与单酸实验具有相同氢离子含量,酸过量系数仍为1.2,后续分析方法同单酸实验.
酸溶实验主要的反应方程式为
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
(1)
Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(2)
2 结果与讨论
2.1 原料成分分析
实验通过ICP-OES对硫铁矿烧渣进行元素分析,其结果如表2所示.采用X射线粉末衍射进行定性分析,其物相组成分析如图1所示.C为衍射强度,θ为2倍X射线入射角.

表2 烧渣化学元素分析
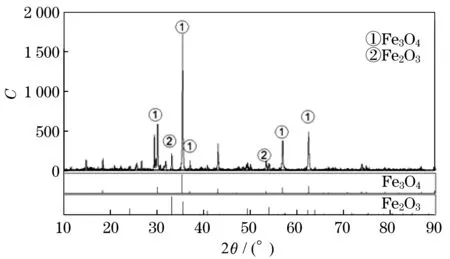
图1 硫铁矿烧渣的X射线衍射图
由表2及图1发现,该烧渣含铁量较高,占总量的50.77%,且绝大部分以Fe3O4形式存在,而其他形式的铁系氧化物如Fe2O3和FeO,含量较少,此外还含有少量Ca,As,Zn等金属元素.该烧渣富含可酸溶的铁系氧化物,适合作为铁系化工产品的原料.
由于实验的硫铁矿烧渣中铁的物相组成主要是以磁铁矿即Fe3O4的形式存在,因此,为了方便酸溶定量实验,铁含量以Fe3O4计算.
2.2 酸溶溶液分析
2.2.1 正交实验结果
根据表1设定的正交实验,称取10 g硫铁矿烧渣,酸过量系数为1.2.实验结果如表3所示.表3中的Kn(n=1,2,3)表示任意列上水平号为n时所对应的实验结果之和.R′代表极差.
由表3可知,盐酸质量分数对酸浸结果影响最大,是关键因素;其次是反应温度;硫酸质量分数次之,酸浸时间影响最小.由正交实验中得到最佳的酸溶条件为20%盐酸,30%硫酸,反应温度90 ℃,酸浸时间4h.但是,从表3可以看出,温度从70 ℃上升至90 ℃时,酸溶效果有所提升,但上升不明显,酸浸时间由3 h延长至4 h时,酸溶效果基本没有变化.考虑到反应温度与酸浸时间提升会增加经济成本,因此,后续单因素实验选取反应温度为70 ℃、酸浸时间为3 h.
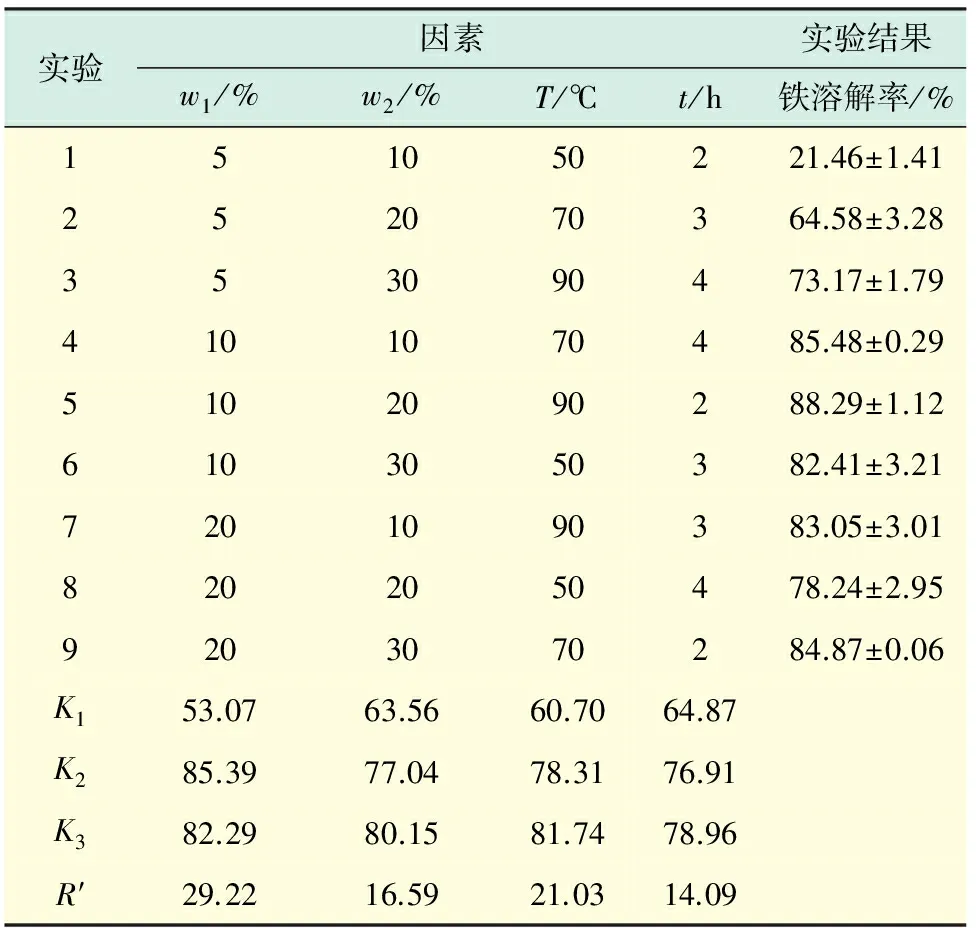
表3 正交实验结果分析表
2.2.2 单因素实验结果
酸溶实验均在70 ℃条件下反应3 h,酸过量系数为1.2.单酸实验结果如图2(a)所示.根据单酸实验结果,进行盐酸质量分数为20%,硫酸质量分数为40%的混酸实验,探讨盐酸和硫酸在混酸中的不同比例对铁系氧化物的酸溶效果,混酸实验结果如图2(b)所示.
由图2(a)可以看出:a.盐酸质量分数由10%提高至15%,矿渣中铁的溶解率上升很快,此时盐酸质量分数对矿渣中铁的浸取率影响明显.当盐酸质量分数达到20%时,铁的溶解率为80.48%,继续增加盐酸质量分数时,铁的溶解率增长缓慢,其利用率降低,成本增加,因此,混酸实验盐酸质量分数选取20%.b.当硫酸质量分数超过50%,矿渣中铁的浸取率有明显的下降趋势,由于此时硫酸的质量分数过高,导致固化现象,影响铁的溶出.本组实验中硫酸质量分数为40%时,铁的浸取率最高为81.22%,由此,混酸实验选取硫酸质量分数为40%.
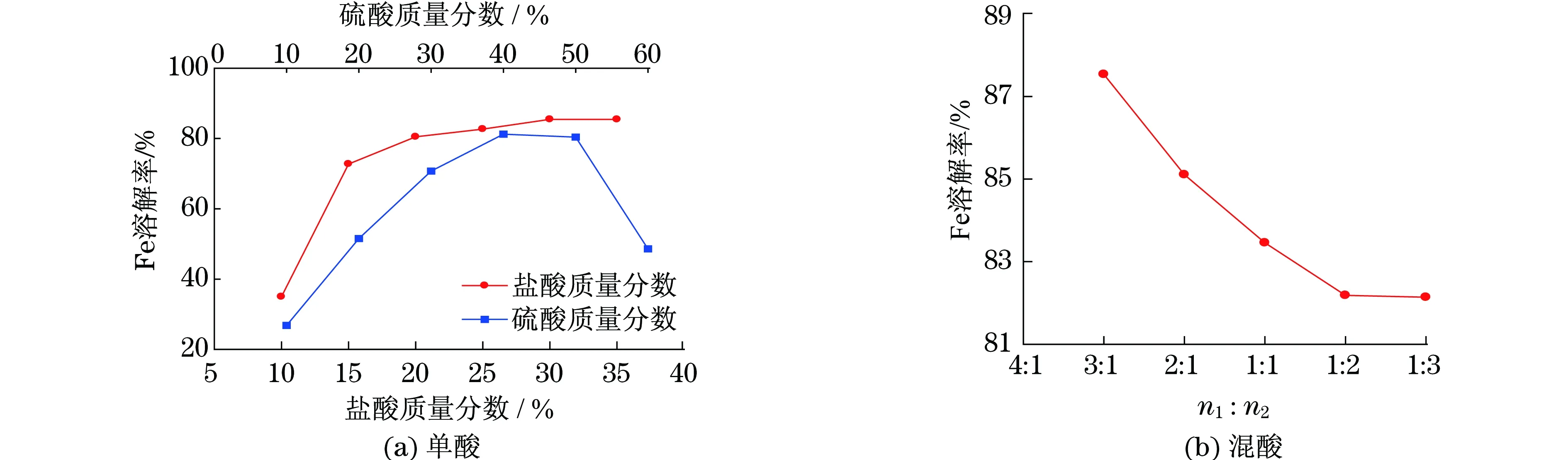
图2 硫铁矿烧渣在单酸和混酸中铁浸取率
由图2(b)可以看出,盐酸占混酸中的比值越大,酸溶效果越好.然而,盐酸的市场价格远高于硫酸,因此,在实际运用中要适当调节盐酸比例,且在这5组实验中铁的溶解率都大于81.22%,比值为3∶1时酸溶效果可达到87.54%,说明在相同条件下,混酸酸溶效果要远远优于单酸.且已有研究中,郑晓虹等[16]用硫酸浸取硫铁矿烧渣中铁的浸取率接近50%,李威等[19]通过盐酸酸溶硫铁矿烧渣得到铁的溶解率为71.43%,由于不同产地的硫铁矿烧渣化学组分不同,本文实验在70 ℃,n1∶n2=3∶1的条件下反应3 h得到铁的溶解率为87.54%,铁的浸取率偏高,酸溶效果显著,而且实验流程简单、能耗低,容易实现工业化,具有较好的经济效益和环境效益.
2.2.3 铁系氧化物酸溶速率拟合曲线分析
将上述单酸实验中酸质量分数以氢离子浓度计,得到在不同浓度的氢离子条件下,硫铁矿烧渣中Fe溶解率变化曲线.由于矿渣溶解反应属于一级动力学反应,将实验酸溶数据进行拟合,结果如图3所示,其中,拟合系数如表4和表5所示.t,P,VIF为模拟系数,R为相关性系数.由于在本实验中硫酸质量分数为60%时,出现固化现象,故舍弃该点,将硫酸质量分数在0~50%进行拟合.

图3 不同H+浓度下Fe溶解率的拟合曲线

表4 不同盐酸质量分数下铁溶解率拟合系数

表5 不同硫酸质量分数下铁溶解率拟合系数
随着盐酸和硫酸中氢离子浓度的升高,在一定范围内,Fe溶解率呈现出不同程度的增长,将它们拟合出如下方程式:
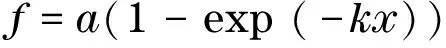
(3)
式中:f为Fe溶解率;x为H+浓度.
其他系数及其相关性如表4和表5所示,其中,盐酸和硫酸的R值分别为0.982 7,0.994 2,具有较好的相关性.分别将表4和表5中的系数代入方程(3),可得
(4)
fH2SO4=100.79(1-exp(-1.830 6x)
(5)
盐酸酸溶系数k=2.876 3,大于硫酸酸溶系数k=1.830 6,盐酸效果优于硫酸.实验结果表明,硫铁矿烧渣浸出的铁以水合离子的形式存在于反应体系中,适度的硫酸起到酸溶作用,然而盐酸更有助于三价铁的浸取,其氯离子能够在破坏烧渣颗粒的表面钝化膜之后,携带氢离子游离于烧渣的毛细部分,诱发酸溶腐蚀,从而提高铁的浸取率[20].
由上述方程可知,随着盐酸和硫酸质量分数的增加,在本实验条件下,矿渣中铁系氧化物在不同H+浓度下的溶解率拟合出的浸取率分别可达95.8%和100%;然而,由图2(a)可知,当硫酸质量分数为60%时出现固化现象,因此,继续增加硫酸质量分数,矿渣中铁的溶解率也无法提高.
2.3 酸溶残渣分析
2.3.1 酸溶残渣形貌分析
通过上述酸溶实验,选取最优条件下酸溶后的残渣作SEM分析,结果如图4示.

图4 硫铁矿烧渣以及酸溶残渣的SEM图
由图4可以看出,原矿渣呈疏松多孔的复杂结构.酸溶后,硫铁矿烧渣的形貌状态发生明显的改变,由图4(b)~(d)可以看出,颗粒粒径明显减小,尤其是经过混酸之后其粒径最小(图4(d)),硫铁矿烧渣大部分已经被降解,说明混酸的效果显著.
单酸酸溶残渣图4(b)和图4(c)呈现出不同的形貌特征,经过盐酸酸溶后的残渣(图4(b))仍然有部分疏松多孔的小颗粒,说明继续加入盐酸或增大盐酸质量分数仍会提高铁的溶解率;图4(c)呈现出许多单斜晶体状态,颗粒比较紧实,结合XRD分析,得出此单斜晶体多为CaSO4类化合物,因此,通过加入硫酸酸溶,可能会形成新的晶体化合物,进一步包裹矿渣中的金属,进而在一定程度上阻碍了铁的溶解,若此时增加硫酸质量分数,并不能明显提高铁的溶解率.
2.3.2 酸溶残渣成分分析
硫铁矿烧渣酸溶残渣XRD谱图如图5所示.由图5可知,不论是单酸还是混酸酸溶后的残渣,其Fe3O4含量都明显减少,而Fe2O3相对于Fe3O4含量反而增加.由于酸溶将大部分的Fe3O4溶解,最终致使残渣中含量很低的Fe2O3也能通过XRD检测出来.同时可以看出,只要加入硫酸后,都会出现类似硫酸钙的峰值(图5(b)和5(c));说明硫酸的加入,会结合钙离子等形成新的晶体,一定程度上阻碍矿渣中铁的溶解.由于混酸残渣中的Fe3O4与Fe2O3含量相对单酸更少,致使图5(c)中硫酸钙晶体的XRD峰在整个图谱中更加明显,因此,也验证了混酸效果显著.

图5 不同酸溶条件下残渣X射线衍射图
3 结 论
a. 正交实验表明,各因素对硫铁矿烧渣铁系氧化物的浸取率显著性由强到弱依次为:盐酸质量分数,反应温度,硫酸质量分数,酸浸时间.
b. 由酸溶效果的数值模拟分析得知,盐酸酸溶系数k=2.876 3大于硫酸酸溶系数k=1.830 6,盐酸酸溶效果优于硫酸酸溶.主要是由于硫酸酸溶过程中易与矿渣中的金属形成CaSO4等新的晶体化合物,阻碍溶解.
c. 酸溶后的矿渣被分解成不同状态的小颗粒,其中,混酸残渣粒径小于单酸酸溶,混酸(盐酸和硫酸)酸溶效果优于单酸酸溶.
d. 酸溶实验结果发现,盐酸比例越大,酸溶效果越好.因此,在实际酸溶工艺中,可结合经济成本以及具体硫铁矿烧渣特性,适当调节硫酸和盐酸的比例,更低成本地回收矿渣中的铁.
[1] FAN X H,DENG Q,GAN M,et al.Effect of biocharas reductanton magnetizing-roasting behavior of pyrite cinder[J].Journal of Iron and Steel Research(International),2015,22(5):371-376.
[2] 江元汝,张忠奎,黄永萱,等.硫铁矿烧渣水热-热解法制备纳米Fe3O4[J].化工进展,2013,32(5):1097-1101.
[3] WANG W Q,FENG Q M,LIU K,et al.A novel magnetic 4A zeolite adsorbent synthesised from kaolinite type pyrite cinder (KTPC)[J].Solid State Sciences,2015,39:52-58.
[4] 黄昱霖,严云,胡志华.低品位硫铁矿烧渣制备导电掺合料[J].环境工程学报,2012,6(4):1353-1357.
[5] 王苏然,杜曦,陈有亮,等.不同粉煤灰掺量的混凝土抗冻融性能研究[J].上海理工大学学报,2015,37(5):493-499.
[6] 党卫星,李海松,王敏,等.硫铁矿烧渣催化类Fenton法深度处理维生素C废水[J].环境污染与防治,2015,37(5):17-21.
[7] LIU J,WEN SM,CHEN Y,et al.Process optimization and reaction mechanism of removing copper from an Fe-Rich pyrite cinder using chlorination roasting[J].Journal of Iron and Steel Research (International),2013,20(8):20-26.
[8] 姜凌,董亚妮,田萍.用硫铁矿烧渣制取聚合硫酸铁的实验研究[J].环境科学与技术,2010,33(8):148-151,166.
[9] ALP I,DEVECI H,YAZICI E Y,et al.Potential use of pyrite cinders as raw material in cement production:results of industrial scale trial operations[J].Journal of Hazardous Materials,2009,166(1):144-149.
[10] ZHENG Y J,LIU Z C.Preparation of monodisperse dmicaceous iron oxide pigment from pyrite cinders[J].Powder Technology,2011,207(1/2/3):335-342.
[11] 占寿祥,郑雅杰.硫铁矿烧渣酸浸反应动力学研究[J].化学工程,2006,34(11):36-39.
[12] LIU Z C,ZHENG Y J.Effect of Fe(II) on the formation of iron oxide synthesized from pyrite cinders by hydrothermal process[J].Powder Technology,2011,209(1/2/3):119-123.
[13] 周海,徐光泽,田雪,等.硫铁矿烧渣酸浸铜反应动力学研究[J].化学工业与工程技术,2010,31(4):5-8.
[14] 龚胜.硫铁矿烧渣制备海绵铁和绿矾制备还原铁粉的工艺研究[D].长沙:中南大学,2007.
[15] YANG C X,CHEN Y H,PENG P A,et al.Trace element transformations and partitioning during the roasting of pyrite ores in the sulfuric acid industry[J].Journal of Hazardous Materials,2009,167(1/2/3):835-845.
[16] 郑晓虹,陈玉峰,黄升光,等.硫酸浸取法从硫铁矿烧渣中提取铁的研究[J].化工进展,2003,22(2):165-168.
[17] 师兆忠,高安全,张高科.混酸法浸取硫铁矿烧渣的试验研究[J].化工矿物与加工,2011,40(10):4-6.
[18] 左大学,王仁宗.硫铁矿烧渣双酸酸解工艺研究[J].磷肥与复肥,2012,27(2):10-12.
[19] 李威,华涛,周启星.盐酸酸溶硫铁矿烧渣的最佳工艺条件[J].应用基础与工程科学学报,2008,16(6):795-801.
[20] 刘培,贺延龄,刘宗宽,等.双酸法提取硫铁矿烧渣中铁[J].化工学报,2013,64(7):2619-2624.
(编辑:石 瑛)
Acid Dissolution Properties of Ferric Oxide in Pyrite CinderZHAN Yong1, ZHANG Huanhuan1, SHU Xing1, SHEN Danni2, DONG Bin3
pyritecinder;aciddissolution;mixedacid;numericalsimulation;crystallization
1007-6735(2017)01-0090-07
10.13255/j.cnki.jusst.2017.01.016
2016-06-07
詹 咏(1971-),女,副教授.研究方向:水污染控制工程方向,E-mail:jannet6@163.com
董 滨(1978-),男,副教授.研究方向:环境工程,E-mail:tj_dongbin@vip.163.com
X 754
A
(1.SchoolofEnvironmentandArchitecture,UniversityofShanghaiforScienceandTechnology,Shanghai200093,China; 2.InstituteofShanghaiforTextileandArchitecturalDesign,Shanghai200060,China; 3.SchoolofEnvironmentalScienceandEngineering,TongjiUniversity,Shanghai200092,China)

