气相色谱法同时测定复方氨酚烷胺片中4种成分的含量
董秋香,张月寒,付萍萍,刘志玮(保定市食品药品检验所,河北保定 071051)
气相色谱法同时测定复方氨酚烷胺片中4种成分的含量
董秋香*,张月寒,付萍萍,刘志玮(保定市食品药品检验所,河北保定 071051)
目的:建立同时测定复方氨酚烷胺片中对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏含量的方法。方法:采用气相色谱法。色谱柱为HP-5石英毛细管柱,程序升温,检测器为氢火焰离子化检测器,检测器温度为300℃,载气为氮气,流速为1.5 mL/min,分流比为20∶1,进样量为1 μL。结果:对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏检测质量浓度线性范围分别为156.0~4 990.4、125.7~4 023.2、19.14~612.4、2.515~80.48 μg/mL(r均为0.999 9);定量限分别为1.4、0.5、1.1、0.9 ng,检测限分别为0.4、0.2、0.3、0.3 ng;精密度、稳定性、重复性试验的RSD<2.0%;加样回收率分别为99.59%~101.77%(RSD=0.8%,n=9)、99.56%~101.80%(RSD=0.7%,n=9)、98.44%~100.83%(RSD=0.7%,n=9)、100.05%~101.91%(RSD=0.6%,n=9)。结论:该方法简便快速、准确可靠,适用于复方氨酚烷胺片中对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏的同时测定。
复方氨酚烷胺片;气相色谱法;对乙酰氨基酚;盐酸金刚烷胺;咖啡因;马来酸氯苯那敏;含量
复方氨酚烷胺片是常见的抗感冒药,用于缓解普通感冒及流行性感冒引起的发热、头痛、鼻塞、咽痛等症状,也可用于流行性感冒的预防和治疗。本品为复方制剂,由对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏及人工牛黄组成,收载于《国家药品标准》[1]和国家食品药品监督管理局标准YBH06802005[2]。现行标准中的含量测定分别采用滴定法和高效液相色谱法(HPLC);滴定法操作烦琐,易产生误差,结果重复性差。该制剂中各成分的处方量、紫外吸收强度差异均较大,采用HPLC法测定其中主成分的含量,多为测定对乙酰氨基酚、咖啡因或马来酸氯苯那敏中1~3种成分的含量[3-6],若同时测定4种成分的含量需采用双波长法[7],无法实现真正意义上的同时检测。因此,本试验采用气相色谱法(GC)建立了同时测定该制剂中对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏含量的方法,以期为全面评价药品质量提供参考。
1 材料
1.1 仪器
7820A型GC仪,包括氢火焰离子化检测器、G4513A自动进样器、EC Chrom Elite工作站(美国Agilent公司);BP211D型电子天平(德国Sartorius公司);DK-2000-ⅢLA型电热恒温水浴锅(天津泰斯特仪器有限公司)。
1.2 药品与试剂
复方氨酚烷胺片(A厂,批号:141028、141023、140414、140931、20130613、141020、20141007;B厂,批号:1410087、1410071、1411092;C厂,批号:1501241、1411071;D厂,批号:20150106、20140911;E厂,批号:140701;F厂,批号:141216;G厂,批号:1141241)规格均为12片/盒;盐酸金刚烷胺对照品(批号:100426-201002,纯度:100%)、对乙酰氨基酚对照品(批号:100018-201409,纯度:99.9%)、咖啡因对照品(批号:171215-200406,纯度:100%)和马来酸氯苯那敏对照品(批号:100047-200606,纯度:99.7%)均购自中国食品药品检定研究院;无水乙醇、三氯甲烷为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:HP-5石英毛细管柱(30 m×0.32 mm,0.25 μm);程序升温:起始温度为170℃,保持3 min,再以12℃/min升温至260℃,保持2 min;检测器:氢火焰离子化检测器;检测器温度:300℃;载气:氮气;流速:1.5 mL/min;分流比:20∶1;进样量:1 μL。
2.2 溶液的制备
2.2.1 混合对照品溶液 称取马来酸氯苯那敏对照品50.30 mg,置于25 mL量瓶中,加无水乙醇溶解并定容,摇匀,作为马来酸氯苯那敏对照品溶液;称取对乙酰氨基酚对照品124.76 mg、盐酸金刚烷胺对照品100.58 mg、咖啡因对照品15.31 mg,置于25 mL量瓶中,加无水乙醇适量使溶解,再精密加入马来酸氯苯那敏对照品溶液1 mL,加无水乙醇定容,摇匀,作为混合对照品贮备液。取上述混合对照品贮备液适量,置于25 mL量瓶中,加无水乙醇定容,摇匀,作为混合对照品溶液。
2.2.2 供试品溶液 取样品20片,精密称定,研细,称取细粉适量(约相当于对乙酰氨基酚125 mg),置于50 mL量瓶中,加无水乙醇适量,于80℃水浴加热30 min,放冷至室温,加无水乙醇定容,摇匀,经0.45 μm微孔滤膜滤过,取续滤液,即得。
2.2.3 阴性对照溶液 按样品的处方比例和制备工艺制备缺对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏的阴性样品,再按“2.2.2”项下方法制备阴性对照溶液。
2.3 系统适用性试验
精密量取“2.2”项下混合对照品溶液、供试品溶液和阴性对照溶液各适量,按“2.1”项下色谱条件进样测定,记录色谱,详见图1。由图1可知,在该色谱条件下,各成分均能达到基线分离,分离度>10;理论板数以盐酸金刚烷胺峰计为17 614,保留时间为2.450、5.430、6.870、8.490 min。结果表明,其他成分对测定无干扰。
2.4 线性关系考察
取“2.2.1”项下混合对照品贮备液适量,倍比稀释,制备乙酰氨基酚质量浓度分别为4 990.4、2 495.2、1 248.6、623.8、311.9、156.0 μg/mL,盐酸金刚烷胺质量浓度分别为4 023.2、2 011.6、1 005.8、502.9、251.4、125.7 μg/mL,咖啡因质量浓度分别为612.4、306.2、153.1、76.55、38.28、19.14 μg/mL,马来酸氯苯那敏质量浓度分别为80.48、40.24、20.12、10.06、5.030、2.515 μg/ mL的系列混合对照品溶液。取上述溶液适量,按“2.1”项下色谱条件进样测定,记录峰面积。以待测成分质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,得对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏的回归方程分别为y=4.404×103x-7.304×104(r=0.999 9)、y=5.734×103x+4.927×104(r=0.999 9)、y=2.597×103x+1.356×102(r=0.999 9)、y=3.383×103x+ 1.789×103(r=0.999 9)。结果表明,对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏检测质量浓度线性范围分别为156.0~4 990.4、125.7~4 023.2、19.14~612.4、2.515~80.48 μg/mL。

图1 气相色谱图Fig 1 GC Chromatograms
2.5 定量限和检测限考察
取“2.2.1”项下混合对照品溶液适量,倍比稀释,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。当信噪比为10∶1时,得定量限(LOQ);当信噪比为3∶1时,得检测限(LOD)。结果,对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏的LOQ分别为1.4、0.5、1.1、0.9 ng;LOD分别为0.4、0.2、0.3、0.3 ng。
2.6 精密度试验
精密量取“2.2.1”项下混合对照品溶液适量,按“2.1”项下色谱条件进样测定,记录峰面积。结果,盐酸金刚烷胺、对乙酰氨基酚、咖啡因、马来酸氯苯那敏峰面积的RSD分别为0.2%、0.3%、0.6%、0.4%(n=6),表明仪器精密度良好。
2.7 稳定性试验
取“2.2.2”项下供试品溶液(批号:141028)适量,分别于室温下放置0、1、2、4、6、8、10、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏峰面积的RSD分别为0.9%、1.2%、1.2%、1.5%(n=8),表明供试品溶液在室温下放置24 h内稳定性良好。
2.8 重复性试验
取同一批样品(批号:141028)适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算平均含量。结果,对乙酰氨基酚、盐酸金刚烷胺、咖啡因和马来酸氯苯那敏的平均含量分别为99.2%、94.4%、100.7%、98.4%,RSD分别为0.8%、1.0%、0.8%、0.9%(n=6),表明本方法重复性良好。
2.9 加样回收率试验
取已知含量的样品(批号:141028),研细,精密称取细粉适量(约相当于对乙酰氨基酚125 mg),共9份,各置于50 mL量瓶中,分别精密加入一定质量的对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏对照品,按“2.2.2”项下方法制备低、中、高质量浓度的供试品溶液。取上述溶液适量,按“2.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表1。

表1 加样回收率试验结果(n=9)Tab 1 Results of recovery test(n=9)
2.10 样品含量测定
取17批样品各适量,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积并计算对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏的含量,结果见表2。
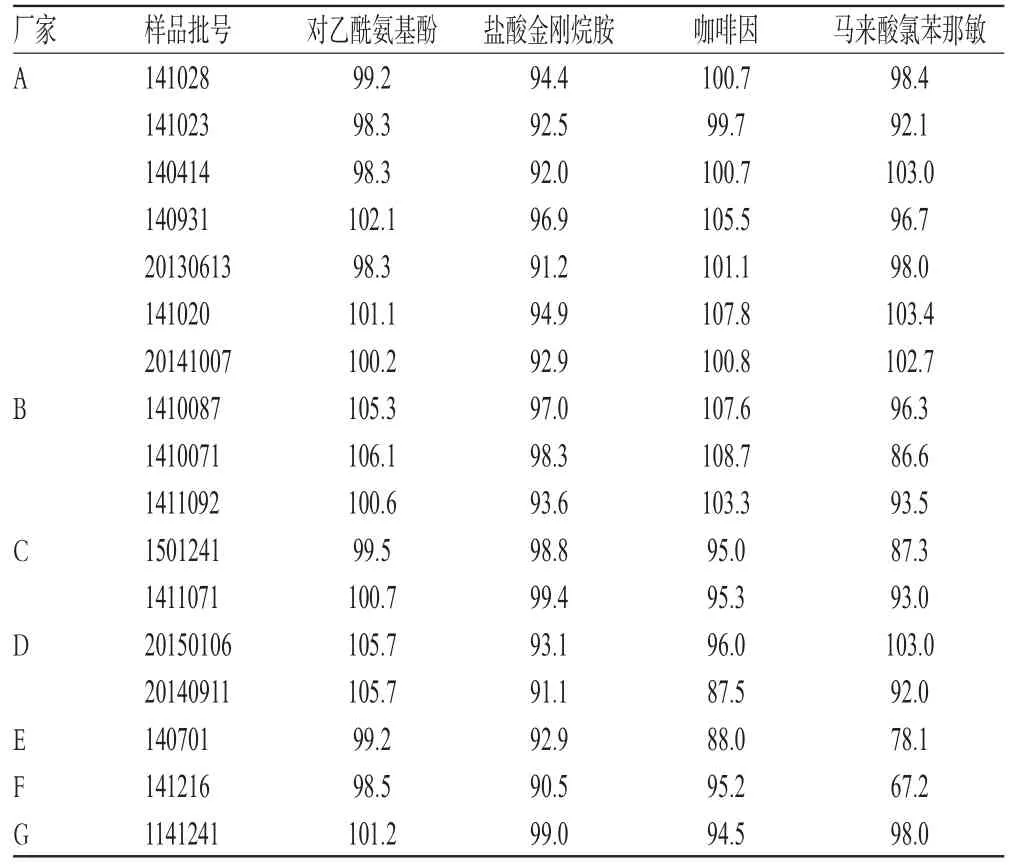
表2 样品含量测定结果(n=3,%)Tab 2 Results of contents determination of samples(n=3,%)
3 讨论
3.1 耐用性考察
本试验分别选择两种色谱柱[HP-5石英毛细管柱(30 m×0.32 mm,0.25 μm),美国Agilent公司]、[DM-5石英毛细管柱(30 m×0.32 mm,0.25 μm),重庆迪马工业有限责任公司],对对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏的分离度进行考察。结果表明,不同品牌色谱柱对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏的分离度影响不大,测定结果均符合要求,表明本方法的耐用性较好。
3.2 提取条件的选择
本品为复方制剂,笔者参考相关文献[8]并根据样品及各成分的理化性质,选取了毒性较低的无水乙醇为溶剂,采用超声振荡15 min提取相关成分。结果,咖啡因、马来酸氯苯那敏提取不完全;后改为80℃水浴加热30 min进行提取,对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏均能提取完全。因此,本试验采用80℃水浴加热30 min进行提取。
综上所述,本方法简便快速、准确可靠,适用于复方氨酚烷胺片中对乙酰氨基酚、盐酸金刚烷胺、咖啡因、马来酸氯苯那敏的同时测定。
[1] 国家食品药品监督管理局.复方氨酚烷胺片[S].WS1-XG-015-2002.2003.
[2] 国家食品药品监督管理局.复方氨酚烷胺片[S].YBH06802005.2005.
[3] 田洪根,王洪明.HPLC法测定复方氨酚烷胺片中马来酸氯苯那敏的含量及含量均匀度[J].中国药品标准,2008,9(3):207-209.
[4] 石强.HPLC法同时测定复方氨酚烷胺片中咖啡因、马来酸氯苯那敏的含量及含量均匀度[J].齐鲁药事,2012,31(10):585-587.
[5] 王军,权勤波,宋建建,等.UFLC同时测定复方氨酚烷胺片中对乙酰氨基酚和咖啡因的含量[J].中国药师,2009, 12(12):1775-1777.
[6] 谢华,傅萍,张悦杨,等.HPLC测定复方氨酚烷胺片中的对乙酰氨基酚、咖啡因和马来酸氯苯那敏[J].华西药学杂志,2012,27(3):307-308.
[7] 黄军.RP-HPLC法测定复方氨酚烷胺片中4种主要成分的含量[J].生命科学仪器,2006,4(6):16-18.
[8] 黄义纯,刘旺培.HPLC测定氨咖黄敏中对乙酰氨基酚和咖啡因的含量[J].首都医药,2007,14(16):472-474.
(编辑:刘 柳)
Simultaneous Determination of 4 Components in Compound Paracetamol and Amantadine Hydrochloride Tablet by GC
DONG Qiuxiang,ZHANG Yuehan,FU Pingping,LIU Zhiwei(Baoding Municipal Institute for Food and Drug Control,Hebei Baoding 071051,China)
OBJECTIVE:To establish a method for the simultaneous determination of paracetamol,amantadine hydrochloride,caffeine,chlorphenamine maleate in Compound paracetamol and amantadine hydrochloride tablet.METHODS:GC was performed on the column of HP-5 sillica capillary,temperature programmed,detector was FID detector,with the temperature of 300℃,carrier gas was nitrogen gas,the flow rate is 1.5 mL/min,the split ratio was 20∶1 and injection volume was 1 μL.RESULTS:The linear range was 156.0-4 990.4 μg/mL for paracetamol,125.7-4 023.2 μg/mL for amantadine hydrochloride,19.14-612.4 μg/mL for caffeine and 2.515-80.48 μg/mL for chlorphenamine maleate(all r=0.999 9);the limits of quantification were 1.4,0.5,1.1,0.9 ng,limits of detection were 0.4,0.2,0.3,0.3 ng;RSDs of precision,stability and reproducibility tests were lower than 2.0%;recoveries were 99.59%-101.77%(RSD=0.8%,n=9),99.56%-101.80%(RSD=0.7%,n=9),98.44%-100.83%(RSD=0.7%,n=9)and 100.05%-101.91%(RSD=0.6%,n=9),respectively.CONCLUSIONS:This method is simple,rapid,accurate and reliable,and suitable for the simultaneous determination of paracetamol,amantadine hydrochloride,caffeine,chlorphenamine maleate in Compound paracetamol and amantadine hydrochloride tablet.
Compound paracetamol and amantadine hydrochloride tablet;GC;Paracetamol;Amantadine hydrochloride;Caffeine;Chlorphenamine maleate;Content
R917
A
1001-0408(2017)06-0844-04
2016-02-28
2016-11-12)
*主管药师,硕士。研究方向:化学药品检验。电话:0312-5906322。E-mail:739998331@qq.com
DOI10.6039/j.issn.1001-0408.2017.06.34

