运脾和络方对糖尿病大鼠坐骨神经的保护及机制研究*
杨 欢 王东军 翁思颖 柴可夫
浙江中医药大学 浙江 杭州 310053
运脾和络方对糖尿病大鼠坐骨神经的保护及机制研究*
杨 欢 王东军 翁思颖 柴可夫#
浙江中医药大学 浙江 杭州 310053
运脾和络方 糖尿病周围神经病变 Caspase-3 氧化应激 大鼠
糖尿病神经病变(DPN)是糖尿病最为常见的并发症之一,不仅缩短患者的预期寿命,增加其病残发生率,而且给患者本人、家庭乃至社会带来巨大的痛苦与沉重的负担。目前除常规治疗尚无特效药物问世,而中医药对DPN的治疗已积累了丰富经验,疗效确切,而作用机制却亟待阐明。本课题组前期研究表明,运脾和络方(专利申请号:ZL200710156412.4)可上调糖尿病大鼠坐骨神经髓鞘碱性蛋白、脑源性神经营养因子的表达,从而修复受损神经[1]。此实验研究旨在通过探讨运脾和络方对糖尿病大鼠坐骨神经细胞Caspase-3表达、血清GSHPX、SOD活性及MDA含量的影响,探讨其治疗糖尿病周围神经病变的可能机制。现将研究结果报告如下。
1 材料
1.1 动物:清洁级健康雄性大鼠60只,体质量200± 15g,购于上海西普尔-必凯实验动物有限公司,许可证号:SCXK(沪)2013-0016,每笼4只,自由饮水,室温22~26℃。湿度45%~65%,每日12h光照维持,昼夜循环,由浙江中医药大学动物实验中心饲养及管理。
1.2 药品与试剂:运脾和络方(黄芪30g,赤芍、苍术各20g,金银花、汉防己、当归各15g,玄参、威灵仙各12g)由浙江省中药研究所制剂室提供:将全方药材粉碎成粗粉,8倍水加减煎煮2次,每次1h,合并滤液,调整pH值至中性,浓缩定容至生药含量1g/ml的溶液,0.22μm微孔滤膜过滤除菌,分装后4℃保存备用。甲钴胺:0.5mg/片,北京星昊医药股份有限公司,生产批号:10150408;Caspase-3免疫组化试剂盒,兔来源多克隆抗体:美国Promega公司;GSH-PX、MDA El isa试剂盒:南京建成生物公司;SOD活性检测试剂盒:NBT法,碧云天;ACCU-CH EK Advant age血糖仪:德国罗氏公司;血糖试剂条:德国罗氏公司,批号:451298;超薄切片机:德国莱卡EMUC;透射电镜:日立H-7650牌。
2 方法
2.1 动物模型建立:SPF级SD大鼠60只,体质量均在200g左右,适应性喂养1周后,按照完全随机原则对其进行分组,正常组8只,造模组52只。造模组大鼠禁食不禁水12h,一次性腹腔注射1%STZ30mg/kg(STZ临用前配制,溶于0.1mmo1/L、pH=4.5的无菌柠檬酸缓冲液,避光保存,30min内使用),正常组腹腔注射等量的柠檬酸钠缓冲液,造模组给予高脂高糖饲料喂养,正常组予普通饲料喂养。72h后尾静脉取血,测血糖≥16.7mmo1/L,即为造模成功。
2.2 分组与给药:按条件选取造模成功大鼠40只,随机分为模型组、运脾和络方高、中、低剂量组、甲钴胺阳性对照组,每组8只。运脾和络方高、中、低剂量分别10g/kg/d、5g/kg/d、2.5g/kg/d,阳性组甲钴胺用250mg/kg/d,模型组和正常组则灌服等量的蒸馏水,每日灌胃1次,连续灌胃16周。
2.3 指标检测:分述如下。
2.3.1 体质量及血液指标测定:称重后尾静脉采血,测空腹血糖;给药结束后取血,Elisa法测血清GSH-PX、SOD、MDA含量,运用公式计算GSH-PX、SOD活性。
2.3.2 免疫组化法检测Caspase-3蛋白:采用WiVnt图像分析系统在×200倍镜下对Caspase-3阳性结果进行半定量分析。每个标本随机观察5个视野,以阳性产物面积/视野面积表示该抗原的相对含量,取其平均值。
2.3.3 电镜观察:取大鼠坐骨神经(长约1mm),置于预冷的5%戊二醛中固定,1%锇酸进行后固定,然后漂洗,乙醇梯度脱水,丙酮包埋剂浸泡,修块定位后切片,醋酸双氧铀50%乙醇饱和液及柠檬酸铅双重染色,于透射电子显微镜下观察糖尿病大鼠坐骨神经超微结构。
2.4 统计学方法:采用SPSS22.0统计学软件进行数据分析,计量资料数据用均数±标准差表示;计量资料多组间比较采用单因素方差分析;以P<0.05为差异有统计学意义。
3 结果
3.1 体质量及空腹血糖变化:见表1。
表1 各组大鼠体质量、血糖变化的比较(±s)
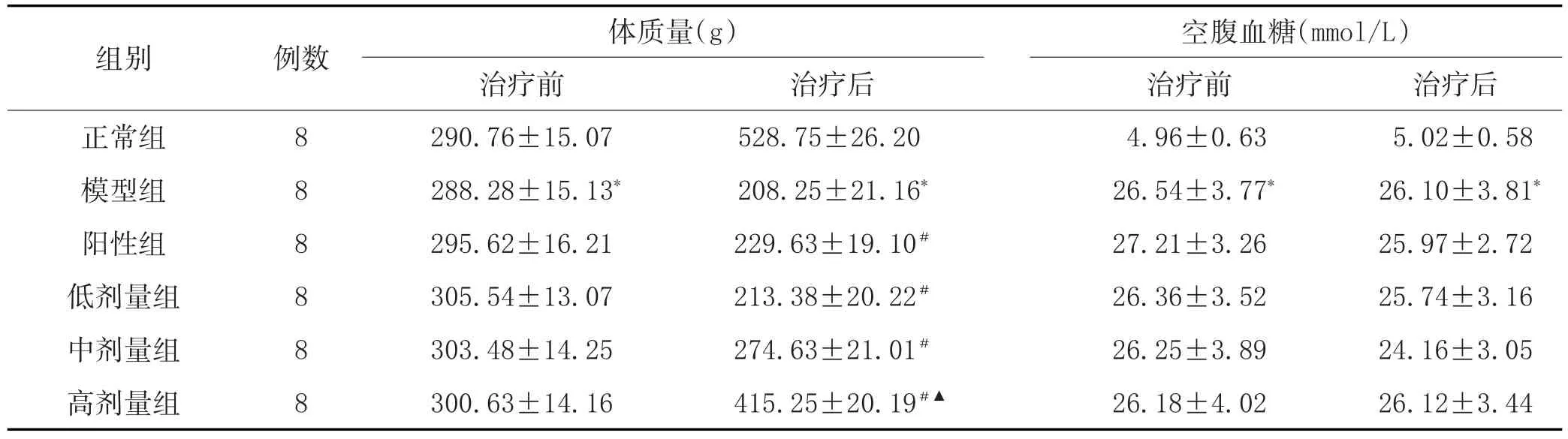
表1 各组大鼠体质量、血糖变化的比较(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与阳性组比较,▲P<0.05。
组别正常组模型组阳性组低剂量组中剂量组高剂量组例数88888 8体质量(g)治疗前290.76±15.07 288.28±15.13*295.62±16.21 305.54±13.07 303.48±14.25 300.63±14.16治疗后528.75±26.20 208.25±21.16*229.63±19.10#213.38±20.22#274.63±21.01#415.25±20.19#▲空腹血糖(mmol/L)治疗前4.96±0.63 26.54±3.77*27.21±3.26 26.36±3.52 26.25±3.89 26.18±4.02治疗后5.02±0.58 26.10±3.81*25.97±2.72 25.74±3.16 24.16±3.05 26.12±3.44
3.2 免疫组化及氧化应激指标测定:见图1。
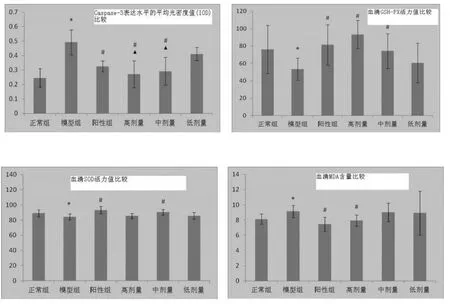
图1 各组免疫组化及氧化应激指标比较
3.3 各组大鼠坐骨神经超微结构影响:正常组:神经膜细胞(SC)清晰可见,排列整齐,层次分明,电子密度比较一致。轴索(A)完整,线粒体结构正常。模型组:髓鞘发生折叠起皱(↑),轴索膜与髓鞘板层分离(↑),轴索变小,失去与髓鞘的正常比例,线粒体肿胀变性,出现溶解破碎。阳性组:髓鞘较薄系再生表现(↑),部分髓鞘尚未完全长成。低剂量组:髓鞘断裂(↑),部分髓鞘折叠起皱。中剂量组:髓鞘板层疏松呈不规则的膜样团块,轴索肿胀或萎缩(↑),并有空泡。高剂量组:轴索部分脱落(↑),神经纤维和神经膜细胞内的线粒体肿胀。
4 讨论
DPN是糖尿病主要的慢性并发症,其发病机制目前尚未完全明了。Brownleen[2]提出的统一机制学说认为,经典的糖尿病并发症的多元醇途径、糖基化终产物(AGES)途径、蛋白激酶C(PKC)途径和氨基己糖途径均是高糖条件下线粒体呼吸链中氧自由基生成过多导致的结果。一方面,氧化应激反应可直接引发单链DNA的断裂,或通过JNK、P38信号转导通路诱导雪旺细胞中一系列半胱天冬酶激活,介导细胞凋亡的发生,其中Caspase-3在死亡受体和线粒体介导的经典细胞凋亡途径中均起着核心作用。另一方面,氧自由基可攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并因此形成脂质过氧化产物,其最终产物为MDA。大量研究证实,超氧化物阴离子的过量产生导致的氧化应激可损伤糖尿病动物的神经和血管组织的DNA、脂质及蛋白质,导致神经传导速度下降,产生DPN。
中医学中无DPN确切病名,《王旭高医案》云:“消渴日久,但见手足麻木,制冷如冰。”症状描述和DPN相似[3],可将其归属为“痹症”“血痹”“痿证”等范畴。柴师有着多年的临床实践,认为DPN多见于久病不愈的患者,多由于消渴日久,气血不足,脾运无力,痰瘀内生,伤及络脉所致,属本虚标实证,认为若单从一方面论治很难达到治病求本、标本兼顾的效果。故在治疗上培补脾气以滋气血生化之源,祛痰通络以化瘀阻络脉之标,运脾和络方具有益气化湿运脾、消痰化瘀和络之效,标本双顾对临床治疗有一定的指导意义。
从本实验结果上看,运脾和络方能够抑制大鼠坐骨神经Caspase-3的蛋白的表达,降低血清MDA含量,提高SOD、GSH-PX活性。通过电镜超微结构图可以看出运脾和络方对大鼠坐骨神经具有一定的保护作用,可能与减轻糖尿病大鼠的氧化应激,清除氧自由基、抗氧化,改善微循环,抑制轴索萎缩变性,减少神经细胞凋亡有关,仍有待进一步研究证实。
[1]柴可夫,沈祥峰.运脾和络颗粒对糖尿病周围神经病变大鼠坐骨神经髓鞘碱性蛋白的影响[J].中华中医药杂志,2013,28(7):1967-1970.
[2]Brownlee M.The pathobiology of diabetic compl ications a uni fying mechanism[J].Diabetes,2005,54(6): 1615-1625.
[3]龚腾芬,陈霞波.自拟益气养血通络方治疗糖尿病周围神经病变32例临床观察[J].浙江中医杂志,2016,51(1):39-40.
2016-11-22
教育部科技发展中心2013年高等学校博士学科点专项科研基金联合资助项目运脾和络法调控线粒体分裂蛋白1(Drp-1)介导的氧化应激和细胞凋亡防治糖尿病周围神经病变,编号:20133322110002
# 通讯作者:柴可夫,E-mai l:ckf666@163.com

