FK506结合蛋白5在肝细胞癌中的表达及其临床意义
闫亭亭,龙晨,蔡文武,王继龙
(1. 中南大学湘雅公共卫生学院,湖南 长沙410008;2. 中南大学湘雅二医院 普通外科,湖南 长沙410011)
肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的主要类型[1],其发病率和病死率分别位居全球恶性肿瘤的第5位和第2位[2-3]。手术切除和肝移植是早期肝癌目前最常见的根治手段[4-5]。但由于术后较高的复发率和转移率,HCC患者预后依然较差[6],术后5年生存率只有24%~50%,甚至更低[7-9]。因此,寻找能够用于预后预测和治疗的分子标志物依然是当前HCC研究的热点和难点。
FK506结合蛋白5(FK506 binding protein 5,FKBP5),又称FKBP51(FK506 binding protein 51),是亲免素蛋白家族成员之一[10],具有调节多种生物学过程的作用,如免疫调节、类固醇激素受体活化、细胞生存、蛋白质合成、折叠和运输等[11]。近年来研究发现,FKBP5在肿瘤发生发展过程中也起着重要作用[12]。FKBP5在黑色素细胞瘤[13]、前列腺癌[14-15]、食管腺癌[16]、神经胶质瘤[17]等肿瘤组织中呈高表达,且与细胞侵袭、转移及肿瘤耐药等密切相关。但也有文献[18]显示FKBP5在胰腺癌组织中呈低表达。这提示FKBP5在不同肿瘤中的表达具有组织特异性。目前,尚无文献报道FKBP5在HCC组织中的表达情况。本研究拟采用qRT-PCR、Western blot和免疫组织化学方法,检测FKBP5在HCC组织中的表达情况,并分析其与HCC患者临床病理特征及预后的关系,为正确评估HCC生物学行为和预后提供有用指标。
1 材料与方法
1.1 临床标本
随机选取中南大学湘雅二医院2009年5月—2011年1月期间接受手术切除的HCC患者的石蜡标本107例,包括HCC组织及相应癌旁组织,且经病理学检查确诊。所有患者均具有完整的临床病理资料(表1),术前未进行放、化疗等辅助治疗。随访的方式主要采取定期复查及电话随访,随访截止于2015年10月,中位随访时间为35(2.0~75.0)个月。另收集30对HCC及相应的癌旁非肿瘤肝组织(距肿瘤>2cm)新鲜标本,在手术切除后立即取样,分别装入冻存管中,迅速冷冻于液氮并于-80℃冰箱中保存。本研究由中南大学湘雅二医院伦理委员会审核批准,并经过研究对象或其家属知情同意。
1.2 试剂
RNA提取试剂TRIzol购自美国Invitrogen公司,qRT-PCR反应试剂盒购自TaKaRa生物技术公司,引物合成由上海生工生物公司完成,FKBP5引物序列上游:TTT GAC TGC AGA GAT GTG GC,下游:CCT GCC TCT CCA AAA CCA TA;内参GAPDH引物序列上游:GTC TCC TCT GAC TTC AAC AGC G,下游:ACC ACC CTG TTG CTG TAG CCA A。RIPA裂解液购自北京康为世纪生物公司,BCA蛋白定量分析试剂盒购自美国Thermo Scientific公司,PVDF膜购自美国Milipore公司,ECL试剂盒购自江苏碧云天公司。FKBP5一抗为兔抗人多克隆抗体(Santa Cruz),WB工作液浓度1:100,IHC工作液浓度1:50。β-actin一抗为鼠抗人单克隆抗体(Sigma),WB工作液浓度1:1 000。免疫组织化学二步法检测试剂盒(PV-9000)、进口山羊血清工作液和DAB显色试剂盒均购自北京中杉金桥生物公司。
1.3 方法
1.3.1qRT-PCR 取新鲜组织50 mg,采用TRIzol法抽提总RNA,按照Takara试剂盒逆转录成cDNA。在7300 Real Time PCR System(美国Applied Biosystems公司)上进行荧光实时定量PCR,设置好反应条件后启动PCR反应,具体条件为95 ℃预变性10 min;95 ℃变性15 s,60 ℃延伸60 s,共40个循环。每个样本设3个复孔,分别记录FKBP5和GAPDH的Ct(Cycle threshold)值,以GAPDH为内参,采用2-△△Ct法计算FKBP5在HCC组织中的相对表达水平。
1.3.2蛋白质提取和Western blot检测 研磨好的新鲜HCC及癌旁组织用RIPA裂解液提取组织总蛋白,BCA法检测蛋白浓度。蛋白样品混合上样缓冲液后100 ℃变性10 min,取50 μg总蛋白上样,以10%SDS-PAGE胶电泳分离后经电转移槽湿转法转到PVDF膜上;5%脱脂奶粉封闭30 min;PBST漂洗3次后将PVDF膜置入FKBP5或β-actin一抗,4 ℃过夜;PBST洗膜10 min×3次,置入1:10 000稀释的HRP标记的相应二抗(中杉金桥生物公司)室温孵育30 min,再次PBST洗涤后ECL化学发光法显影、定影,曝光摄片。以β-actin为内参。
1.3.3免疫组织化学染色及结果判定 4 μm厚的石蜡组织切片于65 ℃下烤片30 min,二甲苯脱蜡15 min×2次,梯度乙醇水化,抗原修复,生物标记笔进行组织圈定后滴加3%过氧化氢溶液灭活内源性过氧化物酶活性,PBS浸泡3min×3次;山羊封闭血清室温封闭30 min,加一抗工作液4 ℃过夜;PBS浸泡3 min×3次,滴加即用型二抗,室温孵育1 h;PBS浸泡3 min×3次,DAB显色,复染,脱水,透明,封片,最后将切片置于显微镜下观察并拍照。用PBS代替一抗作为阴性对照。结果判定:采用双盲法阅片,每张切片选取5个高倍镜视野,根据细胞核阳性显色百分比进行评分[19]。<5%细胞核显色为0分;5%~30%细胞核显色为1分;31%~50%细胞核显色为2分;>50细胞核显色为3分。其中,0~1分定义为低表达,2~3分定义为高表达。
1.4 统计学处理
采用SPSS 19.0软件进行统计分析。两个样本均数比较采用独立样本t检验,FKBP5蛋白表达与临床病理特征的关系采用χ2检验,生存分析采用Kaplan-Meier法和log-rank检验,单因素及多因素生存分析采用Cox比例风险回归模型,P<0.05为差异有统计学意义。
2 结 果
2.1 FKBP5在HCC组织和癌旁组织中的表达
采用qRT-PCR法检测30例HCC及相应癌旁组织中FKBP5 mRNA表达水平,结果显示,与癌旁组织比较,FKBP5 mRNA在26例HCC组织中呈高表达,占86.7%(26/30)(图1A)。与qRT-PCR结果相似,Western blot结果表明FKBP5蛋白在HCC组织中的表达明显高于相应癌旁组织,典型的Western blot图片见图1B。
为进一步明确FKBP5蛋白在HCC组织中的表达情况,采用免疫组化法检测107例HCC及相应癌旁组织石蜡切片中FKBP5蛋白的表达水平。FKBP5蛋白主要定位于细胞核,且与癌旁组织相比,FKBP5在HCC组织中表达明显增高(图1C-D)。FKBP5蛋白在86.0%(92/107)的HCC组织中有表达,根据免疫组化结果评分标准,将HCC组织标本分为FKBP5高表达组和低表达组。其中高表达组占63.6%(68/107),低表达组占36.4%(39/107);而癌旁组织中FKBP5高表达者仅有30例(28.0%),其高表达率明显低于HCC组织(P<0.001)(图1E)。
2.2 FKBP5蛋白表达与HCC患者临床病理特征的关系
分析FKBP5蛋白表达水平与107例HCC患者临床病理特征的关系,结果显示,FKBP5表达水平与肿瘤大小(P=0.009)、数量(P=0.018)、微血管侵犯(P=0.020)、TNM分期(P=0.009)以及BCLC分期(P=0.024)有关,而与患者性别、年龄、AFP、HBsAg、肝硬化、包膜、Edmondson-Steiner分级等无关(均P>0.05)(表1)。
2.3 FKBP5表达与HCC患者预后的关系

图1 FKBP5在HCC及癌旁组织中的表达检测 A:qRT-PCR检测FKBP5 mRNA表达;B:Western blot检测FKBP5蛋白表达;C:FKBP5在HCC及癌旁组织中的免疫组化染色;D:FKBP5不同表达强度的HCC组织;E:FKBP5在107例HCC及相应癌旁组织中的表达差异比较Figure 1 Determination of FKBP5 expression in HCC tissues and adjacent non-tumorous tissues A: FKBP5 mRNA expression quantified by qRT-PCR; B: FKBP5 protein expression detected Western blot analysis; C: Immunohistochemical staining for FKBP5 expression in HCC and adjacent non-tumorous tissues; D: HCC tissues with different FKBP5 expression levels; E: Comparison of FKBP5 expression levels between HCC tissue and adjacent tissue non-tumorous tissues
采用Kaplan-Meier生存分析探讨FKBP5表达水平与HCC患者预后的关系,结果显示FKBP5高表达及低表达患者的中位生存时间分别为22.0、48.1个月,FKBP5高表达患者1、3、5年总体生存率分别为67.1%、32.0%、14.4%,明显低于FKBP5低表达患者(89.6%、63.3%、40.7%),差异具有统计学意义(P<0.001)(图2A)。而FKBP5高表达及低表达患者的中位无瘤生存时间分别为15.7 和38.0个月,且FKBP5高表达患者1、3、5年无瘤生存率亦明显低于FKBP5低表达患者(57.6% vs. 76.9%、23.1% vs.51.4%、9.5%vs.32.7%,P<0.001)(图2B)。
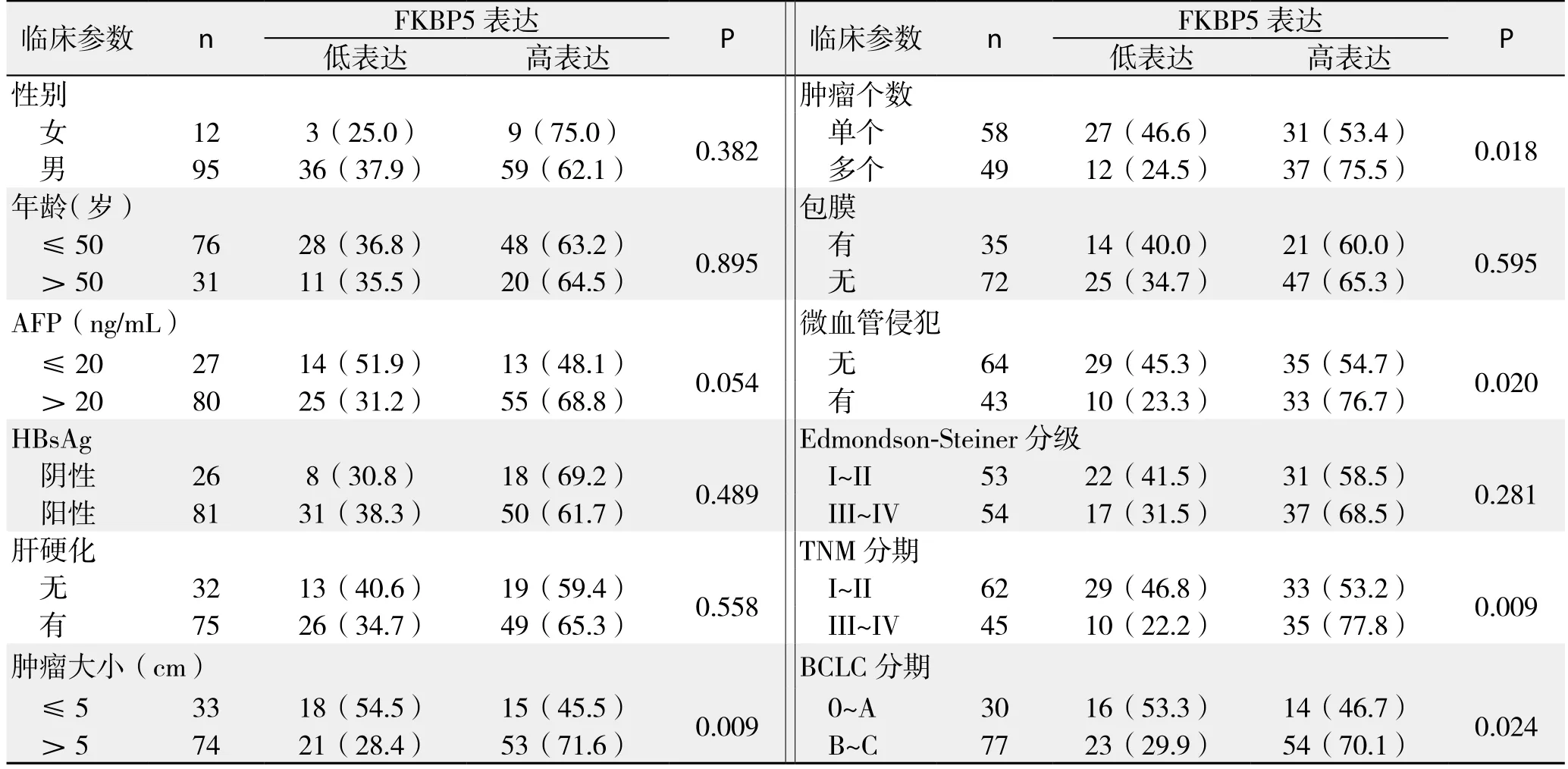
表1 FKBP5表达水平与HCC患者临床病理特征的关系[n(%)]Table 1 Relations of FKBP5 expression with clinicopathologic characteristics of HCC patients [n (%)]

图2 FKBP5不同表达水平的HCC患者生存情况比较 A:总体生存曲线;B:无瘤生存曲线Figure 2 Comparison of survival conditions between HCC patients with different FKBP5 expression levels A: Overall survival curves; B: Disease-free survival curves
2.4 FKBP5高表达是HCC患者总体生存和无瘤生存的独立危险因素
利用Cox比例风险模型进行单、多因素分析,结果显示FKBP5高表达的HCC患者死亡(HR=1.992,95% CI=1.127~3.522,P=0.018)或复发(HR=1.787,95% CI=1.067~2.992,P=0.027)风险明显高于FKBP5低表达患者;且FKBP5高表达与肝硬化、肿瘤个数、微血管侵犯既是HCC患者总体生存的独立危险因素,也是术后无瘤生存的独立危险因素(均P<0.05)(表2)。
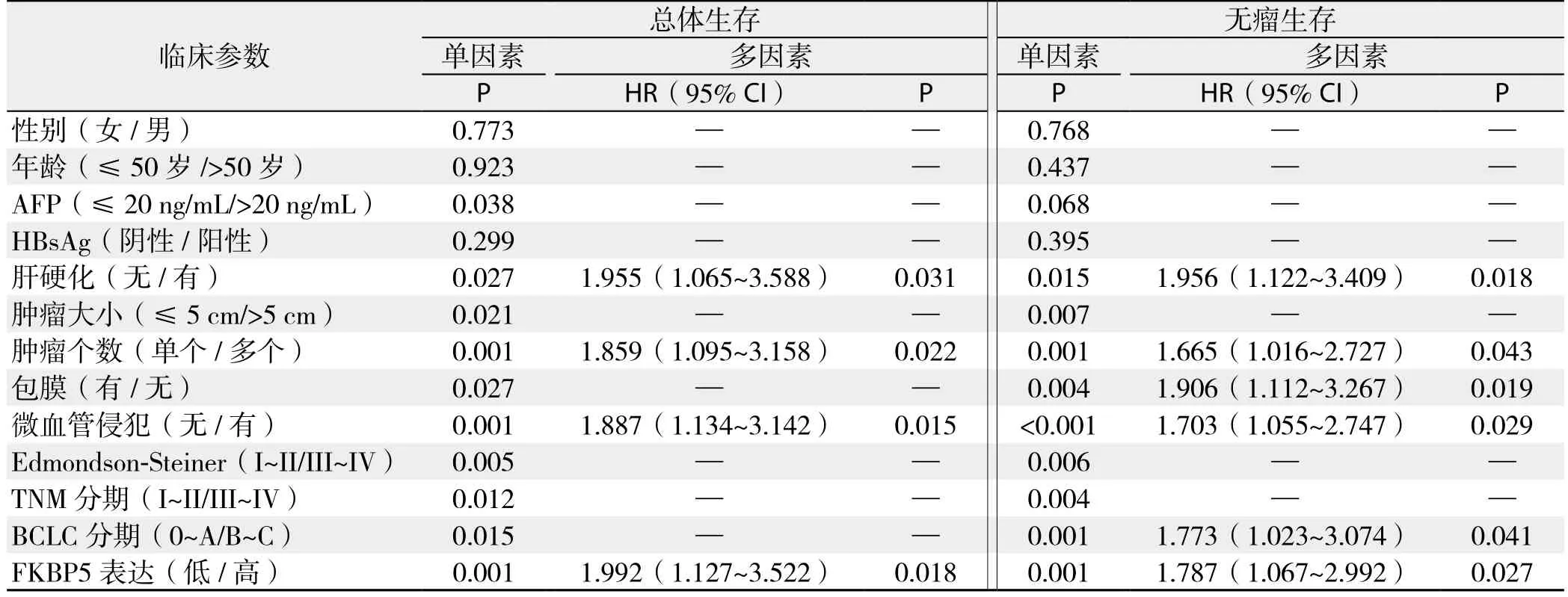
表2 HCC患者总体生存和无瘤生存的影响因素分析Table 2 Analysis of influential factors for overall survival and disease-free survival of HCC patients
3 讨 论
FKBP5是一个大小为51 kDa的FK506结合蛋白,属于亲免素家族,参与调节多种生理和病理过程。近年来,其在肿瘤发生发展过程中的作用日益受到关注。FKBP5在前列腺癌中能够调节雄激素受体活性,进而促进前列腺癌发生发展[14]。在黑色素细胞瘤中,FKBP5呈高表达,且与细胞生存、化疗耐药密切相关[20-21]。同时,FKBP5能够激活EMT相关基因,维持黑色素瘤细胞干性特征,促进肿瘤细胞血管生成和转移[13,22]。Jiang等[17]研究发现FKBP5在神经胶质瘤中表达上调,且与肿瘤分级及预后密切相关,并且FKBP5可通过激活NF-κB通路促进胶质瘤细胞增殖和化疗耐药。此外,食管癌中FKBP5亦呈高表达,且提示患者预后较差[16]。以上研究结果均提示FKBP5是一个癌基因。但Pei等[18]发现FKBP5在胰腺癌标本中表达下调,并导致Akt磷酸化增加,从而降低基因毒应激导致的细胞死亡。在胰腺癌移植瘤模型中敲除FKBP5可促进肿瘤生长,增强肿瘤细胞对吉西他滨的耐药性[23]。然而,目前FKBP5在HCC中的表达情况及临床意义尚不清楚。
本研究首先采用qRT-PCR法检测30例新鲜HCC标本及相应癌旁组织中FKBP5 mRNA表达水平,结果发现HCC组织中FKBP5 mRNA表达水平较配对癌旁组织明显上调。随后Western blot结果亦证实,与癌旁组织相比,HCC组织中FKBP5蛋白表达水平显著增高。进一步采用免疫组织化学法检测发现, FKBP5蛋白主要定位于细胞核,其在HCC组织中的染色强度明显增高。这些研究结果表明FKBP5在HCC组织中表达上调,提示其可能参与HCC的发生发展过程,并发挥促癌作用。这与FKBP5在黑色素瘤、前列腺癌、食管腺癌、神经胶质瘤中的研究结果相吻合[13-17]。
为明确FKBP5在HCC中的临床意义,进一步分析了FKBP5表达水平与HCC患者临床病理特征的关系。结果显示,FKBP5高表达与肿瘤大小、个数、微血管侵犯、TNM分期及BCLC分期均有关(均P<0.05),而与患者性别、年龄、AFP、HBsAg、肝硬化、包膜、Edmondson-Steiner分级等无关(均P>0.05)。既往研究[17,20]显示,FKBP5具有抑制肿瘤细胞凋亡、促进增殖的作用。而本研究发现FKBP5高表达与肿瘤大小密切相关,肿瘤直径≤5cm组FKBP5高表达所占比例显著高于肿瘤直径(71.6% vs.45.5%,P=0.009),间接表明FKBP5可能具有促进HCC细胞增殖的作用。肿瘤个数、微血管侵犯、TNM分期和BCLC分期在一定程度上可反映肿瘤的侵袭转移潜能[3,24],FKBP5与以上临床病理特征具有显著相关性,提示FKBP5具有促进HCC细胞侵袭转移的作用。这与Romano等[13,22]在黑色素瘤中发现FKBP5具有促进黑色素瘤细胞侵袭转移的作用相一致,但FKBP5在HCC细胞中的具体生物学作用尚需相关功能实验验证。
本研究重要的发现还包括FKBP5对HCC患者预后的预测价值。Kaplan-Meier法分析显示FKBP5高表达患者的总体生存率和无瘤生存率较低表达FKBP5患者显著降低。Cox回归单因素分析表明FKBP5表达水平与患者总体生存和无瘤生存密切有关。多因素分析进一步证实FKBP5高表达是HCC患者术后总体生存和无瘤生存的独立危险因素。这与Smith等[16]在食管腺癌中的研究结果具有相似性。基于以上结果,FKBP5的表达水平可用作预测HCC患者预后的分子标志物,FKBP5高表达提示患者的预后较差,术后复发风险高。
综上所述,本研究首次证实FKBP5在HCC组织中表达上调,且与HCC患者临床病理特征及不良预后显著相关,提示FKBP5在HCC的发生发展过程中发挥重要作用,可作为HCC患者预后的独立预测指标。后续细胞学和分子生物学研究将有助于揭开FKBP5促进HCC进展的具体作用及机制。
[1] 陶一明,冯铁诚,王志明. 原发性肝癌患者TNM分期与术后生存关系: SEER数据库分析[J]. 中国普通外科杂志,2016,25(7):952-956. doi: 10.3978/j.issn.1005-6947.2016.07.004.Tao YM, Feng TC, Wang ZM. Association of TNM stage with postoperative survival in patients with primary liver cancer: an analysis of SEER database[J]. Chinese Journal of General Surgery,2016, 25(7):952-956. doi: 10.3978/j.issn.1005-6947.2016.07.004.
[2] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J].CA Cancer J Clin, 2015, 65(2):87-108. doi: 10.3322/caac.21262.
[3] 汪晋, 马金良. 肝癌预后相关影响因素[J]. 中国普通外科杂志,2015, 24(2):270-274. doi: 10.3978/j.issn.1005-6947.2015.02.022 Wang J, Ma JL. Prognostic factors in liver cancer[J]. Chinese Journal of General Surgery, 2015, 24(2):270-274. doi: 10.3978/j.issn.1005-6947.2015.02.022
[4] Konstantinidis IT, Fong Y. 肝癌在当今时代: 移植、消融、开放手术或微创手术?——多学科的个性化决定[J]. 中国普通外科杂志,2015, 24(7):920-927. doi: 10.3978/j.issn.1005-6947.2015.07.002.Konstantinidis IT, Fong Y. Hepatocellular carcinoma in the modern era: transplantation, ablation, open surgery or minimally invasive surgery?—A multidisciplinary personalized decision[J]. Chinese Journal of General Surgery, 2015, 24(7):920-927. doi: 10.3978/j.issn.1005-6947.2015.07.002.
[5] De Minicis S, Marzioni M, Benedetti A, 等. 肝细胞癌的新见解: 从实验到临床[J]. 中国普通外科杂志, 2015, 24(1):1-9. doi:10.3978/j.issn.1005-6947.2015.01.001.De Minicis S, Marzioni M, Benedetti A, et al. New insights in hepatocellular carcinoma: from bench to bedside[J]. Chinese Journal of General Surgery, 2015, 24(1):1-9. doi:10.3978/j.issn.1005-6947.2015.01.001.
[6] 梁治坤, 程凡天, 胡走肖, 等. miR-150-5p抑制肝癌细胞的迁移和侵袭及其机制[J]. 中国普通外科杂志, 2016, 25(8):1175-1179. doi:10.3978/j.issn.1005-6947.2016.08.015.Liang ZK, Cheng FT, Hu ZX, et al. Inhibitory effect of miR-150-5p on migration and invasion of hepatocellular carcinoma cells and its mechanism[J]. Chinese Journal of General Surgery, 2016,25(8):1175-1179. doi: 10.3978/j.issn.1005-6947.2016.08.015.
[7] Tung-Ping Poon R, Fan ST, Wong J. Risk factors, prevention,and management of postoperative recurrence after resection of hepatocellular carcinoma[J]. Ann Surg, 2000, 232(1):10-24.
[8] Forner A, Llovet J M, Bruix J. Hepatocellular carcinoma[J]. Lancet,2012, 379(9822):1245-1255. doi: 10.1016/S0140-6736(11)61347-0.
[9] 周俭, 肖永胜. 肝癌的转化医学研究——从基础到临床[J]. 中国普通外科杂志, 2016, 25(1):1-5. doi: 10.3978/j.issn.1005-6947.2016.01.001.Zhou J, Xiao YS. Translational medical research of hepatocellular carcinoma: from bench to bedside[J]. Chinese Journal of General Surgery, 2016, 25(1):1-5. doi: 10.3978/j.issn.1005-6947.2016.01.001.
[10] Baughman G, Wiederrecht GJ, Campbell NF, et al. FKBP51, a novel T-cell-specific immunophilin capable of calcineurin inhibition[J].Mol Cell Biol, 1995, 15(8):4395-4402.
[11] Storer CL, Dickey CA, Galigniana MD, et al. FKBP51 and FKBP52 in signaling and disease[J]. Trends Endocrinol Metab, 2011,22(12):481-490. doi: 10.1016/j.tem.2011.08.001.
[12] Romano S, Sorrentino A, Di Pace AL, et al. The emerging role of large immunophilin FK506 binding protein 51 in cancer[J]. Curr Med Chem, 2011, 18(35):5424-5429.
[13] Romano S, Staibano S, Greco A, et al. FK506 binding protein 51 positively regulates melanoma stemness and metastatic potential[J].Cell Death Dis, 2013, 4:e578. doi: 10.1038/cddis.2013.109.
[14] Periyasamy S, Hinds T Jr, Shemshedini L, et al. FKBP51 and Cyp40 are positive regulators of androgen-dependent prostate cancer cell growth and the targets of FK506 and cyclosporin A[J]. Oncogene,2010, 29(11):1691-1701. doi: 10.1038/onc.2009.458.
[15] Romano S, D'Angelillo A, Staibano S, et al. FK506-binding protein 51 is a possible novel tumoral marker[J]. Cell Death Dis, 2010,1:e55. doi: 10.1038/cddis.2010.32.
[16] Smith E, Palethorpe HM, Ruszkiewicz AR, et al. Androgen Receptor and Androgen-Responsive Gene FKBP5 Are Independent Prognostic Indicators for Esophageal Adenocarcinoma[J]. Dig Dis Sci, 2016, 61(2):433-443.
[17] Jiang W, Cazacu S, Xiang C, et al. FK506 binding protein mediates glioma cell growth and sensitivity to rapamycin treatment by regulating NF-kappaB signaling pathway[J]. Neoplasia, 2008,10(3):235-243.
[18] Pei H, Li L, Fridley BL, et al. FKBP51 affects cancer cell response to chemotherapy by negatively regulating Akt[J]. Cancer Cell, 2009,16(3):259-266. doi: 10.1016/j.ccr.2009.07.016.
[19] Yong KJ, Gao C, Lim JS, et al. Oncofetal gene SALL4 in aggressive hepatocellular carcinoma[J]. N Engl J Med, 2013, 368(24):2266-2276. doi: 10.1056/NEJMoa1300297.
[20] Romano S, D'Angelillo A, Pacelli R, et al. Role of FK506-binding protein 51 in the control of apoptosis of irradiated melanoma cells[J]. Cell Death Differ, 2010, 17(1):145-157. doi: 10.1038/cdd.2009.115.
[21] Romano S, Mallardo M, Romano MF. FKBP51 and the NF-kappaB regulatory pathway in cancer[J]. Curr Opin Pharmacol, 2011,11(4):288-293. doi: 10.1016/j.coph.2011.04.011.
[22] Srivastava SK, Bhardwaj A, Arora S, et al. Interleukin-8 is a key mediator of FKBP51-induced melanoma growth, angiogenesis and metastasis[J]. Br J Cancer, 2015, 112(11):1772-1781. doi: 10.1038/bjc.2015.154.
[23] Hou J, Wang L. FKBP5 as a selection biomarker for gemcitabine and Akt inhibitors in treatment of pancreatic cancer[J]. PLoS One,2012, 7(5):e36252. doi: 10.1371/journal.pone.0036252.
[24] Bruix J, Llovet JM. Prognostic prediction and treatment strategy in hepatocellular carcinoma[J]. Hepatology, 2002, 35(3):519-524.

