Notch3/Hes1在沙鼠非酒精性脂肪性肝纤维化形成中的变化
陈曦 严茂祥 蔡月琴 叶蕾 陈芝芸
浙江中医药大学附属第一医院 杭州 310006
Notch3/Hes1在沙鼠非酒精性脂肪性肝纤维化形成中的变化
陈曦 严茂祥 蔡月琴 叶蕾 陈芝芸
浙江中医药大学附属第一医院 杭州 310006
[目的]研究沙鼠非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)进展过程中Notch3/Hes1表达的动态变化,探讨其在脂肪性肝纤维化形成中的作用。[方法]长爪沙鼠48只,随机分为正常组和模型组,每组24只,正常组以普通饲料喂养,模型组以高脂饲料喂养,两组分别于实验第4、8、16周末各处理沙鼠8只,HE和Masson染色光镜观察肝组织病理,组织芯片免疫组化法检测肝组织Notch3、Hes1、α-SMA表达。[结果]和正常组比较,随着高脂饮食时间增加,模型组沙鼠肝组织逐渐出现脂肪变、炎症、纤维化甚至是肝硬化;正常组沙鼠肝组织仅少量Notch3、Hes1、α-SMA表达,模型组沙鼠肝组织Notch3、Hes1、α-SMA表达与同期正常组相比表达水平明显增加(P<0.05、P<0.01),第8周、16周时较第4周模型组增加明显(P<0.05、P<0.01);Notch3、Hes1蛋白表达水平与α-SMA蛋白表达呈现明显正相关(r=0.873和0.786,P<0.01)。[结论]Notch/Hes信号在沙鼠非酒精性脂肪性纤维化形成中活性增强,可能参与高脂诱导的非酒精性脂肪性肝纤维化的形成。
NAFLD;肝星状细胞;纤维化;Notch信号通路;组织芯片
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是目前临床上最常见的肝病之一,包括单纯性脂肪肝、脂肪性肝炎和脂肪性肝纤维化等[1]。单纯性脂肪肝预后良好,而脂肪性肝炎、肝纤维化则可能演变成肝硬化和肝癌。导致单纯性脂肪肝进展为脂肪性肝炎、肝纤维化的机制目前仍末明了,探讨NAFLD的发病机制,尤其是阐明脂肪性肝炎和肝纤维化发生的潜在机制并阻断其进展对该病的防治具有重要的意义。研究表明,肝损伤-炎症-修复过程导致肝星状细胞(hepatic stellate cell,HSC)的活化,促使α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)显著增加,引起细胞外基质(extracellular matrix,ECM)的合成与降解失调,是肝纤维化形成的关键[2-3]。在肝纤维化的发生发展中,多条信号通路被激活,Notch通路是其中重要的一条,参与肝内胆汁淤积性肝纤维化、慢乙肝肝纤维化、CCl4肝纤维化等的发生发展[4-6];但其是否参与非酒精性脂肪性肝纤维化的形成目前未见报道。项目组前期研究发现,高脂可诱导沙鼠形成明显的肝纤维化,其病理生理过程与人类NAFLD相似[7],本实验观察高脂诱导的沙鼠非酒精性脂肪性肝纤维化形成过程中Notch3/Hes1表达的变化,探讨Notch通路在非酒精性脂肪性肝纤维化形成中的作用。
1 材料与方法
1.1 实验动物 成年雄性Z:ZCLA长爪沙鼠48只,体质量(50±100)g,清洁级,购自浙江省医科院实验动物中心,合格证号:SCXK(浙)2014-0001,饲养于浙江中医药大学动物实验研究中心屏障环境中,合格证号:SYXK(浙)2013-0184。动物适应性喂养1周后进行实验。
1.2 主要试剂 胆固醇购于上海伯奥生物有限公司,批号:131101;3号胆盐购于杭州微生物试剂有限公司,批号:20140121。高脂饲料(由3号胆盐、胆固醇、猪油、蛋黄粉及普通饲料按1:4:14:20:161比例配制)及普通饲料均浙江省医学科学院实验动物中心制备。苏木素购于sigma进口分装,批号:2101621;伊红购于上海三爱式剂有限公司,批号:20100808;Masson染色试剂盒购于福州迈新生物技术有限公司,批号:20131217;Notch3多克隆抗体购于美国SantaCruz公司,批号:H1308;Hes1单克隆抗体购于美国SantaCruz公司,批号:F1406;α-SMA多克隆抗体购于北京博奥森生物技术有限公司,批号:201411;Envision免疫组化检测试剂盒购于丹麦DAKO公司,批号:14J2677A。
1.3 主要仪器 MICROM STR120组织脱水机(德国MICROM公司),MICROM HM335E石腊包埋机(德国MICROM),LeicaRM 2025病理切片机(德国Leica公司),组织芯片制备仪TM-1(北京博医康实验仪器有限公司),Leica DMLB2显微镜(德国Leica公司)。
1.4 分组及处理 沙鼠随机分为正常组及模型组2组,每组24只,正常组喂养普通饲料,模型组喂养高脂饲料,自由饮水及进食,每组分别于实验第4、8、16周末处理沙鼠8只;沙鼠处理前晚起禁食不禁水18h,次日空腹麻醉下处死,收集肝组织,于10%中性福尔马林中固定,常规制备成蜡块待用。
1.5 肝组织病理诊断 采用HE和Masson染色光镜观察,参考中华医学会肝病学分会脂肪肝和酒精性肝病学组“非酒精性脂肪性肝病诊疗指南(2010年修订版)”[8]进行肝组织脂肪变、炎症程度及纤维化程度诊断。
1.6 组织芯片制备 肝组织蜡块常规切片HE染色,显微镜下确定目标区并在腊块上做定位标记;采用半自动打孔阵列仪根据标本数量在受体蜡块上打孔,并精确排成微孔阵列;在标记蜡块上钻取定位的组织柱,按设计方案移到受体蜡块上;将设计好的蜡块放入温箱,调定温箱温度,半融状态下取出,室温冷却后放入4℃冰箱中备用;借助辅助切片胶带转移系统对组织芯片蜡块进行连续常规切片,切片厚度2~3μm。
1.7 免疫组织化学检测 采用Envision法检测肝组织芯片Notch3、Hes1、α-SMA表达。组织芯片切片常规脱蜡至水,抗原修复,3%H2O2消除内源性过氧化物酶,滴加一抗(Notch3工作浓度1:100、Hes1工作浓度1:100、α-SMA工作浓度1:200)4℃孵育过夜,Envision二抗室温孵育45min,DAB显色,苏木素复染,脱水透明后封片。结果评判如下,阳性细胞光镜下呈均匀棕黄色细颗粒状,根据阳性细胞的着色程度与着色范围进行半定量积分:着色强度即无色0分、浅黄色1分、棕黄色2分、棕褐色3分;着色范围即无阳性细胞数0分、阳性细胞数<1%为1分、阳性细胞数在1%~10%之间为2分、阳性细胞数在10%~50%之间为3分、阳性细胞数>50%为4分;着色强度与阳性细胞百分比的乘积即为该蛋白的表达量。
1.8 统计学方法 采用SPSS17.0统计软件分析统计,积分以均数±标准差(±s)表示,两组之间比较采用非参数的秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 肝组织病理 HE和Masson染色显示,正常组沙鼠肝组织结构正常;模型组沙鼠肝组织出现明显的脂肪变、炎性细胞浸润及胶原间隔形成,4周时以肝细胞脂肪变为主,少量小叶内点状坏死灶;8周时脂肪变、小叶内坏死灶、肝细胞气球样变为主,窦周少量胶原纤维沉积;16周时除脂肪变、小叶内坏死灶和肝细胞气球样变外,间质纤维沉积明显增多,胶原间隔形成。
2.2 肝组织Notch3、Hes1、α-SMA表达 沙鼠肝组织 Notch3、Hes1、α-SMA蛋白表达以细胞胞质为主,着色均为棕黄色。正常组沙鼠肝组织仅少量Notch3、Hes1、α-SMA表达,模型组沙鼠肝组织Notch3、Hes1、α-SMA均明显高于正常组,差异有统计学意义(P<0.05,P<0.01),且随高脂喂养时间增加而表达增强,差异有统计学意义(P<0.05,P<0.01)。相关性分析显示Notch3、Hes1蛋白表达水平与α-SMA蛋白表达呈现明显正相关(r=0.873和0.786,P<0.01)。见表1、图1。
表1 NAFLD沙鼠肝组织Notch3、Hes1、α-SMA动态变化(±s,n=8)Tab.1 Dynamic changes of Notch3,Hes1 and α-SMA in liver tissue of gerbils(±s,n=8)
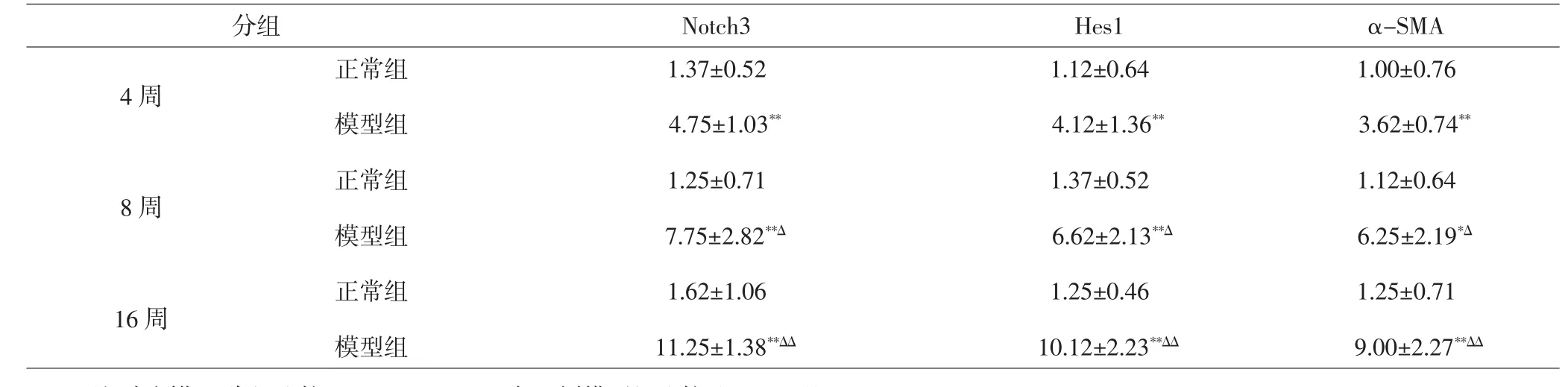
表1 NAFLD沙鼠肝组织Notch3、Hes1、α-SMA动态变化(±s,n=8)Tab.1 Dynamic changes of Notch3,Hes1 and α-SMA in liver tissue of gerbils(±s,n=8)
注:与同期正常组比较,*P<0.05,**P<0.01;与4周模型组比较,ΔP<0.05,ΔΔP<0.01。Note:*P<0.05,**P<0.01 compared with the normal group at the same time point;ΔP<0.05,ΔΔP<0.01 compared with the model group at 4 weeks.
分组 Notch3 Hes1 α-SMA 4周8周16周正常组模型组正常组模型组正常组模型组1.37±0.52 4.75±1.03**1.25±0.71 7.75±2.82**Δ1.62±1.06 11.25±1.38**ΔΔ1.12±0.64 4.12±1.36**1.37±0.52 6.62±2.13**Δ1.25±0.46 10.12±2.23**ΔΔ1.00±0.76 3.62±0.74**1.12±0.64 6.25±2.19*Δ1.25±0.71 9.00±2.27**ΔΔ
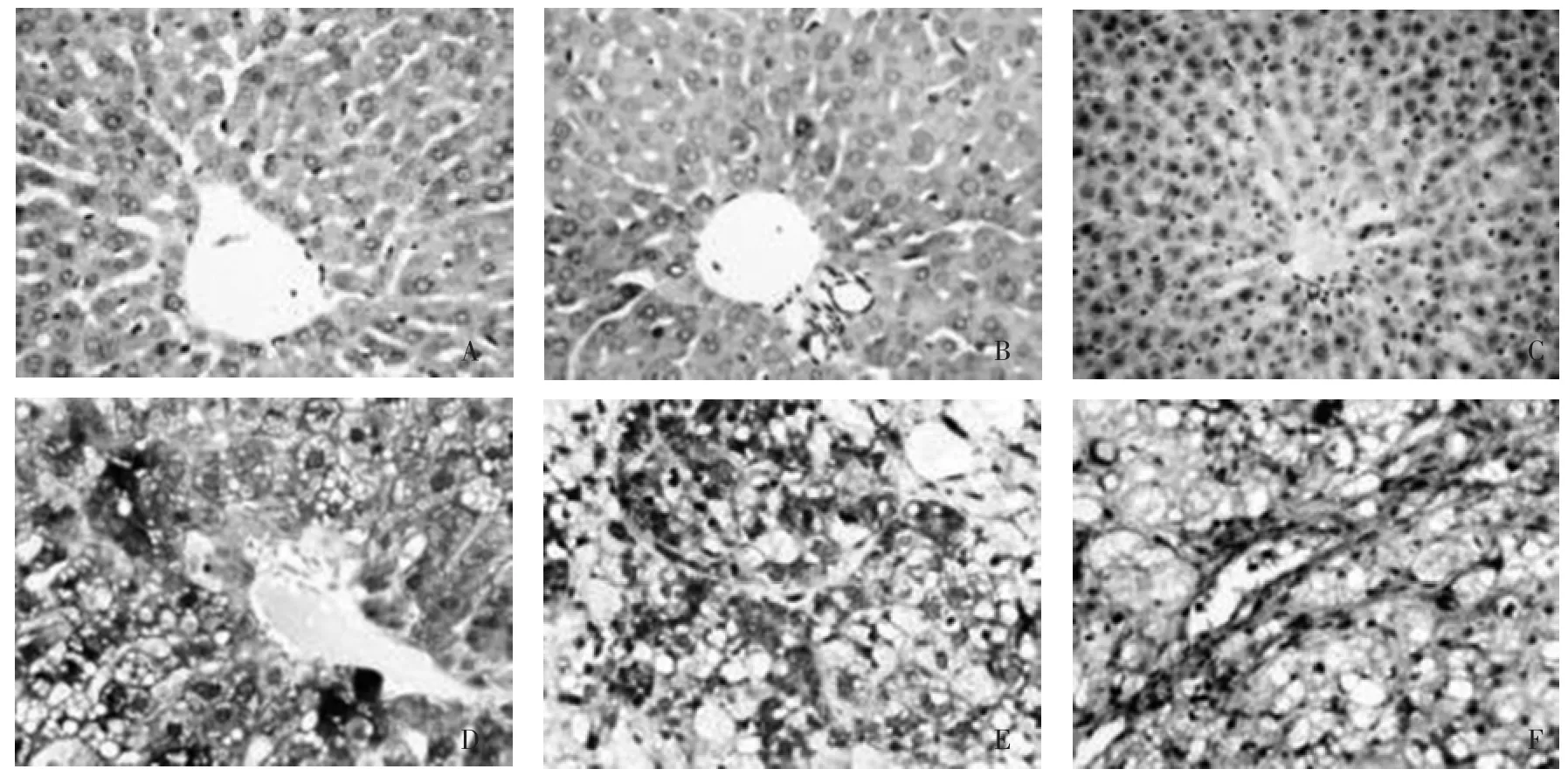
图1 沙鼠肝组织Notch3、Hes1、α-SMA表达(免疫组化,400×)Fig.1 The expression of Notch3,Hes1 and α-SMA in liver tissue of gerbils(immunehistochemical,400×)
3 讨论
Notch信号通路由Notch受体、配体、DNA结合蛋白及下游分子等构成,在进化上高度保守。哺乳动物发现有4种Notch受体,即Notch1-4,这些受体通过与配体的相互作用转导细胞信号,启动下游基因如Hes(Hesl、Hes5)家族等碱性螺旋环家族蛋白的表达,从而在细胞的增殖、分化、凋亡中发挥重要的调控作用[9-10]。研究发现异常的Notch信号通路与肝纤维化的发生和发展有关:Notch3在病变的肝组织中表达上调[11]。在HSC的培养过程中,随着HSC成长为肌成纤维细胞,Notch信号通路激活,其受体及配体表达活跃,反之抑制Notch信号则肝纤维化程度降低[12-13]。 Notch还可与转化生长因子-β、核因子-κB、WNT等多条信号通路协同调节HSC的活化,参与肝纤维化的发病机制[14]。利用基因敲除模型发现,Hes1基因的缺失可使肝脂肪变性受到抑制[14]。α-SMA蛋白是HSC活化的标志[15],在肝纤维化及其他器官纤维化的研究中发现,随着器官纤维化的加重,α-SMA蛋白表达增加。可见Notch信号通路参与肝纤维化的发病机制,对该通路的深入研究,有望为肝纤维化的研究提供新思路,也为临床治疗提供新靶点。
本研究结果发现,随着高脂饲料喂养时间的推进,沙鼠肝组织在脂肪变的基础上,炎症和纤维化逐渐加重,同时组织芯片免疫组化检测发现,沙鼠肝组织中代表HSC活化的α-SMA蛋白表达[15]逐渐增高,Notch信号通路中的关键分子Notch3、Hes1也随纤维化程度的加重而表达增强,Notch3、Hes1蛋白表达水平与α-SMA蛋白表达呈现明显正相关,提示长期高脂饮食诱导沙鼠肝组织脂肪变性,在慢性脂肪变的刺激下,Notch信号通路被激活,肝星状细胞活化,转分化为肌成纤维细胞,分泌α-SMA增加,大量细胞外基质沉积,打破纤维增生与降解之间的平衡,形成脂肪性肝纤维化。研究表明Notch3/Hes1可能参与高脂诱导的非酒精性肝纤维化的发生发展,抑制其过度表达可能为非酒精性脂肪性肝纤维化干预性治疗提供新的见解。
References:
[1]Balasubramanian P,Boopathy V,Govindasamy E,et al.Assessment of Portal Venous and Hepatic Artery Haemodynamic Variation in Non-Alcoholic Fatty Liver Disease (NAFLD)Patients[J].Clin Diagn Res,2016,10(8):7-10.
[2]YixiongChen,Shaoping Zheng,Dan Qi,et al.Inhibition of Notch Signaling by aγ-Secretase Inhibitor Attenuates Hepatic Fibrosis in Rats[J].Plos One,2012,7(10):1-11.
[3]Nevzorova YA,Hu W,Cubero FJ,et al.Overexpression of c-myc in hepatocytes promotes activation of hepatic stellate cells and facilitates the onset of liver fibrosis[J]. Biochimica et Biophysica Acta,2013,1832(10):1765-1775.
[4]Vanderpool C,Sparks EE,Huppert KA,et al.Genetic interactions between Hepatocyte Nuclear Factor-6 and Notch signaling regulate mouse intrahepatic bile ductdevelopment in vivo[J].Hepatology,2012,55(1):233-243.
[5]Bansal R,van Baarlen J,Storm G,et al.The interplay of the Notch signaling in hepatic stellate cells and macrophages determines the fate of liver fibrogenesis[J].Scientific reports, 2015,18272(5):1-12.
[6]Gao J,Xiong Y,Wang Y,et al.Hepatitis B virus X protein activates Notch signaling by its effects on Notch1 and Notch4 in human hepatocellular carcinoma[J].International Journal of Oncology,2016,48(1):329-337.
[7]俞建顺,严茂祥,王德军,等.高脂饮食对长爪沙鼠生化及主要脏器组织病理学的影响[J].中国比较医学杂志,2015,25 (4):38-43,47.
YU Jianshun,YAN Maoxiang,WANG Dejun,et al.Effect of high fat diet on the serum biochemical parameters and histopathology of main organs in Mongolian gerbils[J].Chinese Journal of Comparative Medicine,2015,25(4):38-43,47.
[8]范建高.非酒精性脂肪性肝病诊疗指南(2010年修订版)[J].胃肠病学和肝病学杂志,2010,19(6):483-487.
FAN Jiangao.Guidelines for the diagnosis and treatment of nonalcoholic fatty liver disease(Revised Edition 2010) [J].Chinese Journal of Gastroenterology and Hepatology, 2010,19(6):483-487.
[9]Kopan R,Ilagan MX.The canonical Notch signaling pathway:unfolding the activation mechanism[J].Cell,2009,137 (2):216-233.
[10]Pengpeng Bi,ShihuanKuang.Notch signaling as a novel regulator of metabolism[J].Trends Endocrinol Metab,2015, 26(5):248-255.
[11]谢俏,李汇华,徐有青,等.NOTCH信号通路在肝脏疾病中的研究进展[C].//2011年北京医学会肠外肠内营养学分会学术年会论文集.北京:北京医学会,2011:130-135.
XIE Qiao,LI Huihua,XU Youqing,et al.Research progress of NOTCH signaling pathway in liver diseases[C].//Proceedings of the 2011 Beijing Medical Association for the academic annual meeting of the society of parenteral nutrition.Beijing:Beijing Medical Association,2011:130-135.
[12]Xie G,Karaca G,Swiderska-Syn M.et al.Cross-talk between Notch and Hedgehog Regulates Hepatic Stellate Cell Fate[J].Hepatology,2013,58(5):1801-1813.
[13]Zhang QD,Xu MY,Cai XB,et al.Myofibroblastic transformation of rat hepatic stellate cells:the role of Notch signaling and epithelial-mesenchymal transition regulation[J]. European Review for Medical and Pharmacological Sciences,2015,19(21):4130-4138.
[14]张凯,艾文兵,柳长柏,等.Notch信号通路与HSC活化关系的研究进展[J].世界华人消化杂志,2013,21(33):3611-3616.
ZHANG Kai,AI Wenbing,LIU Changbai,et al.Research Progress on the relationship between Notch signaling pathway and HSC activation[J].World Chinese Journal of Digestology,2013,21(33):3611-3616.
[15]周志鹏.α-平滑肌肌动蛋白(α-SMA)在肝细胞性肝癌中表达的临床研究[D].成都:四川大学,2007:4-6.
ZHOU Zhipeng.The clinnical study of α-smooth muscle actin(α-SMA)in hepatocellular carcinoma[D].Sichuan:Sichuan University,2007:4-6.
Changes of Notch3/Hes1in Gerbils with the Formation of Nonalcoholic Fatty Liver Fibrosis
CHEN Xi,YAN Maoxiang,CAI Yueqin,et al The First Affiliated Hospital of Zhejiang Chinese Medial University,Hangzhou(310006),China
[Objective]To investigate the dynamic changes of Notch3/Hes1 signaling pathway in Mongolian gerbils with nonalcoholic fatty liver disease and explore their effect in the formation of liver fibrosis.[Methods]Forty-eight male gerbils were randomly divided into normal group and model group in average. Gerbils of the model group were fed with high fat diet while those of the normal group with normal diet.Eight gerbils in each group were killed at the end of 4w,8w and 16w,respectively.The pathological changes of the liver tissue were observed by HE and Masson staining,and the expression of Notch3,Hes1 and α-SMA in liver was detected by tissue microarray immunohistochemistry.[Results]Compared with the normal group,the gerbils fed with high fat diet developed steatosis,inflammation,fibrosis and even cirrhosis gradually.Notch3,Hes1 and α-SMA in normal group only few expressed,while compared with the corresponding period of normal group their expression in model group increased significantly(P<0.05,P<0.01).The levels at 8w and 16w were markedly increased compared with those of at 4w(P<0.05,P<0.01).The expression levels of Notch3 and Hes1 were positively correlated with the expression of α-SMA protein(R=0.786 and=0.873,respectively,P<0.01).[Conclusions]The activity of Notch/Hes signaling pathway enhances in the development of nonalcoholic fatty liver fibrosis in gerbils,suggesting that it may take part in the formation of nonalcoholic fatty liver fibrosis induced by high fat diet.
nonalcoholic fatty liver;hepatic stellate cell;fibrosis;Notch signaling pathway;tissue microarray
R331
A
1005-5509(2017)03-0175-04
10.16466/j.issn1005-5509.2017.03.001
2016-11-11)
浙江省公益性技术应用研究计划项目(2012C37088)
Fund project:Planed Program of Public Welfare and Technological Application of Zhejiang Province(2012C37088)
陈芝芸,E-mail:zhiych123@163.com

