LC-MS-MS法同时测定人血浆中阿戈美拉汀及其2种代谢产物的浓度
曹 媛
LC-MS-MS法同时测定人血浆中阿戈美拉汀及其2种代谢产物的浓度
曹 媛
目的 建立同时测定人血浆中阿戈美拉汀及其代谢产物7-去甲阿戈美拉汀和3-羟基-阿戈美拉汀浓度的方法。方法 采用LC-MS/MS法(液相色谱串联质谱)进行检测,以非那西汀为内标、Phenomenex ODS-3为色谱柱,A(0.2%甲酸铵+100%水)-B(甲醇)=30∶70为流动相进行色谱分离。采用ESI(电喷雾电离源)和MRM(多反应监测)的方式进行正电荷检测,用作定量分析的阿戈美拉汀、7-去甲-阿戈美拉汀、3-羟基-阿戈美拉汀和非那西汀的离子反应对m/z分别为244.1→185.1、230.1→171.1、260.1→201.1、180.1→110.1。结果 阿戈美拉汀、7-去甲-阿戈美拉汀、3-羟基-阿戈美拉汀分别在0.045 7~100 ng/mL、0.137 2~300 ng/mL、0.457 2~1 000 ng/mL范围内线性关系良好;最低检测限分别为0.045 7、0.137 2、0.457 2 ng/mL;所有待测样本的日内及日间精密度和准确度均符合相关生物样品分析的要求,且RSD<10%。在稳定性试验中,血浆样品在室温放置4 h、在4 ℃放置24 h、经历3 次冷冻-解冻循环及在-80 ℃中放置3个月等条件下均可保持稳定。结论 该方法具有操作简便、检测快速及灵敏性好等特点,能够用于临床相关药动学研究。
阿戈美拉汀;7-去甲阿戈美拉汀;3-羟基-阿戈美拉汀;液相色谱串联质谱法;血药浓度
0 引言
阿戈美拉汀是第一个褪黑素受体激动剂类抗抑郁药物[1-2],主要用于抗焦虑、抗抑郁、调节生物钟及调整睡眠节律等[3],对于重度抑郁症患者,阿戈美拉汀的抗抑郁效果明显优于经典抗抑郁药物氟西汀[4-5],由于该药物的不良反应较少,因此可能成为一种应用广泛的抗抑郁药物。目前,临床针对该药物及其代谢产物7-去甲-阿戈美拉汀和3-羟基-阿戈美拉汀LC-MS/MS的研究较少,对阿戈美拉汀的药代动力学研究亦不多见,而上述代谢产物同样具有较强的抗焦虑与调整睡眠等药理活性,3-羟基-阿戈美拉汀还能够抗精神失常[6],故对其药动学研究具有十分重要的意义。因此,本试验建立了同时检测阿戈美拉汀、7-去甲-阿戈美拉汀和3-羟基-阿戈美拉汀的LC-MS/MS方法,此方法的通用性较强,现报道如下。
1 材料
1.1 仪器 5415R型低温高速离心机(德国Eppendorf公司);LC-20AD型高效液相色谱仪(HPLC,日本岛津公司);Techne氮吹仪(英国Techne有限公司);API3200串联三重四极杆质谱仪(MS/MS,美国应用生物系统有限公司)。
1.2 药品及试剂 阿戈美拉汀(纯度99.7%,批号:98140302)、3-羟基-阿戈美拉汀(纯度99.4%,批号:98150104)、7-去甲-阿戈美拉汀(纯度99.1%,批号:98150317),法国Les Laboratoires Servier公司;非那西汀(中国食品药品检定研究院,纯度99.9%,批号:2015090133)作为本研究的内标;色谱甲醇(美国天地有限公司,批号:15040261)。其他试剂均为分析纯。化学结构见图1。

图1 阿戈美拉汀(A)、3-羟基-阿戈美拉汀(B)、7-去甲-阿戈
2 方法与结果
2.1 色谱条件与质谱条件 色谱条件:以Phenomenex ODS-3 (150 mm×4.6 mm,5 μm,美国Phenomenex有限公司)为色谱柱,A (0.2%甲酸铵+100%水)-B (甲醇)=30∶70为流动相,流速为0.8 mL/min,柱温为35 ℃;进样量为5 μL。进样方式为自动进样。质谱条件:电喷雾电离源(ESI),检测为正电荷模式,多反应监测(MRM)。电压:4 000 V;用于定量的阿戈美拉汀、7-去甲-阿戈美拉汀、3-羟基-阿戈美拉汀和非那西汀的离子反应对m/z分别为244.1 → 185.1、230.1 →171.1,260.1 → 201.1,180.1 → 110.1;去簇电压(DP)分别为90、50、50、70 V,入口电压(EP)分别为3.5、8、10、7 V,碰撞能量(CE)分别为10、10、15、20 eV。
2.2 对照品溶液的配制 将分析物阿戈美拉汀、7-去甲-阿戈美拉汀、3-羟基-阿戈美拉汀和内标非那西汀用甲醇配成1.0 mg/mL的储备液并保存于-80 ℃冰箱。对照品储备液的制备:取上述1.0 mg/mL的储备液,加甲醇至阿戈美拉汀质量浓度分别为1 000、333.3、111.1、37.04、12.35、4.115、1.372、0.457 2 ng/mL,7-去甲-阿戈美拉汀质量浓度分别为3 000、1 000、333.3、111.1、37.04、12.35、4.115、1.372 ng/mL,3-羟基-阿戈美拉汀质量浓度分别为10 000、3 333、1 111、370.4、123.5、41.15、13.72、4.572 ng/mL的混合储备液。内标储备液质量浓度为100 ng/mL。
2.3 血浆样品处理 精密移取200 μL人体血浆置于1.5 mL规格的离心管中,精密加入20 μL焦亚硫酸钠溶液(20 g/L)后涡旋混合30 s;再加入30 μL内标液(100 ng/mL),涡旋混合30 s;于4 ℃条件下,添加600 μL 15%的盐酸甲醇溶液,涡旋混合5 min;处理后的血浆在12 000 r/min 条件下高速离心(15 700 ×g)10 min,吸取上清液5 μL进行LC-MS/MS分析。
2.4 方法学专属性的考察 在优化之后的色谱和质谱条件下,分别得到空白血浆(图2A)、对照品血浆(图2B)和受试者血浆(图2C)的典型色谱图,见图2。阿戈美拉汀、7-去甲-阿戈美拉汀、3-羟基-阿戈美拉汀和内标非那西汀的保留时间分别为5.5、3.4、3.1、3.1 min,液质图峰形良好,血浆中存在的内源性物质不干扰阿戈美拉汀、7-去甲-阿戈美拉汀、3-羟基-阿戈美拉汀和内标的测定。
2.5 标准曲线及最低定量限(LLOQ)的考察 收集不含待测物及内标的血浆,分别配制同时含有阿戈美拉汀、7-去甲-阿戈美拉汀和3-羟基-阿戈美拉汀3种药物的对照品血浆,其中阿戈美拉汀质量浓度分别为1 000、333.3、111.1、37.04、12.35、4.115、1.372、0.457 2 ng/mL,7-去甲-阿戈美拉汀质量浓度分别为3 000、1 000、333.3、111.1、37.04、12.35、4.115及1.372 ng/mL,3-羟基-阿戈美拉汀质量浓度分别为10 000、3 333、1 111、370.4、123.5、41.15、13.72及4.572 ng/mL,并根据“2.3”项中相关方法对处理后的样品进行进样测定。
以阿戈美拉汀和内标的峰面积比值(R1)为纵坐标,以其浓度(c1)为横坐标,计算阿戈美拉汀在血浆中的标准曲线,得其直线回归方程:Y=0.118 8 X-0.000 5 (r2=0.996 2);以7-去甲-阿戈美拉汀和内标的峰面积比值(R2)为纵坐标,以其浓度(c2)为横坐标,计算7-去甲-阿戈美拉汀在血浆中的标准曲线,得其直线回归方程:Y=0.073 4 X-0.000 3 (r2=0.997 5);以3-羟基-阿戈美拉汀和内标的峰面积比值(R3)为纵坐标,以其浓度(c3)为横坐标,计算3-羟基-阿戈美拉汀在血浆中的标准曲线,得其直线回归方程:Y=0.054 3 X-0.000 7(r2=0.997 8);结果表明,阿戈美拉汀、7-去甲-阿戈美拉汀和3-羟基-阿戈美拉汀的LLOQ分别为0.457 2、1.372、4.572 ng/mL,其分别在0.045 7~100 ng/mL、0.137 2~300 ng/mL及0.457 2~1 000 ng/mL范围内线性关系良好。

注:A.空白血浆,B.空白血浆+0.045 7 μg/L阿戈美拉汀+0.137 2 μg/mL 7-去甲-阿戈美拉汀+0.457 2 μg/mL 3-羟基-阿戈美拉
2.6 精密度及准确度试验 取200 μL空白血浆,根据“2.2”项和“2.3”项方法配制成低、中、高浓度梯度的QC样品(阿戈美拉汀质量浓度分别为0.109 7、3.704、80 ng/mL,7-去甲-阿戈美拉汀质量浓度分别为0.329 2、11.11、240 ng/mL,3-羟基-阿戈美拉汀质量浓度分别为1.097、37.04、800 ng/mL),各个浓度均分别进行5样本分析且均连续测定3 d。按照当日所测得的标准曲线计算血浆中阿戈美拉汀、7-去甲-阿戈美拉汀及3-羟基-阿戈美拉汀的日内精密度,并根据上述方法,在不同的日期重复操作另外样品,计算日间精密度。结果见表1。
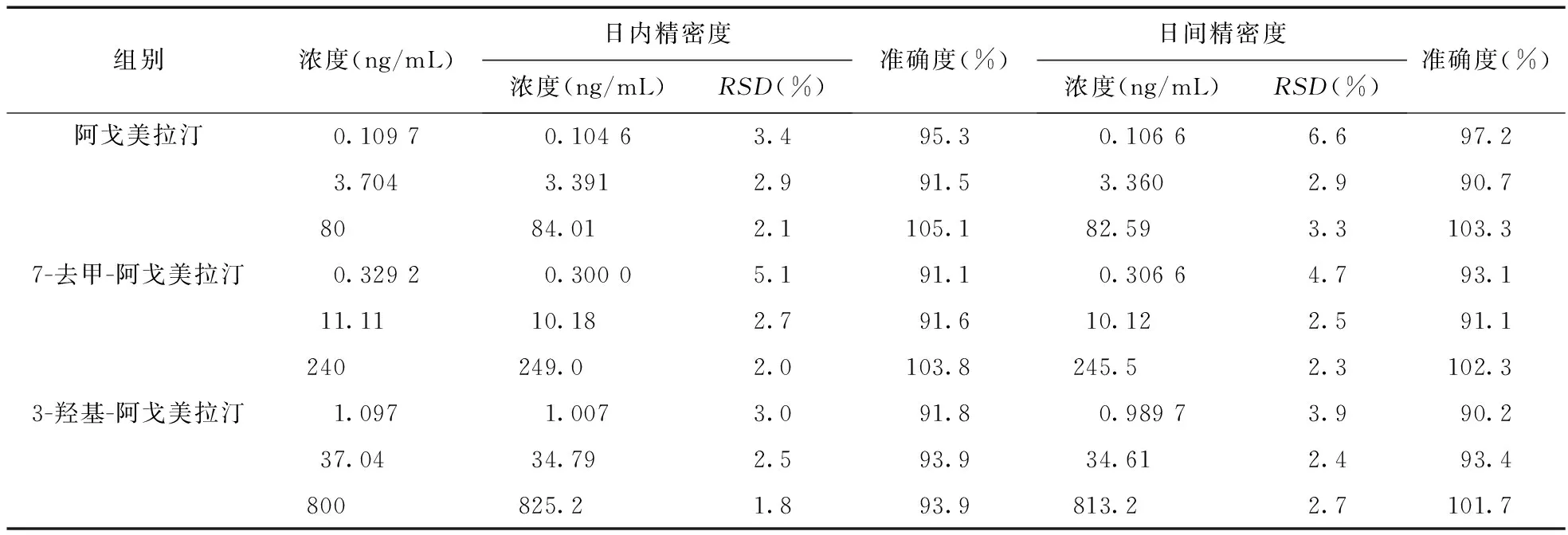
表1 精密度和准确度结果
2.7 提取回收率和基质效应 取空白血浆,按照“2.3”项中方法处理后,分别加入“2.6”项低、中、高浓度的阿戈美拉汀、7-去甲-阿戈美拉汀和3-羟基-阿戈美拉汀,分别取10 μL进样。分别用2种方法处理不同浓度各种化合物,取其峰面积的比值,计算各种化合物的提取回收率(n=5)。结果显示,低、中、高浓度阿戈美拉汀回收率分别为88.5%、87.7%、90.7%;7-去甲-阿戈美拉汀回收率分别为99.5%、91.4%、95.3%;3-羟基-阿戈美拉汀回收率分别为104.6%、99.9%、100.3%。结果表明,3种药物的回收率均符合要求且稳定。
另取200 μL健康志愿者的空白血浆,按照“2.3”项中方法处理后,分别加入低、中、高质量浓度的阿戈美拉汀、7-去甲-阿戈美拉汀和3-羟基-阿戈美拉汀20 μL及内标20 μL,对上述样品均进行LC-MS/MS 分析并获得峰面积,与直接进样的相同浓度混合标准品溶液得到的峰面积相互比较,并考察本研究中的基质效应。结果显示,低、中、高浓度阿戈美拉汀基质效应分别为112.1%、102.7%、107.5%;7-去甲-阿戈美拉汀基质效应分别为107.0%、103.3%、108.0%;3-羟基-阿戈美拉汀基质效应分别为104.6%、110.1%、111.7%。内标的平均基质效应为105.3%。结果表明,3种药物在本检测方法下均不存在基质效应。
2.8 稳定性试验 在不同的保存条件下,对阿戈美拉汀、7-去甲-阿戈美拉汀和3-羟基-阿戈美拉汀的低、中、高质量浓度血浆样品的稳定性进行考察(n=5),各次检测结果的RSD均<15%。结果显示,三种血浆样品于室温中放置4 h、在4 ℃的进样温度下放置24 h、在3次冷冻-解冻循环处理及在-80 ℃的保存条件中保存3个月后均稳定。结果见表2。

表2 稳定性试验结果(ng/mL,n=5)
2.9 药动学试验 20名中国籍汉族健康志愿者(18~26岁)于试验日晨,在空腹条件下用100 mL温水送服阿戈美拉汀片(1片,25 mg);受试者于给药前0 h及给药后0.25、0.5、0.75、1、1.5、2、2.5、3、3.5、4、5、6、7、8 h时,采集各志愿者静脉血1 mL。将上述取得的血浆样本分别置于肝素管中,用冰浴冷却后,以5 000 r/min的离心条件离心10 min,得到分离后的血浆并置于-80 ℃冰箱内保存待测。利用LC-MS/MS法检测给药后不同时间的阿戈美拉汀血药浓度,利用DAS 2.1.1软件对本研究中的药-时数据进行统计学分析,并得到主要药动学数据,包括峰值浓度(Cmax)、达峰时间(Tmax)、所有时间点的曲线下面积(AUClast)、药-时曲线下面积(AUCinf)及半衰期(t1/2)。见表3。阿戈美拉汀及其代谢产物7-去甲-阿戈美拉汀和3-羟基-阿戈美拉汀的药-时曲线见图3。本研究药动学实验得到我院伦理委员会批准,且各受试者均同意并签署知情同意书。

表3 本研究中药动学试验主要参数(n=5)

图3 阿戈美拉汀(A)、7-去甲-阿戈美拉汀(B)和3-羟基-阿戈美拉汀(C)的血浆药-时曲线
3 讨论
阿戈美拉汀是一种褪黑素类似物,是首个上市销售的褪黑素受体激动剂,临床试验显示,其对抑郁症具有较好的疗效[7],不良反应亦较少[8],可能成为一种应用广泛的抗抑郁药物。但临床针对该药物及其代谢产物7-去甲-阿戈美拉汀和3-羟基-阿戈美拉汀LC-MS/MS的研究十分匮乏[9-12]。因此,建立准确且简便的阿戈美拉汀血药浓度测定方法具有非常重要的意义。沈阳药科大学药学院应用LC-MS/MS方法,测定了比格犬血浆中阿戈美拉汀的药代动力学行为及其相对生物利用度,灵敏度较高,但是其为动物水平研究,与人体实际情况具有一定的差异,且其峰形较差,准确度不高[13];尚德为等[14]建立了一种人血浆中阿戈美拉汀浓度的快速检测方法,并对该药物的2种片剂的生物等效性进行研究。尽管其对于阿戈美拉汀人体药代动力学研究起到重要作用,但其未对该药物的代谢产物进行同时检测。
笔者为了同时检测阿戈美拉汀及其代谢产物7-去甲-阿戈美拉汀和3-羟基-阿戈美拉汀的人体血浆含量,希望通过增加流动相中的质子供体来增强分离效果,因此液相条件选择中初始选择添加醋酸铵,但发现其对响应无明显改善,因此,通过在流动相中添加0.2%甲酸铵,有效增强了分离度;此外,一般情况下,乙腈的洗脱能力明显强于甲醇,但本研究中乙腈流动相的色谱峰形较差,且重复性不佳,选用甲醇后,发现分离效果较好,且无保留时间过长等问题。尽管本课题得到较为理想的检测结果,但仍存在一些问题,主要在于本研究的阿戈美拉汀体内药代动力学研究中,志愿者均选择为中国籍汉族人群,但对于其余人种,该方法是否存在一定的影响还需要进一步考证。
综上所述,本方法可应用于阿戈美拉汀及其代谢产物7-去甲-阿戈美拉汀和3-羟基-阿戈美拉汀的人体药动学及生物等效性研究,对该药物的应用及代谢的研究具有重要意义。
[1] Patil SR,Nerurkar KK,Kalamkar AM,et al.Validated LC-MS/MS method for quantification of agomelatine in human plasma and its application in a pharmacokinetic study[J].J Mass Spectrom,2012,47(1):23-28.
[2] Wang X,Zhang D,Liu M,et al.LC-MS/MS method for the determination of agomelatine in human plasma and its application to a pharmacokinetic study[J].Biomed Chromatogr,2014,28(2):218-222.
[3] 吕志强,杨建云,肖炳坤,等.褪黑素能类药物研究进展[J].国际药学研究杂志,2013,40(2):162-166.
[4] 胡孝芬,欧阳泽祥,韩友松.阿戈美拉汀抗抑郁药应用的现状与进展[J].中国药房,2014,25(6):554.
[5] Kim J,Woo SY,Im CY,et al.Insights of a lead optimization study and biological evaluation of novel 4-hydroxytamoxifen analogs as estrogen-related receptor γ (ERRγ) inverse agonists[J].J Med Chem,2016,59(22):10209-10227.
[6] Saracino MA,Mercolini L,Carbini G,et al.Multi-matrix assay of the first melatonergic antidepressant agomelatine by combined liquid chromatography-fluorimetric detection and microextraction by packed sorbent[J].J Pharm Biomed Anal,2014,95:61-67.
[7] Bhutada P,Dixit P,Thakur K,et al.Effects of agomelatine in a murine model of obsessive-compulsive disorder:interaction with meta-chlorophenylpiperazine,bicuculline,and diazepam[J].Kaohsiung J Med Sci,2013,29(7):362-367.
[8] De Berardis D,Serroni N,Campanella D,et al.A case of obsessive-compulsive disorder successfully treated with agomelatine monotherapy[J].J Clin Psychopharmacol,2012,32(2):289-290.
[9] De Berardis D,Fornaro M,Serroni N,et al.Agomelatine beyond borders:current evidences of its efficacy in disorders other than major depression[J].Int J Mol Sci,2015,16(1):1111-1130.
[10]Chenu F,El MM,Blier P.Electrophysiological effects of repeated administration of agomelatine on the dopamine,norepinephrine,and serotonin systems in the rat brain[J].Neuropsychopharmacology,2013,38(2):275-284.
[11]Taylor D,Sparshatt A,Varma S,et al.Antidepressant efficacy of agomelatine:meta-analysis of published and unpublished studies[J].BMJ,2014,348:g1888.
[12]Musazzi L,Seguini M,Mallei A,et al.Time-dependent activation of MAPK/Erk1/2 and Akt/GSK3 cascades:modulation by agomelatine[J].BMC Neurosci,2014,15:119.
[13]栾心怡,赵慧敏,刘舒,等.LC-MS /MS 法测定Beagle 犬血浆中阿戈美拉汀的质量浓度[J].沈阳药科大学学报,2015,32(10):801-807.
[14]尚德为,倪晓佳,张明,等.HPLC-MS/MS法测定人血浆中阿戈美拉汀的浓度[J].广东药学院学报,2013,29(4):366-369.
Simultaneous determination of agomelatine and two of its metabolites in human plasma by LC-MS/MS
CAO Yuan
(Department of Pharmacy,Baoji People′s Hospital,Baoji 721000,China)
Objective To establish a method for the simultaneous determination of agomelatine,7-desmethyl-agomelatine and 3-hydroxy-agomelatine in human plasma.Methods The LC-MS/MS method was used with phenacetin as internal standard,and the determination was performed on Phenomenex ODS-3 column with 0.2% ammonium formate+100% water-methanol (30∶70) as the mobile phase.Agomelatine (244.1→185.1),7-desmethyl-agomelatine (260.1→201.1) and 3-hydroxy-agomelatine (180.1→110.1) were detected by electrospray ionization (ESI) with positive ion in MRM mode quantitatively.Results The linear range was good within 0.045 7~100 ng/mL of agomelatine,0.137 2~300 ng/mL of 7-desmethyl-agomelatine and 0.457 2~1 000 ng/mL of 3-hydroxy-agomelatine,respectively,and the lowest limits of quantitation were 0.045 7,0.137 2 and 0.457 2 ng/mL,respectively.The intra-day and inter-day precision and accuracy were all in line with the requirements of biological sample analysis.The plasma samples were stable after 3 freeze-thaw cycles and being stored for 4 h at room temperature and 90 d at -80 ℃.Conclusion The method is rapid,sensitive and repeatable,which can be used for the determination of plasma concentration and pharmacokinetic study.
Agomelatine;7-desmethyl-agomelatine;3-hydroxy-agomelatine;LC-MS/MS;Plasma concentration
2016-07-28
宝鸡市人民医院药剂科,陕西 宝鸡 721000
10.14053/j.cnki.ppcr.201703023

