FSH体外干预小鼠卵巢后DGE表达谱的建立及初步分析
马春骥,张晓光,裴秀英,王燕蓉
(1.宁夏职业技术学院生物与制药技术系,宁夏银川 750021;2.宁夏医学科学研究所,宁夏银川 750004;3.河南省漯河市医学高等专科学校第二附属医院,河南漯河 462300;4.宁夏医科大学生育力保持教育部重点实验室,宁夏银川 750004)
FSH体外干预小鼠卵巢后DGE表达谱的建立及初步分析
马春骥1,2,张晓光3,裴秀英2,4,王燕蓉4
(1.宁夏职业技术学院生物与制药技术系,宁夏银川 750021;2.宁夏医学科学研究所,宁夏银川 750004;3.河南省漯河市医学高等专科学校第二附属医院,河南漯河 462300;4.宁夏医科大学生育力保持教育部重点实验室,宁夏银川 750004)
本研究利用数字基因表达谱技术,构建FSH体外干预小鼠卵巢12 h后的DGE差异基因表达谱,并对差异表达基因进行GO功能和Pathway信号通路分析。发现FSH干预培养12 h组(FA)和无FSH干预培养12 h组(NA)之间存在显著差异基因256个,其中上调基因34个,下调基因222个。对差异表达基因功能注释分析表明,在体外干预培养小鼠卵巢的过程中,FSH主要对小鼠卵巢生殖相关的细胞元件生成、生殖结构发育、核糖体生成、性腺发育、雌性性腺发育等GO功能类基因有一定影响,并通过趋化因子、ErbB、促性腺激素释放素、粘着斑、血管内皮生长因子、神经营养蛋白因子等信号通路干预小鼠卵巢体外培养。
小鼠;卵巢;FSH;数字基因表达谱
卵巢深低温冻存再移植技术将有可能帮助女性恢复或延长生育能力,特别是对于女性癌症患者,在治疗肿瘤前可利用该技术体外保存其生殖细胞。但是体外冻存和移植过程中会对卵巢造成一定的损伤。Aubard和张皓云等人在移植卵巢组织时发现,移植造成了一半以上的原始卵泡的损失[1-2]。对于雌性哺乳动物,母体卵泡刺激素(Follicle Stimulating Hormone,FSH)是一类重要的性激素,其与生殖系统密切相关。有研究表明,若在卵巢组织移植过程辅以FSH,可最大限度地提高卵泡和卵母细胞的直径,提高次级卵泡的百分比,说明FSH对卵泡的生长发育有重要作用[3-4]。本课题组前期研究发现,将体外培养的小鼠卵巢组织移植回体内时,经体外FSH短暂干预培养的小鼠卵巢组织在血流重建时间和卵泡闭锁抑制等方面,均要优于未经FSH干预组[5],但尚不清楚其作用机理。
作为新一代高通量测序技术,数字基因表达谱(Digital Gene Expression Tag Profiling,DGE)可针对某一物种特定组织的特定状态下mRNA的表达情况,进行全面、精准、快速的检测,获得物种特定组织、特定状态的基因表达图谱,从而在基因表达水平进行数字化分析。本研究利用DGE技术,对体外FSH干预的小鼠卵巢组织构建其数字基因表达谱,初步分析其作用机理。
1 材料与方法
1.1 材料
实验动物为SPF级的ICR品系雌性小白鼠,购自宁夏医科大学实验动物中心,雌性小白鼠体重(20±2)g。主要试剂为卵泡刺激素(FSH):注射用重组人卵泡刺激素(果纳芬)。
1.2 实验方法
1.2.1 试剂的配制
基础培养液:DMEM/F12(5 g)、链霉素(0.1 g)、Hepes(2.38 g)、NaHCO3(2.388 g)、二甲基亚砜(10 mL)、青霉素(10万IU)。用NaHCO3将基础培养液pH值调至7.2~7.4,将调制好的基础培养液经0.22 μm的微孔滤器过滤除菌备用。在卵巢体外培养过程中,FSH干预组为在基础培养液内添加FSH至终浓度达到0.3 IU·mL-1。基础培养液在使用前加入10 % 小牛血清。
1.2.2 卵巢的获取
通过观察小鼠动情周期阴道涂片,取其双侧卵巢,将每只小鼠的两个卵巢随机分成FA和NA组。
1.2.3 实验分组
根据研究目的,将100只雌性小鼠的200枚卵巢分为FA和NA 两组(FA组为0.3 IU·mL-1FSH 体外干预培养12 h,NA组为无FSH体外干预培养12 h)。
1.2.4 总RNA提取与纯化
利用TRizol提取法提取卵巢组织总RNA,并进行纯化。使用生物分析仪检测总RNA的浓度和纯度,检测前RNA均经过DNaseI处理。
1.2.5 RNA测序样品处理
利用Oligo(dT)磁珠取6 μg待测样本总RNA,对其mRNA进行吸附和纯化。纯化后的mRNA反转录合成双链cDNA。用内切酶NlaIII(识别位点为CATG)处理双链cDNA,再利用磁珠对其纯化,并在其5’末端连上测序所需的接头1。用MmeI内切酶(识别位点为CATG,切割位点为识别位点下游17 bp处)处理测序样品,产生大量带有接头1的标签序列和带有磁珠的序列。再利用磁珠吸附沉淀去除3’片段后,剩余即为带有接头1的测序样品,在其3’末端连上接头2,获得5’和3’端连有不同接头的21 bp标签序列库,纯化后上机测序(图1)。
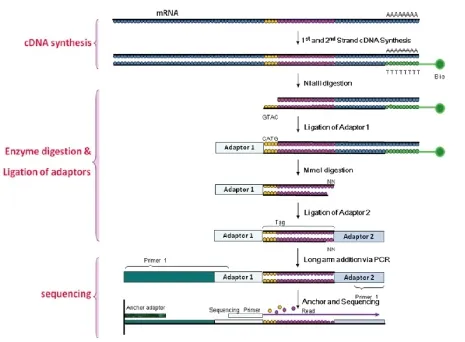
图1 测序标签制备的原理和步骤
1.2.6 测序数据的获取
因测序所得到的原始数据含有3’端接头序列和部分低质量数据,需对其行处理。去除3’端接头、空片段、低拷贝片段和长度过大或过小的序列,最终得到干净的测序数据。
1.3 测序数据生物信息学分析
对全部干净的测序数据与GenBank小鼠基因组数据库进行比对,并进行基因注释。此外,为了获得测序样本中基因表达量,以保证基因表达水平更加准确,需对测序数据进行标准化,标准化方法为:每个基因包含的原始干净的标签数/该样本中总干净的标签数×1 000 000。
通过对差异基因进行P-value多重假设检验校正,筛选FSH干预培养的小鼠卵巢差异基因(FDR≤0.001,差异倍数为2倍以上)。利用Cluster软件,对FA和NA样本中差异基因表达模式进行聚类分析。
对FA和NA样本中差异表达基因分别进行GO(Gene Ontology)功能显著性富集分析和Pathway显著性富集分析,以明确差异表达基因在分子生物学功能(molecular function)、所在细胞中的位置(cellular component)、参与行使的生物进程(biological process)和参与主要的生化代谢途径和信号传导途径中的作用。
2 结果与分析
2.1 总RNA的提取与纯化
对FA和NA样本卵巢组织总RNA的浓度和纯度进行检测,RNA完整指数RIN>=7.0,28S/18S>0.7,即本实验样品可用,见图2。
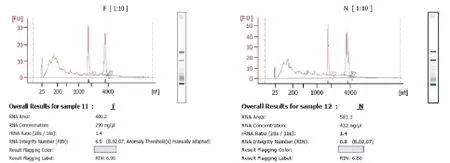
图2 总RNA产物检测图谱注:F为FSH干预培养小鼠卵巢;N为无FSH干预培养小鼠卵巢
2.2 质量分析
2.2.1 测序质量评估
测序质量评估表明,在NA和FA样本中,干净的数据总量占比分别达到93.59%和91.74%,干净的数据种类数占比分别达到39.29%和33.99%,说明测序标签测序总量达标,测序质量很高,有效标签覆盖率足够后续实验需要,测序信息可用于后续数据分析,具体结果见图3。
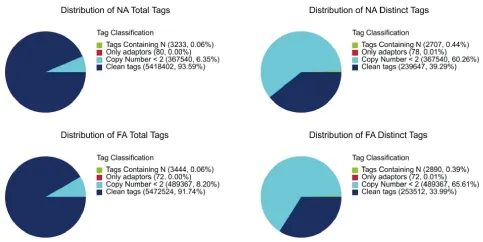
图3 测序质量分析图
2.2.2 测序饱和度分析
随着测序进程的推进,测序量也随之增加。从图4可以看出,无论是NA组还是FA组,基因数在测序数据量达到2 M时均趋于饱和。
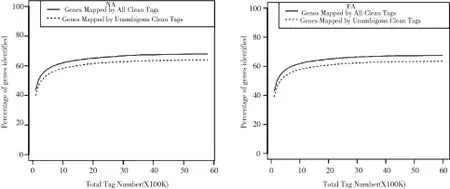
图4 样本饱和度分析图
2.2.3 干净标签拷贝数分布统计
通过对干净标签数据进行统计分析,可以判断其相应基因的表达量,且可以从整体上评估数据的可靠性。本研究结果表明,在两组样本中,拷贝数大于100的高表达标签种类数虽然很少(占比分别为3.02%和2.79%),但表达量都超过了62%;而拷贝数小于5的标签虽然表达量小(占比分别为7.86%和8.46%),但种类数上非常丰富,分别占mRNA总数的63.61%和67.05%,说明不同基因的mRNA在细胞中的表达是不一致的,除少量基因高表达外,大多数基因在mRNA的表达水平都很低(图5)。

图5 Clean Tags拷贝数分布统计图
2.3 差异基因的表达分析
以FDR≤0.01且差异基因表达量倍数在2倍及以上为筛选标准,发现FA组与NA组的小鼠卵巢存在显著的基因差异,共有差异基因256个,其中高表达差异基因34个,低表达差异基因222个。
2.4 差异表达基因GO功能显著性富集分析
对FSH体外干预和无FSH干预的小鼠卵巢培养12 h表达差异基因进行GO功能分类。结果显示FSH干预后,在细胞组分Ontology中有196个基因差异表达,显著富集在细胞内(intracellular part)、膜结合细胞器(membrane-bounded organelle)等6个GO-term中。在分子功能Ontology中有193个基因差异表达,虽然没有显著富集,但大部分基因主要集中于结合功能的基因上。在生物学过程Ontology中,有188个差异基因表达,虽然也没有显著富集,差异基因主要集中在核糖核蛋白复合(ribonucleoprotein complex biogenesis)、细胞元件的生成(cellular component biogenesis at cellular level)、生殖结构发育(reproductive structure development)、核糖体生成(ribosome biogenesis)、性腺发育(gonad development)、雌性性腺发育(female gonad development)等过程中。图6仅以P-value<0.05为阈值定义差异表达基因中显著富集的GO-term。
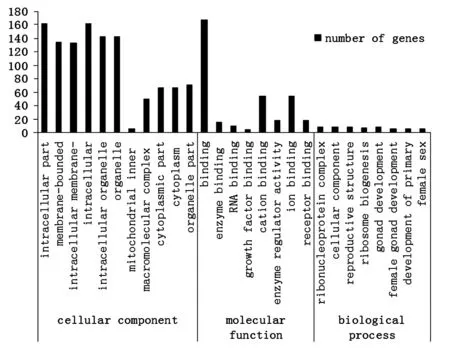
图6 FSH干预差异表达基因GO功能分类
2.5 差异表达基因信号通路(Pathway)显著性富集分析
对FA组和NA组小鼠卵巢201个差异基因进行Pathway分析,将P-value<0.05的信号通路定义为在差异表达基因中显著富集的通路。以此为标准,FSH体外干预小鼠卵巢差异基因主要集中在10个信号通路中,分别为:趋化因子信号通路(Chemokine signaling pathway)、ErbB信号通路(ErbB signaling pathway)、促性腺激素释放素信号通路(GnRH signaling pathway)、粘着斑信号通路(Focal adhesion signaling pathway)、Fc epsilon RI signaling pathway、血管内皮生长因子信号通路(VEGF signaling pathway)、神经营养蛋白因子信号通路(Neurotrophin signaling pathway)、半乳糖代谢信号通路(Galactose melabolism signaling pathway)、神经胶质瘤信号通路(Glioma signaling pathway)和间隙连接信号通路(Gap junction signaling pathway)(表1)。

表1 NA vs FA的Pathway显著富集列表(Top 10)
3 讨论
目前,可通过DNA-RNA杂交、差异显示、表达序列标签等技术对生物在不同生长发育阶段和处理条件下的差异基因进行比较,并获得基因表达图谱,但由于此类技术存在一定的缺陷,以至于获得的基因表达模式信息有限,不能对差异基因进行定量研究。近年来,研究人员多采用基因芯片技术研究高通量基因差异表达,但该技术需事先制备大量已知cDNA或寡核苷酸序列分子探针,再采用特殊方法固定或原位合成在支持物上,对选定的基因进行表达模式分析[6]。本实验采用DGE技术具有高通量和高灵敏性的优势,不需要获得目标基因序列,可更准确、全面、高效地从全转录组水平反映生物体在生长发育过程中基因表达变化情况[7-8]。在本研究中,对照组和实验组测序样本量均达2 M饱和状态,通过样本质量分析和拷贝数分布统计,均表明测序样本信息充足、精确;但是,因基因组序列信息不足,对基因注释及差异表达基因的功能注释有一定影响,限制了表达谱数据的深入发掘和全面分析。
作为天然卵泡存活因子,FSH可影响女性卵巢的生殖和内分泌功能[9]。在卵巢体外玻璃化冻存过程中,因低温冻存会对卵巢造成一定损伤,已有研究员人员通过加入FSH以降低卵巢冻存损伤。陈杰等[10]研究发现,给不同时段的玻璃化冻存卵巢添加FSH,添加FSH的卵巢中含有的正常卵泡要显著高于不添加FSH的卵巢。除此之外,Magalhes等[3]研究发现,培养卵巢组织时,在FSH添加组中,卵泡和卵母细胞的直径以及次级卵泡的百分比都比不添加FSH组的卵巢要高,说明FSH对卵泡的生长发育有极其重要的作用,但尚不清楚FSH作用卵巢的机理。
在本研究中值得注意的是,差异基因在趋化因子信号通路和粘着斑信号通路相对更为显著富集。趋化因子在机体的免疫过程中发挥着重要作用,其趋使白细胞等免疫细胞在各循环系统和组织间游走并活化,清除感染源,促进创伤愈合。除此之外,趋化因子还对肿瘤生长的调节、移植免疫排斥、神经系统发育等方面起着重要作用。同时,相当一部分的趋化因子还是细胞生长因子,促使血管生成或参与胚胎期免疫系统的形成[11-13]。本研究中,趋化因子信号通路富集了12个差异基因,我们推测体外培养小鼠卵巢是一种缺血缺氧的过程,FSH通过该信号通路参与了卵巢的血管生成与血管内皮细胞的抗凋亡。
4 结论
本研究对体外FSH干预培养12 h的小鼠卵巢差异表达基因进行分析,发现差异基因在Gene Ontology和Pathway上显著富集,说明FSH参与卵巢生殖结构发育、性腺发育、雌性性腺发育和细胞内核糖体生成等生物学发育过程,并通过趋化因子信号通路、ErbB信号通路、促性腺激素释放素信号通路、粘着斑通路、血管内皮生长因子信号通路和神经营养蛋白因子信号通路等体外干预小鼠卵巢,为FSH应用于抗卵巢玻璃化冻存损伤提拱了一定的理论支持。
[1]Aubard Y,Piver P,Cogni Y,et al. Orthotopic and heterotopic autografts of frozen-thawed ovarian cortex in sheep[J].Hum Reprod,1999(8):2149-2154.
[2]张皓云,管英俊,孙秀宁.冻存卵巢移植后功能及其影响因素[J].解剖科学进展,2004(4):332-335.
[3]Magalhes-Padilha D M,Fonseca G R,Haag K T,et al.Long-term in vitro culture of ovarian cortical tissue in goats:effects of FSH and IGF-I on preantral follicular development and FSH and IGF-I receptor mRNA expression[J].Cell Tissue Res,2012(3):503-511.
[4]Gartrell B A,Tsao C K,Galsky M D.The follicle-stimulating hormone receptor: A novel target in genitourinary malignancies[J].Urologic Oncology Seminars & Original Znvestigations,2013(8):1403-1407.
[5]Wang Y R,Chang Q,Sun J,et al. Effects of HMG on revascularization and follicular survival in autotransplant mouse ovarian tissue[J].Reproductive BioMedicine Online,2012(6):646-653.
[6]Eveland A L,Satoh-Nagasawa N,Goldshmidt A,et al.Digital gene expression signatures for maize development[J]. Plant Physiol, 2010(3):1024-1039.
[7]Hao Q N,Zhou X A,Sha A H,et al.Identification of genes associated with nitrogen-use efficiency by genome-wide transcriptional analysis of two soybean genotypes. BMC Genomics,2011(1):1-15.
[8]Mardis E R. The impact of next-generation sequencing technology on genetics. Trends Genet,2008(3):133-141.
[9]Hermann B P,Heckert L L.Transcriptional regulation of the FSH receptor: new perspectives[J].Mol Cell Endocrinol,2007(1):100-108.
[10]陈杰,张宁,王燕蓉,等.小鼠卵巢玻璃化冻存过程中FSH干预对VEGF及VEGFR-2表达的影响[J].宁夏医科大学学报,2013(3):236-239.
[11]Yoshie O,Imai T,Nomiyama H. Chemokines in immunity[J].Advances in Immunology,2001(78):57-110.
[12]Cascieri M A,Springer M S.The chemokine/chemokine-receptor family:potential and progress for therapeutic intervention[J].Current Opinion in Chemical Biology,2000(4):420-427.
[13]郑红.趋化因子及其受体的功能[J].免疫学杂志,2004(1):1-5.
The Construction and Basic Analysis of DGE About Mouse Ovarian Intervened by FSH in Vitro
MA Chun-ji1,2,ZHANG Xiao-guang3,PEI Xiu-ying2,4,WANG Yan-rong4
(1. Department of Biology and Pharmaceutical Technology, Ningxia Polytechnic College, Yinchuan Ningxia 750021,China; 2.Ningxia Institute of Med. Sciences, Yinchuan Ningxia 750004, China; 3.The Second Affiliated Hospital of Henan Luohe Medical College,Luohe Henan 462300,China; 4. Key Laboratory of Fertility Preservation and Maintenance of Ministry of Education, Ningxia Medical University,Yinchuan Ningxia 750004,China)
Using technology of digital gene expression tag profiling to construct the gene expression profile of mouse ovarian intervened in vitro by FSH, and analyze the expression of differential genes. The estrum mouse ovarian were divided into 2 groups, one cultured with FSH 12 hours(FA), the other cultured without FSH 12 hours(NA).Then analyze the Gene Oncology and Pathway. There are 256 differential genes between FA and NA,including 34 up-regulated genes and 222 down-regulated genes. The Gene ontology analysis of differential genes demonstrate that FSH has effect on GO functional genes about cellular component biogenesis at cellular level, reproductive structure development, ribosome biogenesis, gonad development, female gonad development and these genes have taken part in signaling pathways including Chemokine,ErbB, GnRH, Focal adhesion,Fc epsilon RI, VEGF, Neurotrophin when mouse ovarian intervened by FSH in vitro.
mouse;ovary;FSH;DGE
2016-09-01
宁夏回族自治区自然科学基金项目“小鼠卵巢组织特异性启动子OSP1和DHEA基因真核表达载体的建立及活性研究”(NZ12285);宁夏科技支撑计划项目“促性腺激素干预移值卵巢基因表达的蛋白质组学研究”(宁科计字 [2012]17)。
马春骥(1983- ),男,讲师,硕士,从事生物化学与分子生物学研究。
王燕蓉(1957- ),女,教授,博士生导师,从事生殖医学研究。
Q954.3
A
2095-7602(2017)02-0059-07

