不同黑木耳品种锁状联合形成的差异性研究
王妍 姜忠元 董锡文

摘要:为了研究光质、营养因素对黑木耳[Aurieuzaria auricular (L. ex Hook.)Uzderw.]菌丝锁状联合形成的影响,以5个黑木耳品种为研究对象,通过平板插片培养法进行试验。结果表明,红光、蓝光和紫光对黑木耳品种H29和SL15锁状联合形成有显著的促进作用;H15、H29、XK1、SL15分别在紫外光照射时间4、4、5、3 min后有利于锁状联合形成;供试的4种碳源中,可溶性淀粉、蔗糖、麦芽糖对5个黑木耳品种锁状联合的形成有促进作用;5个黑木耳品种在以牛肉膏为氮源时,锁状联合显著高于其他氮源;5个黑木耳品种在加入丙氨酸和谷氨酸的培养基中锁状联合有显著的提高。
关键词:黑木耳[Aurieuzaria auricular (L. ex Hook.)Uzderw.];锁状联合;光质;营养因素
中图分类号:S646.6 文献标识码:A 文章编号:0439-8114(2017)04-0682-04
黑木耳[Aurieuzaria auricular(L. ex Hook.)Uzderw.]是世界上最早实现人工栽培的食用菌,其食用和药用价值极高,受到消费者的普遍欢迎[1];目前中国已成为世界上黑木耳的主产国[2]。随着黑木耳栽培方式的日渐改进,在黑木耳菌丝生长过程中发现很多环境因素会对其产生影响,进而影响黑木耳的产量。光质、紫外光照射、碳源、氮源和氨基酸等外在因素在黑木耳菌丝生长过程中起着重要作用,会影响黑木耳菌丝锁状联合结构的形成[3,4]。形成锁状联合的菌丝再形成耳基的比例为100%,而不形成锁状联合的菌丝形成耳基的比例仅为20%左右;并且形成锁状联合的菌丝形成耳基的时间比不形成锁状联合的菌丝形成耳基的时间提前30 d左右[5-7]。关于黑木耳生长研究的成果已有很多[8-12],但关于不同黑木耳品种锁状联合形成的差异性比较还鲜有报道。因此,试验对此进行了探讨,以期揭示不同外在因素对黑木耳菌丝锁状联合形成的影响,进而为黑木耳生产提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 供试黑木耳品种的菌株购于黑龙江省科学院微生物研究所,分别是黑微15(H15)、黑微29(H29)、新科1号(XK1)、新科10号(XK10)、神龙15号(SL15)。
1.1.2 培养基 ①PDA固体培养基[13,14]组成为马铃薯200 g、葡萄糖20 g、蛋白胨5 g、KH2PO4 3 g、MgSO4 1.5 g、VB1 10 mg、琼脂20 g、水1 000 mL,pH 5.5。②基础培养基组成为KH2PO4 3 g、MgSO4 1.5 g、VB1 10 mg、琼脂20 g、水1 000 mL,pH 5.5。③碳源培养基组成是在基础培养基中添加0.5%的蛋白胨组成无碳培养基,再在无碳培养基中分别添加2%的葡萄糖、可溶性淀粉、麦芽糖、蔗糖组成不同的碳源培养基。④氮源培养基组成是在基础培养基中添加2%的葡萄糖组成不同的无氮培养基,再在无氮培养基中分别添加0.5%的蛋白胨、牛肉膏、酵母膏、(NH4)2SO4组成不同的氮源培养基。⑤氨基酸培养基组成是在基础培养基中加入2%的葡萄糖和0.5%的蛋白胨,再分别添加0.4%的丙氨酸(Ala)、谷氨酸(Glu)、苏氨酸(Thr)、酪氨酸(Try)组成不同的氨基酸培养基[15]。
1.2 试验方法
1.2.1 菌种活化与培养 在无菌条件下,将供试黑木耳各品种菌株转接在经过灭菌的PDA固体斜面培养基中央,置于恒温培养箱里,于25 ℃恒温条件下培养。
1.2.2 不同光质处理 光质有LED光源的红光、蓝光、白光、绿光、紫光。将LED光源固定于恒温培养箱顶部,培养温度为25 ℃。取活化好的黑木耳各品种菌株,用打孔器在菌落边缘打取相同菌龄的菌种块5 mm,转接在PDA固体平板培养基上,并在菌种块一定距离处以45°倾斜角插入盖玻片(插片法)[16],待盖玻片上长满菌丝后用于显微观察。光照组实施24 h照射处理,对照组实施24 h黑暗处理[17],每个处理设置6个重复。
1.2.3 紫外光照射处理 依次将接种3 d后的PDA固体平板培养基(插片)放在超净工作台的30 W紫外灯垂直下方约30 cm处,打开培养皿盖,按照设定的时间1、2、3、4、5 min分别照射紫外光。照射后遮光,防止光复活。不进行紫外光照射的为对照组,都置于恒温培养箱内25 ℃培养。隔3 d再进行一次上述处理;每处理设置6个重复。
1.2.4 不同营养因素处理 将活化后的菌种分别转接在含有不同碳源、氮源、氨基酸的固体平板培养基中央(插片),都以基础培养基(插片)为对照,25 ℃恒温培养;每处理设置6个重复。
1.2.5 计数及统计 每处理培养12 d后随机选取5个平板,将插片取出,置于显微镜下观察,记录锁状联合的个数、菌丝数,并计算出锁状联合菌丝比率,其计算公式为:
锁状联合菌丝比率=锁状联合个数/菌丝数,
处理组锁状联合菌丝比率=处理组锁状联合菌丝比率-对照组锁状联合菌丝比率。
1.3 数据处理
试验所得数据采用Microsoft Office Excel 2007程序处理,并用其制表和绘图;运用SPSS11.0软件进行统计分析。
2 结果与分析
2.1 光质对黑木耳锁状联合形成的影响
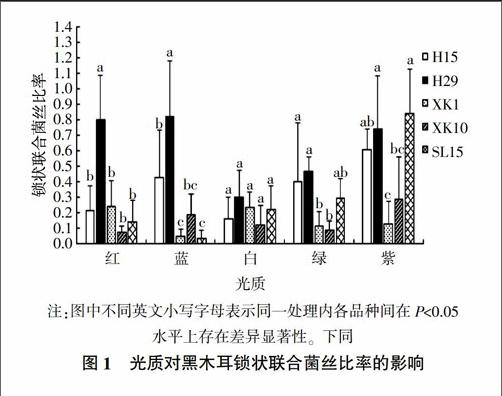
光质是一种重要的环境因素,能影响生物的生存、生长和发育;光质对黑木耳品种各菌株锁状联合形成的影响情况见图1。由图1可知,黑木耳品种H29在红光和蓝光处理下,锁状联合菌丝比率显著高于其他4个品种(P<0.05);5个黑木耳品种在白光处理下锁状联合菌丝比率均较低,相互之间的差异不显著(P>0.05);H15和H29在绿光处理下锁状联合菌丝比率明显高于其他3个品种,其中显著高于XK1、XK10品种(P<0.05);SL15在紫光處理下锁状联合菌丝比率达到最高值,明显高于其他4个品种,其中显著高于XK1、XK10品种(P<0.05)。可见,不同光质,尤其是红光、蓝光和紫光分别对H29和SL15锁状联合的形成影响显著。
2.2 紫外光照射对黑木耳锁状联合形成的影响
紫外线是一种不可见光,其照射菌丝体后可引起其发生诸如生长发育、物质转换、能量代谢等方面的变化,从而影响菌丝体生长,而且不同长短的照射时间对菌丝体产生的影响也不同[18-21]。试验里紫外光照射对黑木耳锁状联合形成的影响情况见图2。由图2可知,H15在紫外光照射4 min后锁状联合菌丝比率达到最高,且明显高于其他品种;H29随着照射时间的增长,锁状联合菌丝比率呈现减-增-减的动态变化,在紫外光照射4 min后锁状联合菌丝比率达到最高值;XK1随着照射时间的增长,锁状联合菌丝比率呈现增-减-增的动态变化,当紫外光照射时间为5 min时,锁状联合菌丝比率达到最高值,且显著高于其他品种(P<0.05);XK10锁状联合菌丝比率随着紫外光照射时间的增长呈现缓慢递减的变化,其锁状联合的形成受紫外光照射时间的影响并不明显;SL15在紫外光照射时间为3 min时,锁状联合菌丝的比率达到最高值。因此,H15、H29、XK1、SL15分别在紫外光照射时间为4、4、5、3 min后有利于锁状联合的形成。
2.3 不同碳源对黑木耳锁状联合形成的影响
碳源是真菌菌丝生长发育过程中所需的一种主要营养物[22]。试验里不同碳源对黑木耳锁状联合形成的影响情况见表1。由表1可知,黑木耳品种H15在以可溶性淀粉为碳源时,锁状联合菌丝比率最高;H29在以蔗糖为碳源时,锁状联合菌丝比率最高,达到0.996,且显著高于其他品种(P<0.05);XK1、XK10、SL15均在以麦芽糖为碳源时锁状联合菌丝比率最高,且显著高于H15(P<0.05),其中XK1、XK10显著高于H29(P<0.05)。说明黑木耳菌丝对双糖和多糖的利用较好,以可溶性淀粉、蔗糖、麦芽糖作为碳源对黑木耳锁状联合的形成有促进作用。
2.4 不同氮源对黑木耳锁状联合形成的影响
黑木耳菌丝生长发育过程中能利用的氮源有尿素、氨、铵盐、硝酸盐、蛋白胨等,试验里4种不同氮源对黑木耳锁状联合形成的影响情况见图3。由图3可知,5个黑木耳品种在以牛肉膏为氮源的培养基中,锁状联合菌丝比率的形成明显高于其他氮源,其中H15和H29的锁状联合菌丝比率最突出,对氮源的利用率最高;以牛肉膏为氮源的XK1、XK10和SL15锁状联合菌丝比率也要高于同品种其他氮源。可见,以牛肉膏为氮源的培养基有利于5个黑木耳品种锁状联合的形成。
2.5 不同氨基酸对黑木耳锁状联合形成的影响
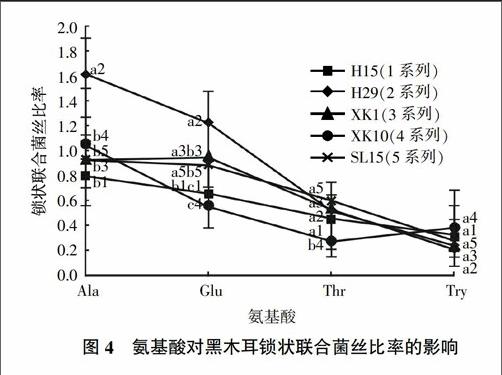
氨基酸作为一种营养物,对黑木耳菌丝体生长和子实体形成具有一定的影响[23];因此,在黑木耳菌丝体生长发育阶段添加不同种类氨基酸,可以比较其对黑木耳锁状联合形成的影响。不同氨基酸对黑木耳锁状联合形成的影响情况见图4。由图4可知,H29在丙氨酸培养基中锁状联合菌丝比率最高,且显著高于其他品种(P<0.05);其次为谷氨酸培养基。在4种不同氨基酸培养基中,丙氨酸和谷氨酸培养基对5个黑木耳品种锁状联合的形成有较明显的促进作用。
3 小结
试验结果表明,红光、蓝光和紫光对黑木耳品种H29和SL15锁状联合的形成有显著促进作用,白光对5个黑木耳品种锁状联合的形成作用不大,因此生产中应尽量避免白光的使用。紫外光不同照射时间处理后,H15、H29、XK1、SL15分别在紫外光照射时间为4、4、5、3 min后促进了锁状联合菌丝比率的提高,因此生产中应根据品种选择不同的紫外光照射时间。参试的4种碳源中,可溶性淀粉、蔗糖、麦芽糖对5个黑木耳品种锁状联合菌丝比率的提高有促进作用,葡萄糖的促进作用不明显。以牛肉膏为氮源的培养基有利于锁状联合菌丝比率的提高。培养基中添加丙氨酸和谷氨酸有利于锁状联合菌丝比率的提高,因此,生产上可考虑适当加入这2种氨基酸。
根据试验结果可知,相同外在因素对不同黑木耳品种锁状联合的形成影响有所不同。生产实践中,可根据不同黑木耳品种选择不同的培养条件,进而缩短生产周期、增加产量、节本增效。不过试验仅进行了单因素比较,各因素、各水平的优化组合综合效果比较还有待下一步探究。
参考文献:
[1] 邹 莉,姜童童,王 玥,等.LED光源不同光质对黑木耳菌丝体生长的影响[J].安徽农业科学,2014,42(10):2855-2856.
[2] 吴 芳,员 瑗,刘鸿高,等.木耳属研究进展[J].菌物学报,2014,33(2):198-207.
[3] 刘佳宁,张介驰,马庆芳,等.不同温度和光照条件下黑木耳次生菌丝形态的研究[J].黑龙江科学,2014,5(6):13-15.
[4] 李 楠,李 玉.不同光照条件对黑木耳产量及色素含量的影响[J].食用菌,2008,30(6):7-9.
[5] 戴肖东,张丕奇,马庆芳.PDA培养基灭菌前后pH值变化及对黑木耳菌丝生长的影响[J].食用菌,2008,30(6):30-31.
[6] 阮瑞国,林丛发.影响黑木耳产量的几个因素研究[J].食药用菌,1995,3(3):12-13.
[7] 韩建荣,黄咏贞.温度和光对黑木耳产量的影响及指标优化研究[J].山西大学学报(自然科学版),1991(3):285-292.
[8] 张 鹏,姚方杰,王立军,等.黑木耳形态发育研究的概述[J].北方园艺,2011(4):185-187.
[9] 张 鹏.木耳形态发育及木耳属次生菌丝和子实体的解剖学研究[D].长春:吉林农业大学,2011.
[10] 顾龙云.浅谈锁状联合[J].食用菌,1982(2):43.
[11] 高 娃,张丕奇,党阿丽,等.东北黑木耳野生菌株比较[J].食药用菌,2013,21(4):230-232.
[12] 楊春瑜,申世斌,马 岩.黑木耳显微结构及即食黑木耳纸加工工艺研究[J].中国林副特产,2002(1):34-35.
[13] 赵桂云,暴纪春,张 晶,等.十四种食用菌菌丝形态观察[J].食用菌,2007,29(2):14-15.
[14] 黄亚东.木耳的极性研究[D].武汉:华中农业大学,2004.
[15] 赵 萍.氨基酸对黑木耳菌丝生长发育的影响[J].甘肃农业大学学报,1997(2):159-162.
[16] 杨 勇,张凤英,陈 岑.PDA培养基改良配方的研究[J].酿酒科技,2012(4):29-31.
[17] 蔡信之.插片法观察放线菌霉菌效果好[J].实验教学与仪器, 1995(2):28-29.
[18] 傅常娥,苏丽敏,冉丽萍,等.紫外线处理对3种食用菌菌丝体生长及多糖产量的影响[J].延边大学农学学报,2013,35(3):194-199.
[19] 姜天甲,陆仙英,蒋振晖,等.短波紫外线处理对香菇采后品质的影响[J].农业机械学报,2010,41(2):108-112.
[20] 周春梅,王 欣,刘宝林,等.短波紫外线处理时间对白玉菇自发气调保鲜的影响[J].食品与发酵工业,2011,37(3):230-234.
[21] 訾惠君,刘连强,陈晓明,等.紫外线辐射对平菇菌丝体生长的影响[J].天津农业科学,2015,21(7):142-144.
[22] 班立桐,王文治,周宗寰.碳源和氮源对网脉木耳菌丝生长影响的研究[J].天津农林科技,2006(2):10-11.
[23] 姜萍萍,韩 烨,顾赛红,等.五种食用菌氨基酸含量的测定及营养评价[J].氨基酸和生物资源,2009,31(2):67-71.

