游泳运动员运动诱发支气管痉挛的可复性研究
宋小波,陆一帆,王斌,闫会萍
游泳运动员运动诱发支气管痉挛的可复性研究
宋小波1,2,陆一帆2,王斌1,闫会萍2
目的:对比分析短期终止训练和持续大强度训练对游泳运动员气道反应性和肺通气功能的影响,结合分析相关炎性因子的变化,研究游泳运动员运动诱发支气管痉挛的可复性。方法:以36名青少年游泳运动员为研究对象,平均年龄15.97±1.1岁。其中,15名运动员终止训练或低强度恢复性训练为期2周,为实验组;选取同一教练组,正常强度训练的21名运动员为对照组。分别于2周前后进行肺功能测试和支气管激发试验。测试日晨起肘正中静脉采血,测试血常规及血清IgE、IL-17。结果:1)首次测试,共检出13名运动员EIB阳性(36%),实验组5人(33%)、对照组8人(38%),组间比较无显著性差异;2)首次测试13名EIB阳性运动员中仅有5人出现哮喘类呼吸症状(EIA),实验组2人(13%)、对照组3人(14%),组间比较无显著性差异;3)停训2周后,实验组3名EIB阳性运动员转为阴性,EIB检出率显著低于对照组(20%vs.48%,P<0.05);实验组运动员支气管激发试验FEV1下降百分比显著降低(10.53±8.19 vs.8.35±5.24,P<0.05),而肺功能参数MEF50%显著升高(88.69±27.01 vs.91.13± 26.93,P<0.05);4)停训2周后,实验组运动员静脉血中性粒细胞计数(3.47±1.06 vs.3.13± 0.97,P<0.05)和中性粒细胞百分比(55.31±7.60 vs.51.25±8.31,P<0.05)均显著降低,静脉血中性粒细胞计数显著低于对照组(3.13±0.97 vs.3.39±0.91,P<0.05);中性粒细胞计数同支气管激发试验FEV1下降百分比之间相关性不显著(r=0.323,P>0.05);实验组运动员血清IL-17含量显著降低(0.98±0.21 vs.0.83±0.10,P<0.05),而血清IgE未发生显著变化。结论:1)游泳运动员EIB具有可复性,短期终止训练在一定程度上可以促进EIB的恢复;2)EIB阳性运动员多无哮喘类主观症状,支气管激发试验的客观证据是明确诊断的必要条件。
游泳;运动诱发支气管痉挛;气道高反应性;可复性
运动诱发支气管痉挛(Exercise-induced brochoconstriction,EIB),是指运动诱发的暂时性气道狭窄,可单独发生而无任何症状,亦可伴有咳嗽、喘鸣、呼吸困难等哮喘症状,称为运动诱发哮喘(Exercise-induced asthma,EIA)。2000年悉尼奥运会开始,国际奥委会医学委员会(IOC Medical Commission,IOC-MC)制定了运动员EIB/EIA的诊断细则。2000年、2004年两届奥运会,21.2%的运动员支气管激发试验阳性,20.7%的运动员支气管舒张试验阳性[18]。全球变态反应与哮喘欧洲协作组(Global Allergy and Asthma European Network,GA2LEN)的奥运医疗调查报告显示,北京奥运会有25%的欧洲运动员出现运动相关哮喘症状[32]。EIB/EIA在优秀运动员群体中患病率较高,已成为奥运会运动员常见的慢性医疗问题[5]。基于考虑EIB对运动能力的潜在影响以及运动诱发哮喘恶化是青少年运动员运动猝死的重要非心源性因素,多数学者认为相关问题必须引起足够重视,有必要制定针对性筛查方案和预防策略[21]。同其他项目相比,游泳和冬季项目具有更高的患病率,其中,竞技游泳运动员支气管激发试验阳性率可高达76%[29]。长期大强度训练,泳池游离氯和/或含氯化合物暴露条件下反复的过度通气,是游泳运动员EIB患病率高于其他项目运动员的可能原因,而气道反应性增高(Airway hyperresponsiveness,AHR)是其基本病理改变[6,30]。AHR同气道炎症反应有关,包括持续性和暂时性两种病理类型[15]。大多数哮喘患者存在持续性AHR,根本原因在于慢性炎症反应引起气道重塑导致支气管组织结构发生改变。吸入空气变应原、刺激物或污染物引发气道急性炎症反应亦可引起暂时性AHR,去除刺激因素后气道反应性可恢复至正常水平[15]。目前,游泳运动员EIB/ EIA的发生机制并不明确,研究并确定游泳运动员的EIB是否具有可复性是制定预防策略和治疗方案的基础。本研究以36名青少年游泳运动员为研究对象,对比分析短期终止训练和持续大强度训练对游泳运动员气道反应性和肺通气功能的影响,结合分析相关炎性因子的变化,研究游泳运动员运动诱发支气管痉挛的可复性。
1 研究对象与方法
1.1 研究对象和分组
以36名参加全国青少年游泳集训的运动员为研究对象,年龄14~18岁,平均15.97±1.1岁;训练年限3~8年,平均5.2±1.2年;健将组运动员8名、一级组运动员16名、二级组运动员12名。本次集训为期5周,共86名运动员参加。其中,15名运动员于第4周、第5周终止训练(9名)或进行恢复性低强度陆上训练(6名),为本研究实验组;选取同一教练组,正常强度训练的21名运动员为对照组。所有运动员均无吸烟史,无抗哮喘药物治疗史,在实验前3周内无感冒等呼吸道感染病史(表1)。所有运动员在同一游泳池内训练(游离氯0.75 mg/L,三卤甲烷170 μg/L),在实验前24 h内禁止剧烈运动和饮用咖啡。
1.2 研究方法
1.2.1 实验方案
实验过程包括2个测试阶段。首次测试(T1)在集训第3周完成。所有运动员于测试日晨起,肘正中静脉采静脉血测血常规,同时离心分离血清,-80℃冰箱保存待测。完成病史和训练情况调查后进行肺功能测试和支气管激发试验,在支气管激发试验前后采用改良Borg scale量表对运动员运动呼吸症状进行评分。第2次测试(T2)于2周后进行,对纳入实验的36名运动员进行回访调查,测试内容同T1一致。
1.2.2 基本情况调查
在进行支气管激发试验前所有运动员完成病史和训练情况调查。采用问卷的形式,在实验人员的监督下完成。病史调查的内容包括:哮喘诊断史、鼻炎等过敏性疾病的现病史和家族史、抗哮喘药物治疗史、运动相关呼吸症状以及吸烟史。有过敏史的运动员,进一步了解过敏原类别(花粉、动物皮屑、粉尘、食物或药物)。训练情况调查的内容包括:运动等级、训练年限、周训练量和训练强度。
1.2.3 血液指标测试
受试者测试日晨起空腹,安静坐位,于肘正中静脉取血1 ml,采入EDTA抗凝负压管用于血常规检测,1 h内完成。取5 ml静脉血离心15 min(3 000 r/min,室温)提取血清,分装并于-80℃冰箱保存待测。血常规采用ABX Pentra 60全血细胞分析仪检测,试剂用原装配套试剂。血清IgE、IL-17采用ELISA法测定,试剂盒由美国R&D公司提供。测试过程严格按照仪器和试剂说明书进行操作。
1.2.4 肺功能测试
采用COSMED Pony FX便携式肺功能检测仪进行肺功能测试,按照美国胸科协会(American Thoracic Society,ATS)推荐方法进行。测试指标包括:肺活量(VC)、用力肺活量(FVC)、1 s用力肺活量(FEV1)、1 s率(FEV1/FVC%)等。
1.2.5 支气管激发试验
支气管激发试验采用场地运动负荷试验(Field-Based Exercise Test,FBT)的激发方式,在50 m泳道的标准室内游泳馆进行。环境温度28℃±2.7℃,相对湿度70%±4.5%,泳池水温27℃±0.3℃。要求受试者完成8 min极量强度运动,心率达到并维持在85%HRmax(HRmax=220-年龄)以上,分别于运动负荷试验开始前以及运动负荷试验结束后1 min、3 min、5 min、7 min、10 min进行肺功能测试,运动负荷试验前后FEV1下降≥10%为EIB阳性的诊断标准[16]。于运动负荷试验结束后进行运动呼吸症状评分(改良Borg scale量表)。实验过程采用Polar表监控并记录心率(RS800CX,芬兰)。
1.3 统计分析
采用SPSS统计软件(SPSS 19.0 for Windows)处理数据。连续变量做正态性检验,符合正态分布则用均数±标准差(±SD)表示,不符合正态分布则以中位数和四分位数间距来描述,分类变量用数值和百分比表示。连续变量的组间比较采用单因素方差分析或Mann-Whitney秩和检验,实验前后比较采用重复测量方差分析或Wilcoxon秩和检验,分类变量的组间比较采用χ2检验。P<0.05表示具有显著性差异。连续变量的相关分析采用Pearson相关分析。
2 结果
2.1 一般情况
两组运动员年龄、身高、体重和训练年限无显著性差异,且测试日前3周所有运动员均无呼吸道感染病史。实验组运动员5名(33%)和对照组运动员9名(42%)有过敏史,组间比较无显著性差异。两组运动员均无哮喘确诊患者,无抗哮喘药物治疗史。训练情况调查结果显示,实验前两组运动员周训练量无显著性差异。实验组10名运动员(66%)和对照组13名运动员(62%)在大强度训练时曾出现咳嗽、喘鸣等呼吸症状,组间比较无显著性差异(表1)。
2.2 肺功能和支气管激发试验
支气管激发试验结果显示,首次试验实验组5名运动员(33%)EIB阳性,其中2人(13%)出现哮喘症状,确定为EIA;而对照组8名运动员(29%)EIB阳性,其中3人(14%)出现哮喘症状,组间比较无显著性差异(表2)。停训2周后,实验组3名运动员(20%)EIB阳性,其中2人首次试验EIB阳性,1人首次试验EIB阴性(图1)。强度训练2周后,对照组10名运动员(48%)EIB阳性,显著高于实验组(P<0.05),其中6人首次试验EIB阳性,4人首次试验EIB阴性(图1)。停训2周后,实验组运动员支气管激发试验FEV1下降程度显著降低(P<0.05),而肺功能测试MEF50%显著升高。2次试验最为严重的呼吸困难均出现在运动负荷试验后即刻,实验组与对照组之间均无显著性差异(表2、图2)。
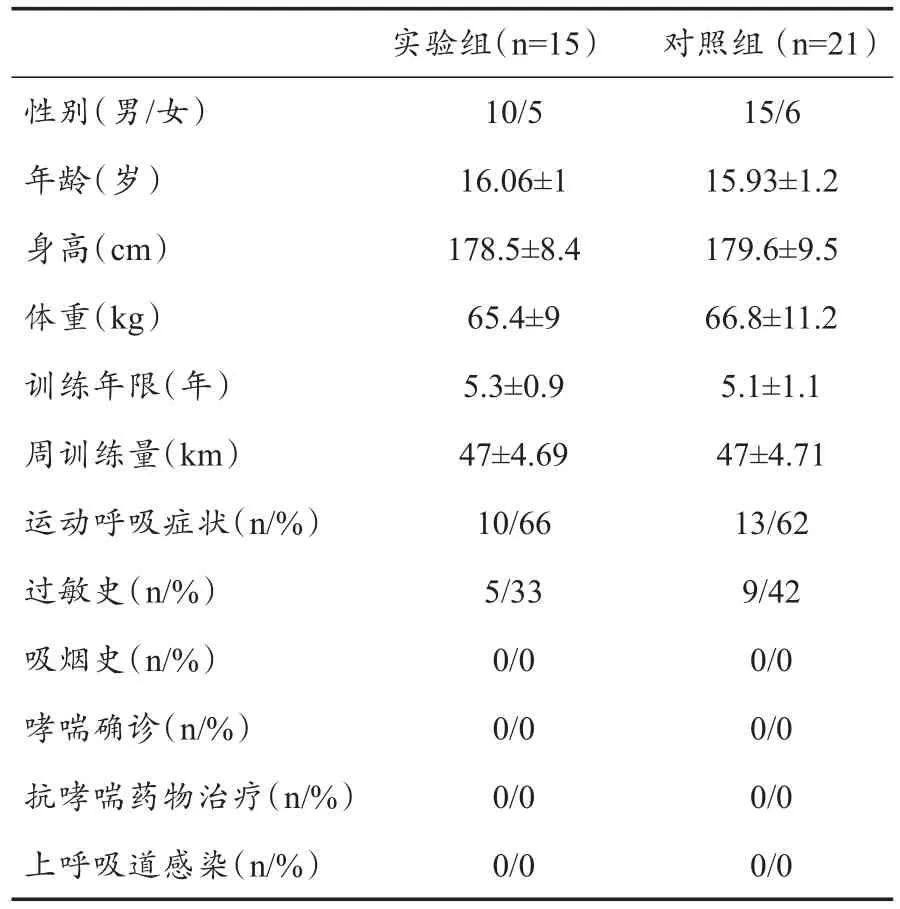
表1 受试者基本情况Table 1 Clinical and training characteristics of study subjects
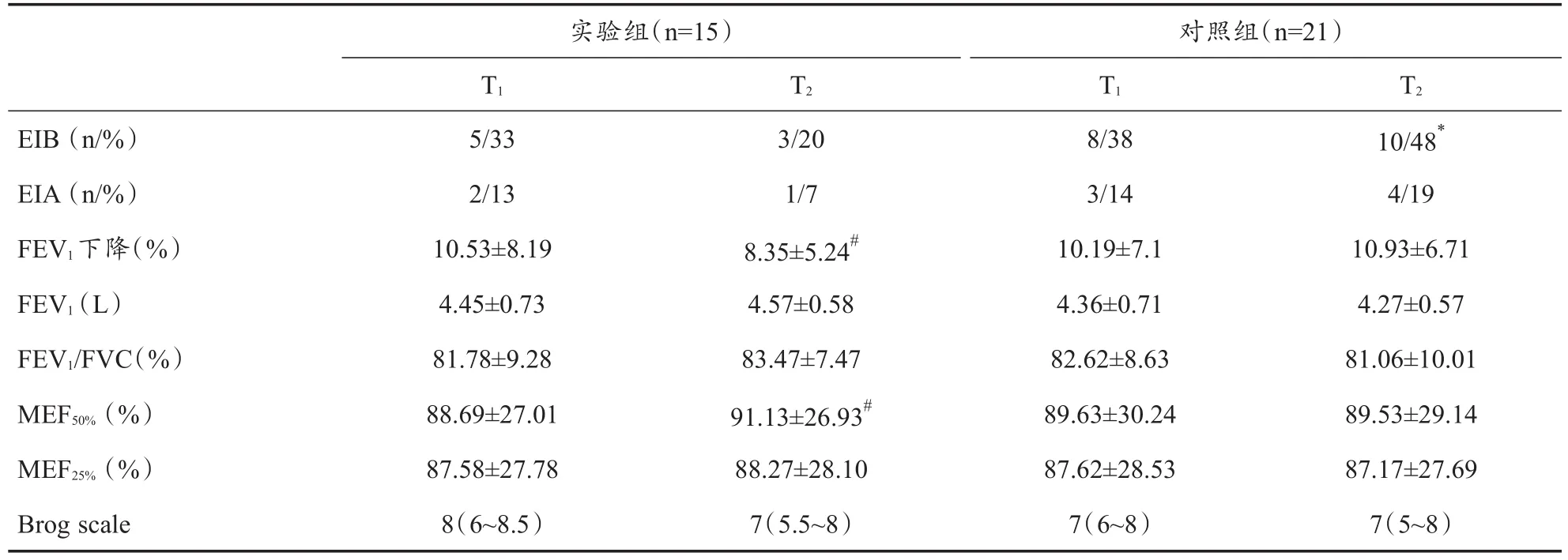
表2 游泳运动员肺功能和支气管激发试验结果Table 2 Subjects’lung function data and bronchial provocation test result
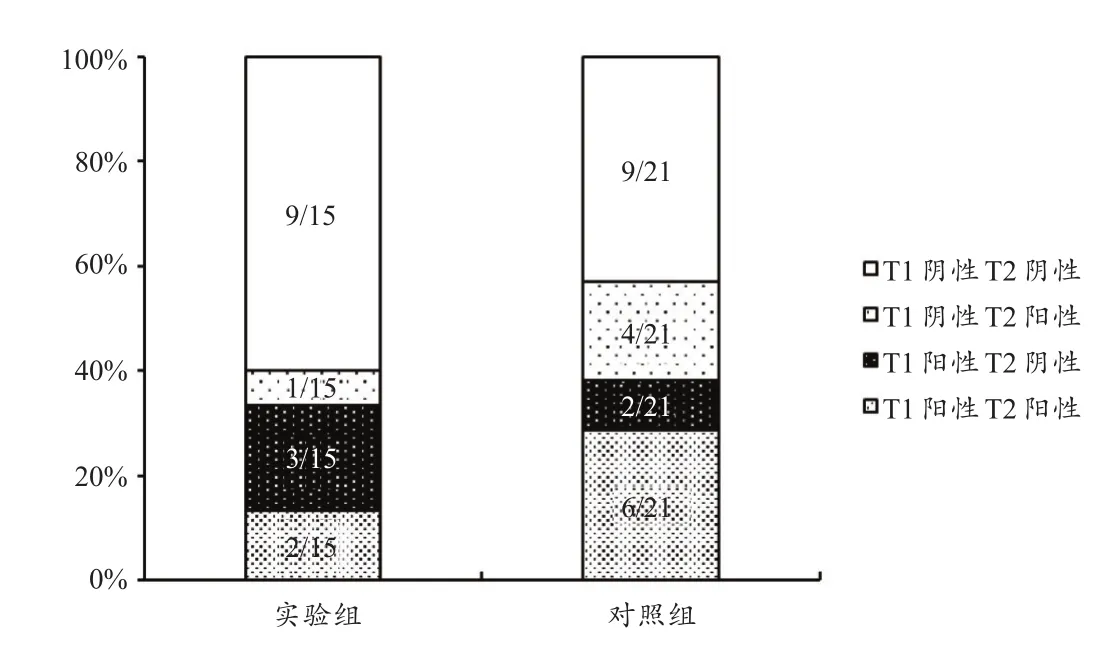
图1 实验组和对照组前后两次支气管激发试验EIB诊断情况Figure 1.Positive/negative diagnosis for EIB at T1 and T2 in experimental group and control group
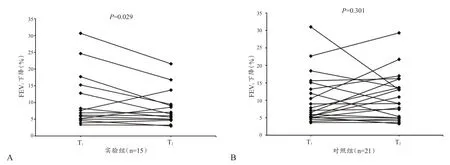
图2 实验组(A)和对照组(B)前后两次支气管激发试验FEV1下降百分比变化Figure 2.The fall in FEV1(%)at T1 and T2 in experimental group and control group
2.3 血液指标测试结果
停训2周后,实验组运动员静脉血中性粒细胞百分比显著降低,中性粒细胞计数显著低于对照组,血清IL-17含量显著降低。实验组运动员中性粒细胞计数同支气管激发试验FEV1下降百分比之间相关性不显著(r=0.323,P>0.05)。2次测试2组运动员血清IgE含量均未发生显著性变化(表3、表4)。
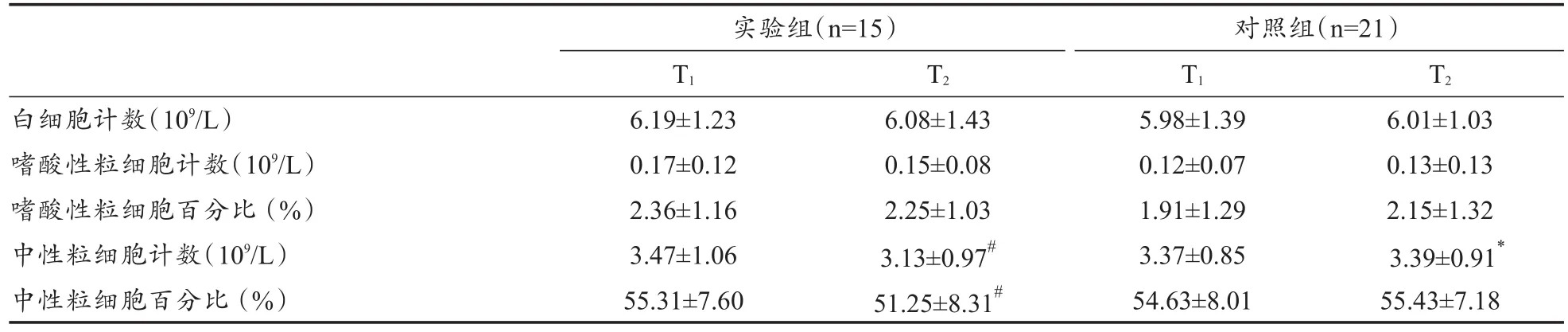
表3 静脉血血常规测试结果Table 3 Blood cell counts in experimental group and control group

表4 血清IgE和IL-17测试结果Table 4 The concentration of serum Immunoglobulin-E and Interleukin-17
3 分析讨论
本研究为对照观察研究,通过分析全国青少年游泳集训医务监督临床资料,探讨游泳运动员EIB的可复性。研究发现,终止训练2周后,实验组运动员支气管激发试验FEV1下降百分比显著减少,而MEF50%显著升高,EIB检出率显著低于持续训练组,其中3名EIB阳性运动员转为阴性。因此认为,短期终止训练可以促进游泳运动员EIB的恢复和肺功能的改善。游泳运动员EIB的患病率可高达76%[7,8,22,29]。周期性运动训练,尤其特殊环境下(氯暴露)的长期训练和比赛,是游泳运动员EIB检出率高于其他项目的原因,AHR是基本病理改变[6,30,31,33]。明确此种病理改变是慢性炎症反应导致的长期持续性改变,还是急性炎症反应引发的暂时性变化,是制定运动员EIB/EIA预防策略和治疗方案的基础。Helenius等[23]首次对游泳运动员EIB的可复性进行研究,发现26名游泳运动员退役5年后,EIB检出率由31%下降到12%,EIA检出率由23%下降到1%,同时诱导痰嗜酸性粒细胞百分比呈现下降趋势。因此认为,游泳运动员的EIB/EIA是由长期训练引起的,终止训练可以促进EIB/EIA的恢复。Bougault等[9]结合竞技游泳训练实际,以年度训练周期中2~4周的常规性训练调整期为切入点,研究短期终止训练对游泳运动员EIB的影响。研究发现,2周调整期结束后19名运动员乙酰甲胆碱激发试验的激发剂量(MCh-PC20)以及等CO2自主过度通气(Eucapnic Voluntary Hyperpnoea,EVH)FEV1下降百分比均显著降低。因此认为,训练因素是引起游泳运动员EIB的主要原因,2周以上的训练调整有利于EIB阳性运动员运动呼吸功能的恢复。参加Bougault等[9]研究的运动员训练调整期依然保持在2±3 h/周的游泳训练,并未完全脱离泳池氯环境,在一定程度上影响了研究结果的有效性。Bohm等[10]同样研究短期终止训练对游泳运动员EIB的影响,发现终止训练并未对运动员MCh-PC20产生影响,认为短期终止训练不足以改善游泳运动员的运动呼吸功能。同Bougault等相比,Bohm等严格限制了训练终止期的训练量和训练强度,但仅采用乙酰甲胆碱激发试验的方式来评估运动员的气道反应性降低了研究结果的可靠性。乙酰甲胆碱激发试验具有良好的可重复性[36],但是鉴于运动员EIB的病理机制不同于一般人群,这种方法并不完全适用于运动员群体[24]。比较而言,本研究采用的运动激发试验更为合理,结果更为可靠。此外,Bougault等[6]采用纤维支气管镜对游泳运动员支气管粘膜进行组织活检,发现了杯状细胞增生、粘液分泌增加以及粘膜下I型和Ⅲ型胶原蛋白表达增加、腱糖蛋白沉积等慢性炎症和气道重塑的客观证据,证明了游泳运动员AHR为持续性病理变化的可能性,但其研究对象的年龄相对较大,训练年限相对较长。本研究认为,气道重塑的病理改变可能同训练年限有关,年龄较小,训练年限较短是本研究游泳运动员EIB具有可复性的重要条件之一。
本研究36名游泳运动员共检出13名EIB阳性,占所有运动员的36%。同Helenius等[23](组胺激发,36%)的研究结果一致,略低于Bougault等[9](乙酰甲胆碱激发和/或EVH,63%)和Bohm等[10](乙酰甲胆碱激发,52%)的研究结果。2009年,梁辰等[1]首次对中国游泳运动员肺功能异常进行调查,发现21名国家队运动员中有4名EIB阳性,检出率仅为19%。Langdeau等[29]研究训练环境对竞技运动员运动呼吸功能的影响,发现潮湿环境下训练的游泳运动员EIB检出率高达76%。造成结果差异较大的原因包括研究所采用的支气管激发试验方式不同和运动员训练环境存在差异2个方面。支气管激发试验包括直接激发试验和间接激发试验2种类型,直接激发试验最长用的有组胺激发和乙酰甲胆碱激发2种方式。引起相同程度的支气管平滑肌收缩,组胺激发可引起包括头痛、皮肤潮红等全身性不良反应,而乙酰甲胆碱激发无上述不良反应且具有更好的可重复性,是IOC-MC唯一认可的用于评估运动员气道功能的直接激发方式[36]。间接支气管激发试验包括运动激发试验、EVH、甘露醇干粉和高渗盐水激发试验。其中,运动激发试验为本研究和梁辰等[1]所采用的激发方式,同Langdeau等[29]所采用的乙酰甲胆碱激发试验相比特异性更高,但敏感性较低[19]。EVH同样属于间接支气管激发试验,作为IOC-MC推荐的运动员支气管激发试验“金标准”,具有更高的特异性和敏感性,是目前运动员EIB最可靠的检测手段[20]。但是,EVH操作复杂,设备昂贵,不适用于大规模筛查。不同于梁辰等[1]所采用的实验室运动激发(Laboratory-Based Exercise Test,LBT),本研究采用了场地运动激发(Field-Based Exercise Test,FBT)的方式。LBT在实验室条件下进行,其局限性包括:1)实验室条件下无法获得预期的运动强度而不能产生优秀运动员所需要的激发效果[25];2)LBT所采用的运动方式并不具备项目的专项特点,试验结果同实际运动过程中出现的相关症状并无特定关系[3]。FBT则采用运动员专项的主要运动模式进行负荷试验,能够更准确的反映运动员呼吸症状同训练实际之间的关系[25]。梁辰等[1]对LBT和FBT 2种方式的筛查效果进行对比研究,发现LBT激发EIB阳性的运动员采用FBT激发时均转为阴性,认为游泳馆湿度较大是影响FBT激发效果的主要原因。本研究认为,无论何种运动激发方式,试验前严格限制研究对象的体力活动非常必要。研究显示,训练前热身、间歇性大强度的训练方式均有利于运动终止后支气管周围血管血流和气道粘膜表面水分的恢复,进而抑制EIB的发生[11,28]。因此,试验前任何形式的体力活动,均有利于机体产生运动诱发支气管反应的不应期而影响激发效果。梁辰等虽然将FBT安排在LBT结束48 h后进行,有效避免了前后2次试验之间的相互影响,但并未对实验前运动员的训练或运动情况进行明确限制。此外,训练环境差异是影响运动员EIB检出率的另一重要因素。本次集训游泳池游离氯(0.75 mg/L)、三卤甲烷(170 μg/L)含量虽在游泳池水质标准(CJ244-2007)规定的正常范围内,但处于正常高值。加之时值冬季,游泳馆闭窗保暖通风不良,泳池水面含氯微粒势必增多,这也是本研究运动员EIB检出率相对较高的可能原因之一。
遗传性过敏症、项目特点和训练环境因素是运动员EIB/EIA的主要风险因素[12]。对于游泳运动员而言,泳池氯暴露条件下周期性耐力训练,反复发生的过度通气导致呼吸道粘膜上皮细胞受损并引发炎性反应,是EIB/EIA检出率高于其他项目的可能原因[4,26,30]。Bernard等[13]的流行病学研究发现,6~14岁儿童每周参加室内游泳训练的时间长短不仅同EIB检出率和哮喘患病率显著相关,而且,同血清肺表面活性相关蛋白A(Surfactant associated proteins A,SP-A)以及SP-B含量存在明显剂量-效应关系,池边停留1 h便可引起血清SP-A和SP-B含量显著升高,说明泳池氯暴露可引起支气管上皮损伤和渗透性增加。Bougault等[6]采用纤维支气管镜进行组织活检,证明了游泳运动员支气管粘膜存在上皮损伤修复的慢性炎症反应和气道重塑的病理变化。Helenius等[22]研究发现,游泳运动员EIB检出率显著高于健康对照组,诱导痰嗜酸性粒细胞百分比、嗜酸性粒细胞过氧化物酶含量亦显著高于健康对照组,说明过敏性炎症反应在游泳运动员EIB产生过程中发挥一定作用。本研究前后2次测试2组运动员静脉血嗜酸性粒细胞百分比、嗜酸性粒细胞计数以及血清IgE含量均未发生显著变化。所有运动员无过敏性哮喘诊断史,且整个实验过程在冬季进行,有效避免了季节性环境变应原引发的过敏反应,是本研究两组运动员静脉血嗜酸性粒细胞未发生显著变化的原因。研究显示,氯仿等有机物吸入引起的呼吸道上皮损伤本质是一种氧化应激损伤,中性粒细胞炎性反应是其主要特点[34,38]。Bonetto等[14]对10名因意外泳池氯暴露引发急性肺损伤的儿童进行跟踪调查,发现除肺功能受损外,所有患者血清CC16蛋白含量和FeNO均显著增加,说明呼吸道上皮损伤并发生炎性反应,而呼出气冷凝物LT84含量增加则说明呼吸道炎性反应以中性粒细胞浸润为主。McGovern等[35]的动物实验同样证明,中性粒细胞炎性反应是氯化物吸入引发上皮损伤导致AHR的主要原因。而IL-17是一类促炎细胞因子,可以促进支气管纤维母细胞、上皮细胞和平滑肌细胞活化,增加IL-6、IL-8、G-CSF等细胞因子的表达,促使中性粒细胞在呼吸道局部浸润增殖,加重呼吸道炎性反应[2,40]。由此可见,终止训练、脱离泳池含氯环境是本研究实验组运动员2周后静脉血中性粒细胞含量显著降低,血清IL-17含量显著减少的可能原因。但是,本研究实验组运动员静脉血中性粒细胞计数同支气管激发试验FEV1下降百分比之间的相关性并不显著,因此,不能明确此种炎性细胞变化同运动员运动肺功能变化之间的具体关系。
本研究大强度训练时曾出现运动相关呼吸症状的运动员多数支气管激发试验阴性,而EIB阳性运动员中仅有5名出现运动诱发支气管收缩的哮喘类症状而确诊为EIA。并且,本研究支气管激发试验后,2组运动员运动呼吸症状评分(改良Brog scale量表)无显著性差异,说明主观呼吸症状并不能反应运动诱发支气管收缩的客观事实。Rundell等[39]研究发现,通过症状问诊虽然能够对运动员EIA的患病率进行合理预估,但是,使用主观症状问诊的方式进行筛查不仅会出现误诊,同样会出现漏诊。Bohm等[10]研究发现,大多数存在AHR的游泳运动员并无明显临床症状,而且游泳运动员同一般健康人群运动诱发支气管收缩的主观症状并无显著性差异,因此认为,支气管激发试验的客观证据是运动员EIB/EIA明确诊断的必要条件。美国过敏、哮喘、免疫学学会(American Academy of Allergy,Asthma and Immunology,AAAAI)的工作组报告指出,不能单纯依靠主观症状进行EIB/EIA的临床诊断[27],IOC-MC要求所有治疗性使用β2受体激动剂的运动员必须提供EIB诊断的客观证据[41],更加明确了支气管激发试验的客观诊断的重要性。此外,Park等[37]对2004—2012年间133份EIB/EIA的临床病例资料进行回顾性分析,分别从危险因素、炎性反应特点等方面研究EIB同EIA的本质区别,研究发现,EIB更容易受环境因素的影响,或许是一种不同于EIA的独特的临床类型。
4 总结
本研究基于对全国青少年游泳集训期间运动员医务监督临床资料的回顾性分析,采用对照观察的研究方法探讨游泳运动员EIB的可复性。样本量的大小在一定程度上限制了论证强度,这是针对高水平竞技运动员的研究所不可避免的问题。本研究研究结果显示,游泳运动员EIB的发生同运动训练有关,短期终止训练在一定程度上可以促进运动员EIB的恢复。大多数EIB阳性游泳运动员并无运动相关支气管收缩的哮喘类症状,支气管激发试验的客观证据是EIB明确诊断的必要条件。训练环境因素在游泳运动员EIB/EIA或者AHR的发生发展过程中发挥重要作用,日常训练应保证游泳池良好的水质标准,并加强室内通风。将泳池氯化物浓度控制在0.3 mg/m³以内具有良好的预防效果,而良好的通风(≥60 m³/h)可以有效降低游泳馆室内空气氯胺浓度[17]。EIB是否会影响游泳运动员的运动能力以及长期大强度训练EIB阳性运动员AHR的病理转归是未来研究的方向。
[1]梁辰,马云,李国平.中国优秀游泳运动员肺功能异常相关因素分析[J].中国运动医学杂志,2009,28(6):612-615.
[2]赵银霞,许化溪.白细胞介素17细胞因子家族与支气管哮喘[J].中华哮喘杂志(电子版),2010,4(3):218-221.
[3]ANDERSON S D.Indirect challenge tests:airway hyperresponsiveness in asthma:its measurement and clinical significance[J].Chest J,2010,138(2_suppl):25S-30S.
[4]ANDERSOM S D,KIPPELEN P.Airway injury as a mechanism for exercise-induced bronchoconstriction in elite athletes[J].J Allergy Clini Immunol,2008,122(2):225-235.
[5]BUSSOTTI M,DI MARCO S,MARCHESE G.Respiratory disorders in endurance athletes-how much do they really have to endure?[J].Open Access J Sports Med,2014,5:47.
[6]BOUGAULT V,LOUBAKI L,JOUBERT P,et al.Airway remodeling and inflammation in competitive swimmers training in indoor chlorinated swimming pools[J].J Allergy Clinical Immunol,2012,129(2):351-358.
[7]BOUGAULT V,TURMEL J,BOULET L P.Bronchial challenges and respiratory symptoms in elite swimmers and winter sport athletes:airway hyperresponsiveness in asthma:its measurement and clinical significance[J].Chest J,2010,138(2_suppl):31S-37S.
[8]BOUGAULT V,BOULET L P.Airway dysfunction in swimmers[J].Br J Sports Med,2012,46(6):402-406.
[9]BOUGAULT V,TURMEL J,BOULET L P.Airway hyperresponsiveness in elite swimmers:is it a transient phenomenon?[J].J Allergy Clini Immunol,2011,127(4):892-898.
[10]BOHM P,HECKSTEDEN A,MEYER T.Impact of a shortterm water abstinence on airway hyperresponsiveness in elite swimmers[J].Clinical J Sport Med,2016,0(0):1-5.
[11]BOULT L P,O’BYRNE P M.Asthma and exercise-induced bronchoconstriction in athletes[J].New England J Med,2015,372(7):641-648.
[12]BONIMI M,LAPUCCI G,PETRELLI G,et al.Predictive value of allergy and pulmonary function tests for the diagnosis of asthma in elite athletes[J].Allergy,2007,62(10):1166-1170.
[13]BERNARDA,CARBONNELLE S,MICHELO,et al.Lung hyperpermeability and asthma prevalence in schoolchildren:unexpected associations with the attendance at indoor chlorinated swimming pools[J].Occup Environ Med,2003,60(6):385-394.
[14]BONETTO G,CORRADI M,CARRARO S,et al.Longitudinal monitoring of lung injury in children after acute chlorine exposure in a swimming pool[J].Am J Respiratory Critical Care Med,2006,174(5):545-549.
[15]COCKCROFT D W,DAVIS B E.Mechanisms of airway hyperresponsiveness[J].J Allergy Clinical Immunol,2006,118(3):551-559.
[16]CASTRICUM A,HOLZER K,BRUKNER P,et al.The role of the bronchial provocation challenge tests in the diagnosis of exercise-induced bronchoconstriction in elite swimmers[J].Br J Sports Med,2010,44(10):736-740.
[17]CARBONNELLE S,BERNARD A,DOYLE I R,et al.Fractional exhaled NO and serum pneumoproteins after swimming in a chlorinated pool[J].Med Sci Sports Exerc,2008,40(8): 1472-1476.
[18]DICHINSON J W,WHYTE G P,MCCONNELL A K,et al. Impact of changes in the IOC-MC asthma criteria:a British perspective[J].Thorax,2005,60(8):629-632.
[19]ELIASSON A H,PHILLIPS Y Y,RAJAGOPAL K R,et al. Sensitivity and specificity of bronchial provocation testing.An evaluation of four techniques in exercise-induced bronchospasm[J].Chest J,1992,102(2):347-355.
[20]FITCH K D,SUE-CHU M,ANDERSON S D,et al.Asthma and the elite athlete:summary of the International Olympic Committee's consensus conference,Lausanne,Switzerland,January 22-24,2008[J].J Allergy Clin Immunol,2008,122(2):254-260.
[21]HULL J H,RAWLINS J C.Screening for cardiac and respiratory problems in elite sport-compare and contrast[J].Expert Review Respir Med,2016,10(7):715-717.
[22]HELENIUS I J,RYTILA P,METSO T,et al.Respiratory symptoms,bronchial responsiveness,and cellular characteristics of induced sputum in elite swimmers[J].Allergy,1998,53(4):346-352.
[23]HELENIUS I J,RYTILA P,SARNA S,et al.Effect of continuing or finishing high-level sports on airway inflammation,bronchial hyperresponsiveness,and asthma:A 5-year prospective follow-up study of 42 highly trained swimmers[J].J Allergy Clin Immunol,2002,109(6):962-968.
[24]HOLZER K,ANDERSON S D,DOUGLASS J.Exercise in elite summer athletes:challenges for diagnosis[J].J Allergy Clin Immunol,2002,110(3):374-380.
[25]HOLZER K,DOUGLASS J.Exercise induced bronchoconstriction in elite athletes:Measuring the fall[J].Thorax,2006,61(2):94-96.
[26]HALLSTRAND T S,ALTEMEIER W A,AITKEN M L,et al.Role of cells and mediators in exercise-induced bronchoconstriction[J].Immunol Allergy Clinics North Am,2013,33(3):313-328.
[27]INTERNATIONAL OLYMPIC COMMITTEE.IOC Consensus Statement on Asthma in Elite Athletes.Lausanne:International Olympic Committee[EB/OL].https://stillmed.olympic.org/.
[28]KIPPELEN P,FITCH K D,ANDERSON S D,et al.Respiratory health of elite athletes preventing airway injury:a critical review[J].Br J Sports Med,2012,46(7):471-476.
[29]LANGDEAU J B,TURCOTTE H,BOWIE D M,et al.Airway hyperresponsiveness in elite athletes[J].Am J Respir Critical Care Med,2000,161(5):1479-1484.
[30]LOMAX M.Airway dysfunction in elite swimmers:prevalence,impact,and challenges[J].Open Access J Sports Med,2016,7:55.
[31]LEVAI I K,HULL J H,LOOSEMORE M,et al.Environmental influence on the prevalence and pattern of airway dysfunction in elite athletes[J].Respirology,2016.Doi:10.1111/resp.12859.
[32]MOREIRA A,DELGADO L,CARLSEN K H.Exercise-induced asthma:why is it so frequent in Olympic athletes?[J]. Expert Review Respir Med,2011,5(1):1-3.
[33]MORISSETTE M C,MURRAY N,TURMEL J,et al.Increased exhaled breathe condensate 8-isoprostane after a swimming session in competitive swimmers[J].Eur J Sport Sci,2016,16(5):569-576.
[34]MCGOVERN T K,CHEN M,ALLARD B,et al.Neutrophilic oxidative stress mediates organic dust-induced pulmonary inflammation and airway hyperresponsiveness[J].Am J Physiology-Lung Cellular Molecular Physiol,2016,310(2):L155-L165.
[35]MCGOVERN T K,GOLDBERGER M,ALLARD B,et al. Neutrophils mediate airway hyperresponsiveness after chlorineinduced airway injury in the mouse[J].Am J Respir Cell Mol-Biology,2015,52(4):513-522.
[36]PRICE O J,HULL J H,ANSLEY L.Advances in the diagnosis of exercise-induced bronchoconstriction[J].Expert Rev Respir Med,2014,8(2):209-220.
[37]PARK H K,JUNG J W,CHO S H,et al.What makes a difference in exercise-induced bronchoconstriction:an 8 year retrospective analysis[J].PloS one,2014,9(1):e87155.
[38]WHITE C W,MARTIN J G.Chlorine gas inhalation:human clinical evidence of toxicity and experience in animal models[J].Proc Am Thoracic Soc,2010,7(4):257-263.
[39]RUNDELL K W,IM J,MAYERS L B,et al.Self-reported symptoms and exercise-induced asthma in the elite athlete[J]. Med Sci Sports Exe,2001,33(2):208-213.
[40]TANAKA S,YOSHIMOTO T,NAKA T,et al.Natural occurring IL-17 producing T cells regulate the initial phase of neutrophil mediated airway responses[J].J Immunol,2009,183(11):7523-7530.
[41]WEILER J M,BONINI S,COIFMAN R,et al.American Academy of Allergy,Asthma&Immunology work group report:exercise-induced asthma[J].J Allergy Clinical Immunol,2007,119(6):1349.
The Reversibility of Exercise-induced Brochoconstriction in Swimmers
SONG Xiao-bo1,2,LU Yi-fan2,WANG Bin1,YAN Hui-ping2
Objective:To investigate the effect of training break on airway hyper-responsiveness and pulmonary function and to evaluate the reversibility of EIB in swimmers.Methods:Thirty-six adolescent swimmers(average age:15.97±1.1 years)participate in our research.All of the swimmers completed resting spirometry test and bronchial provocation test at baseline and follow-up. Fifteen of the swimmers who had stopped training more than 2 weeks before the follow-up examination were selected as experimental group and twenty-one swimmers who had continued their intensity training were taken as control.Result:1)Thirteen swimmers(36%)showed EIB at T1,five in experimental group(33%)and eight in control group(38%).There was no significant difference between groups.2)Only five swimmers(14%)showed EIA at T1,two in experimental group(13%)and three in control group(14%).There was no significant difference between groups.3)After two weeks,there were 3 EIB positive athletes turned negative.The prevalence of EIB in experimental group was significantly lower than control(20%vs.48%,P<0.05).Significant decrease in declines of FEV1(10.53±8.19 vs.8.35±5.24,P<0.05)and significant rise in MEF50%(88.69±27.01 vs 91.13±26.93,P<0.05)were observed in experimental group only.4)After two weeks,significant decrease of percentage of neutrophils(55.31±7.60 vs.51.25±8.31,P<0.05)and neutrophil count(3.47±1.06 vs.3.13±0.97,P<0.05)were observed in experimental group.There was a significant difference in neutrophil count between groups(3.13±0.97 vs.3.39± 0.91,P<0.05).No relation was found between neutrophil count and the declines of FEV1(r= 0.323,P>0.05).Neither group experienced any significant change in serum IgE.Conclusions:1)Training may contribute to the development of airway hyperresponsiveness in swimmers and the EIB of swimmers is partly reversible.2)The majority of swimmers with EIB are asymptomatic,so the definitive diagnosis must depend on the objective evidence of bronchial provocation tests.
Swim;Exercise induced bronchoconstriction;Airway hyper-responsiveness;Reversibility
1002-9826(2017)02-0011-07
10.16470/j.csst.201702002
G804.5
:A
2016-09-07;
:2017-01-10
中央高校基本科研业务费专项资金资助课题(2015ZD001)。
宋小波,男,博士,主要研究方向为医务监督和训练监控,E-mail:songxiaobohcc@hotmail.com。
1.华中师范大学,湖北 武汉430079;2.北京体育大学,北京100084
1.Central China Normal University,Wuhan 430079,China;2.Beijing Sport University,Beijing 100084,China.

