清肝益肾祛风复方对自发性高血压大鼠血压及胸腺的干预作用研究*
丁李立强,贾成林,陈 瑜,2**,张 腾,2**
(1.上海中医药大学附属岳阳中西医结合医院 上海 200437;2.上海市中医药研究院中西医结合临床研究所 上海 200437)
本课题组依据高血压病因病机,结合古代经典复方和临床实践经验自拟清肝益肾祛风复方用以治疗高血压,获得较好的治疗效果。本实验将通过使用清肝益肾祛风复方干预自发性高血压大鼠(Spontaneously hypertensive rat,SHR)模型,观察其对SHR的血压及胸腺的治疗干预作用,初步探讨清肝益肾祛风复方治疗高血压的相关机制。
1 材料与方法
1.1 实验动物
SPF级WKY和SHR雄性大鼠,4周龄,体重80-100 g,购自北京维通利华有限公司,动物许可证号:SCXK(京)2012-0001。
1.2 药物与试剂
清肝益肾祛风复方(QYQ)所含中药材均购自上海康桥药业有限公司:制黄精(批号151021),夏枯草(批号1608111),炒黄芩(批号151106),益母草(批号160818),石决明(批号160326),柴胡(批号160921),桑寄生(批号160813),川牛膝(批号160701),川芎(批号160824),防风(批号160718),羌活(批号160129),黄连(批号160913);坎地沙坦酯片(Candesartan Cilexetil Tablets,Can,日本武田药品工业株式会社,批准文号:国药准字J20150085)。
1.3 仪器设备
大、小鼠无创血压计(型号:BP-98A Series,北京软隆Softron生物技术有限公司);电子天平(型号:FA1004B,上海精密科学仪器有限公司);石蜡切片机(型号:RM2235,Leica);正置显微镜(型号:DM2000,Leica)。
1.4 动物分组与处理
将WKY大鼠作为空白组(WKY组),SHR大鼠随机分为模型对照组(SHR组),清肝益肾祛风复方治疗组(QYQ组),坎地沙坦治疗组(Can组)。清肝益肾祛风中药组方(川芎15 g、柴胡15 g、黄连6 g、羌活15 g、防风15 g、夏枯草30 g、川牛膝15 g、黄精15 g、石决明20 g、炒黄芩15 g、桑寄生15 g、益母草30 g)各药材采用中药常规煎煮法,按照人体剂量6.3倍换算后浓缩灌胃,给药体积2 mL,每日1次;坎地沙坦酯片用pH值为6.4的磷酸盐缓冲液(PBS)溶解,按照人体剂量换算以1 mg·kg-1的剂量灌胃,给药体积2 mL,每日1次;模型对照组和空白组给予等体积的饮用水灌胃,实验期间自由饮水、进食。
各组大鼠在6周龄时开始灌胃,持续至20周龄,所有大鼠在灌胃前禁食12 h,并统一在灌胃后1 h使用大鼠无创血压计测量血压情况,每2周测量1次。分别在大鼠第4、8、12、20周龄时,处死各组部分大鼠,剥离胸腺并称重,石蜡包埋后切片,进行HE染色,使用Image Pro Plus 6.0图像分析处理软件进行定量分析。
1.5 统计与分析
运用SPSS 20.0统计软件进行统计分析,计量资料以均数±标准差(±s)表示,使用单因素方差(oneway ANOVA)分析各组血压差异,组间比较采用LSD方法。取P<0.05为显著性水平,P<0.01作为有极显著性统计学意义。
2 结果
2.1 各组大鼠收缩压水平变化情况
如图1所示,对比于WKY大鼠,SHR大鼠的血压在6周龄开始逐步上升,在8周龄时收缩压已达到170 mmHg左右,从10周龄开始直至20周龄收缩压维持在200 mmHg左右,6周龄开始SHR组收缩压均显著高于WKY组(p<0.01);使用清肝益肾祛风复方(QYQ)在6周龄始开始干预,可见QYQ组在8周龄血压较SHR模型组显著降低(p<0.01),从8周龄开始至20周龄,QYQ组的收缩压均显著低于SHR组(p<0.01);虽然QYQ组血压仍高于WKY组与Can组,但QYQ对SHR大鼠血压的降低仍是十分显著的,在20周龄时,与QYQ组与SHR模型组对比能降低50 mmHg左右的血压。
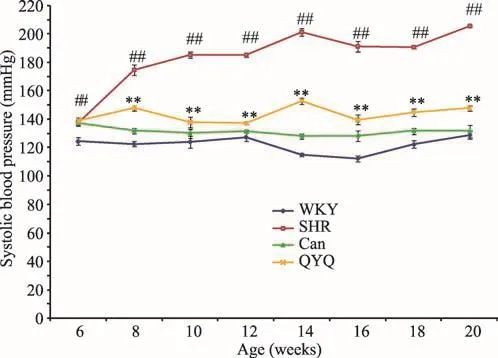
图1 各组大鼠从6至20周龄的收缩压变化情况

图2 各组大鼠在4-20周龄时胸腺指数变化情况
2.2 不同周龄的各组大鼠胸腺指数的差异情况
胸腺指数(Thymus index)=胸腺质量(mg)÷大鼠体质量(g)×10,如图2所示,在4周龄及8周龄时,SHR大鼠胸腺指数均大于WKY大鼠(p<0.05);在6周龄开始药物灌胃干预后,8周龄的QYQ组大鼠胸腺指数显著高于SHR组(p<0.01),而8周龄时Can组的大鼠胸腺指数也高于SHR但差异无统计学意义(p>0.05);在12周龄和20周龄时各组之间的胸腺指数均无显著差异(p>0.05)。
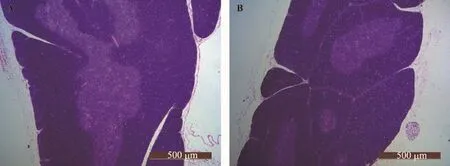
图3 4周龄时WKY与SHR大鼠胸腺组织形态学比较
表1 4周龄时WKY组与SHR组胸腺病理切片面积比较(±s)

表1 4周龄时WKY组与SHR组胸腺病理切片面积比较(±s)
2.3 不同周龄各组大鼠胸腺病理形态学的改变
如图3与表1所示,4周龄时两组大鼠的胸腺被膜完整,皮质较厚,髓质边界清晰,WKY大鼠髓质多相互连接成片状,而SHR大鼠胸腺多为散在同心圆形状分布;SHR大鼠胸腺的髓质、皮质及总面积均略少于WKY大鼠,但差异无显著性(p>0.05)。
如图4与表2所示,8周龄时WKY大鼠及SHR大鼠胸腺开始萎缩,皮质和髓质面积减少,WKY大鼠髓质边界清楚,SHR髓质边界较模糊,而QYQ组和Can组髓质边界都较清晰;SHR大鼠胸腺的髓质、皮质及总面积均稍大于WKY大鼠,但差异无显著性(p>0.05);而QYQ组大鼠髓质、皮质及总面积有明显增多,其中髓质面积大于WKY组与SHR组但差异无显著性(p>0.05),皮质面积显著大于WKY组(p<0.01)和SHR组(p<0.01),胸腺总面积也大于WKY组(p<0.01)和SHR组(p<0.05);同时Can组大鼠髓质、皮质及总面积也均大于WKY组(p<0.05),而其大于SHR组但差异无显著性(p>0.05);QYQ组与Can组大鼠之间的髓质、皮质及总面积差异无统计学意义(p>0.05),Can组大鼠髓质面积占总面积比率高于QYQ组(p<0.05)。
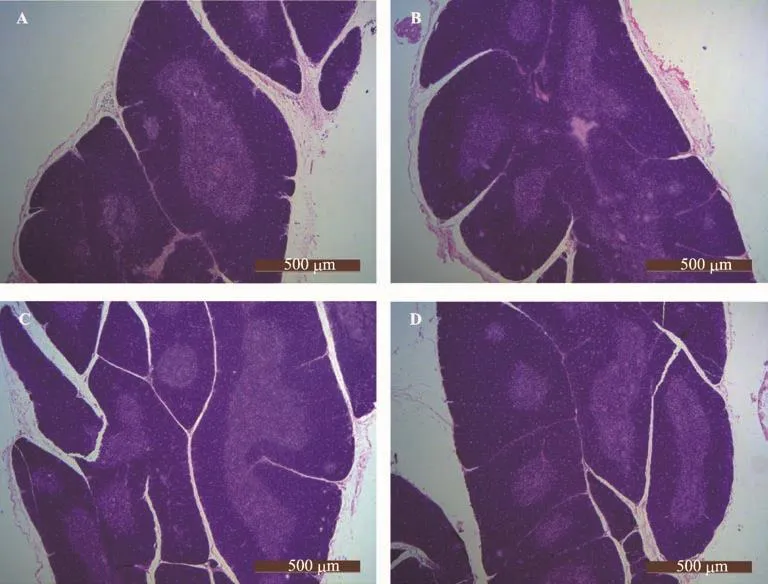
图4 8周龄各组大鼠胸腺组织形态学改变
表2 8周龄时各组胸腺病理切片面积比较(±s)
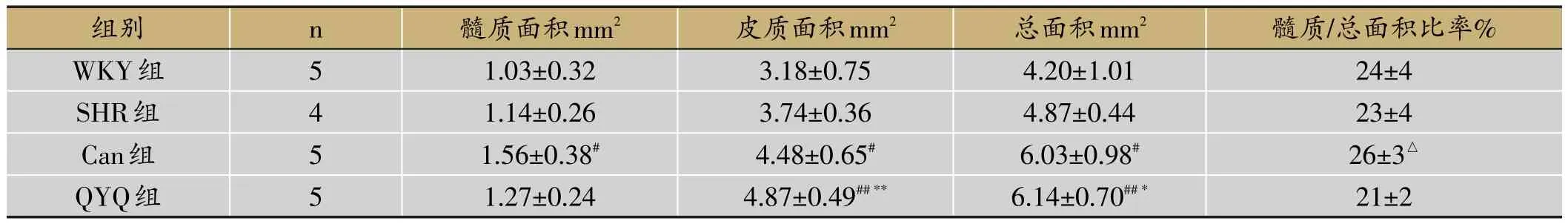
表2 8周龄时各组胸腺病理切片面积比较(±s)
注:与WKY组比较#P<0.05,##P<0.01;与SHR模型组比较*P<0.05,**P<0.01;与QYQ组比较△P<0.05
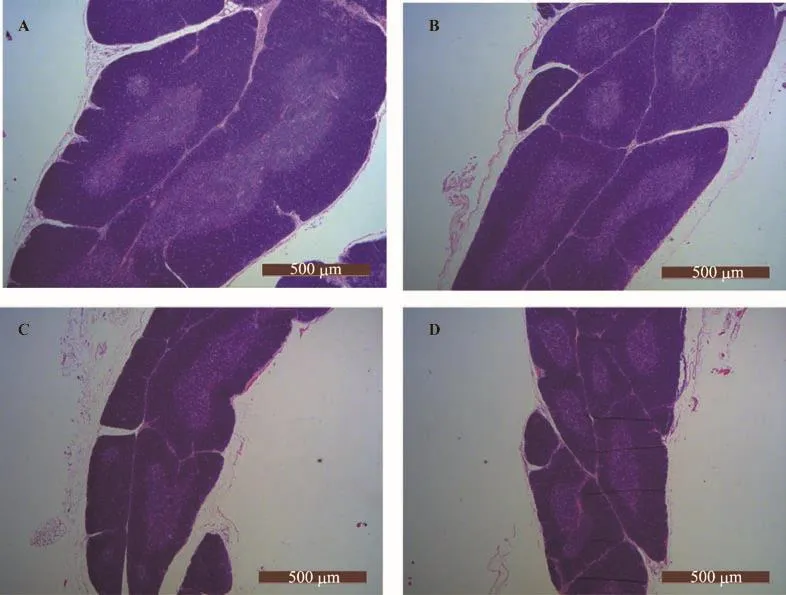
图5 12周龄各组大鼠胸腺组织形态学改变
表3 12周龄时各组胸腺病理切片面积比较(±s)
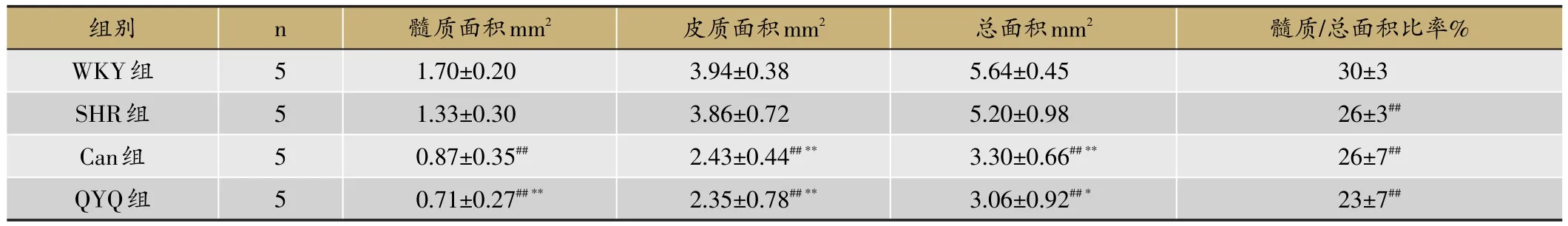
表3 12周龄时各组胸腺病理切片面积比较(±s)
注:与WKY组比较##P<0.01;与SHR模型组比较*P<0.05,**P<0.01。
如图5与表3所示,12周龄时各组大鼠胸腺萎缩明显,皮质萎缩、变薄,髓质面积减少,而WKY大鼠髓质边界较清楚,而SHR髓质边界模糊,其髓质面积占总面积比率显著低于WKY组大鼠(p<0.01),SHR组的髓质、皮质及总面积均小于WKY组,但差异无统计学意义(p>0.05);QYQ组大鼠髓质、皮质及总面积减少,髓质面积小于WKY组(p<0.01)与SHR组(p<0.01),皮质面积小于WKY组(p<0.01)和SHR组(p<0.01),其胸腺总面积小于WKY组(p<0.01)和SHR组(p<0.05);Can组大鼠大鼠髓质、皮质及总面积也减少,髓质面积小于WKY组(p<0.01),皮质面积小于WKY组(p<0.01)和SHR组(p<0.01),其胸腺总面积小于WKY组(p<0.01)和SHR组(p<0.01);QYQ组与Can组大鼠之间的髓质、皮质、总面积及髓质占总面积比率差异无统计学意义(p>0.05)。
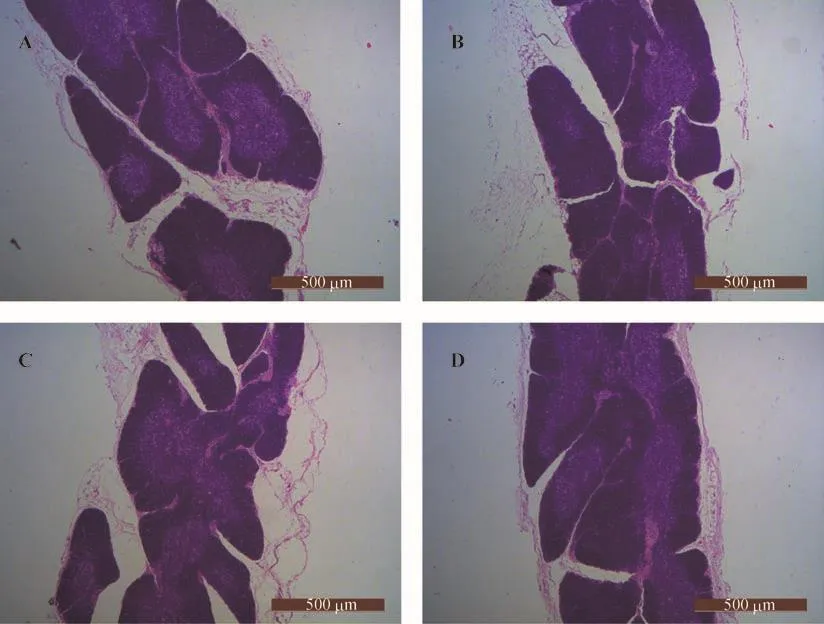
图6 20周龄各组大鼠胸腺组织形态学改变
表4 20周龄时各组胸腺病理切片面积比较(±s)
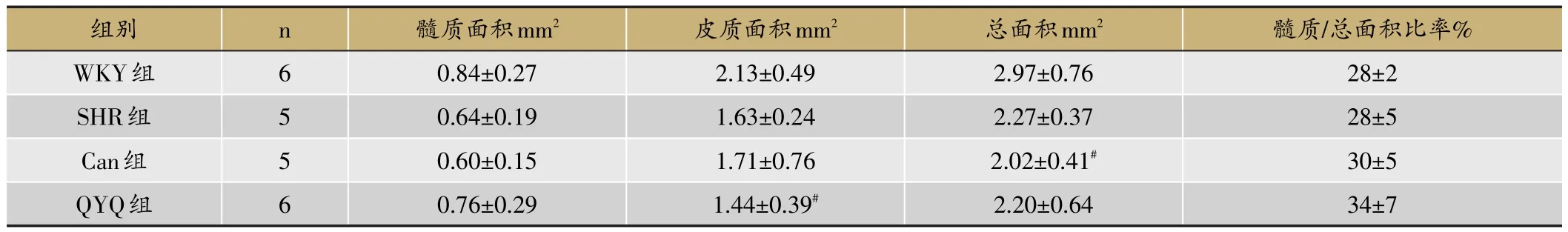
表4 20周龄时各组胸腺病理切片面积比较(±s)
注:与WKY组比较#P<0.05。
如图6与表4所示,20周龄时各组大鼠胸腺显著萎缩,皮质明显萎缩、变薄,SHR大鼠胸腺萎缩情况较WKY大鼠明显,髓质边界模糊,其髓质、皮质及总面积均低于WKY组大鼠,而差异无统计学意义(p>0.05);SHR大鼠模型组与各治疗组之间髓质、皮质及总面积均无明显差异;QYQ组的髓质面积略大于SHR组,但差异无显著性(p>0.05),皮质面积小于WKY组(p<0.05);Can组胸腺总面积小于WKY组(p<0.05);另外,QYQ组和Can组髓质面积占总面积比率要高于SHR组,但差异无显著性(p>0.05);QYQ组与Can组大鼠之间的髓质、皮质、总面积及髓质占总面积比率差异无统计学意义(p>0.05)。
3 讨论
胸腺是中枢淋巴器官,是T细胞分化、发育、成熟的场所,是机体重要的免疫器官。作为T细胞的训练场所和幼稚T细胞库,胸腺执行着重要的T细胞中枢耐受,T细胞在胸腺内经历阴性选择和阳性选择,阳性选择保持抗原特异性T细胞输出,而阴性选择负责尽量降低外周发生自身免疫反应的可能性[1],使得能够识别异体抗原,且对自身抗原无应答能力的胸腺细胞存活并发育成熟,从而使机体对自身抗原产生免疫耐受,并能够输出成熟胸腺细胞发挥免疫功能[2]。
免疫衰老是免疫系统全方位多系统的受基因严格控制的循环递减的自然过程[3]。免疫衰老是人体衰老的主要原因之一,免疫衰老包括造血干细胞增殖和分化不足、B细胞发育受阻、中枢T细胞输出不足、外周细胞介导的免疫降低、固有免疫应答减弱等几个重要方面,而胸腺的衰老是免疫衰老最重要的标志[4]。随着年龄的增加,胸腺组织脂肪浸润,胸腺细胞大量减少,皮髓质比例下降,小淋巴细胞凋亡。免疫衰老是以胸腺衰老为先导的从中枢到外周逐步衰老的进程,从而引起免疫力降低和老年自身免疫疾病的发生。
SHR大鼠是一种在实验中广泛运用的高血压动物模型,有研究发现该系大鼠的免疫功能低下[5],这种免疫缺陷似乎与其高血压的发生密切相关,但其具体机制并不清楚。巴德年等通过移植正常大鼠胸腺或者胸腺提取物,能够恢复SHR的免疫功能及降低其血压[6]。此外,有报道[7]显示SHR易发生类似于人结节性动脉周围炎的血管病变,而当新生儿期SHR大鼠接受Wistar大鼠胸腺移植后,能够预防该血管病变的发生[8]。Purcell等研究发现在幼年时期SHR大鼠胸腺的髓质和皮质容量比值与WKY大鼠相似,而在12周时SHR大鼠胸腺髓质明显少于WKY大鼠[9]。同时SHR大鼠胸腺淋巴细胞对丝裂原诱导的增殖反应性较低,并在12周龄时与WKY大鼠对比最为显著[10],说明随着年龄的增加,SHR大鼠胸腺功能相较于WKY大鼠显著地降低。
对于SHR大鼠胸腺萎缩及免疫功能低下的原因,有研究发现在SHR大鼠血清中含有一种能够对自身胸腺细胞发生补体依赖性细胞毒作用的自身抗体,这种抗体的强度和出现频率随年龄增长而增加,能够加快SHR大鼠胸腺萎缩和T细胞功能不全[11]。另外,糖皮质激素能够通过直接或间接的途径增强胸腺细胞的凋亡而诱导胸腺的萎缩[12],研究显示SHR大鼠肾上腺糖皮质激素水平较高[13],Suzuki等[14]通过切除肾上腺能够减少SHR和WKY大鼠胸腺的凋亡,并且使用地塞米松能够增加胸腺细胞凋亡并诱导WKY大鼠胸腺的萎缩,因此认为SHR大鼠胸腺萎缩亢进是由其较高的肾上腺糖皮质激素水平导致的。此外,也有研究[15]认为因神经-内分泌-免疫网络系统的存在,交感神经系统影响着胸腺的成熟和萎缩,而SHR大鼠的明显亢进的交感神经系统导致了胸腺萎缩的亢进。
我们的实验结果显示,随着周龄的增加SHR大鼠和WKY大鼠的胸腺逐渐萎缩,并且SHR胸腺萎缩程度大于WKY,SHR在12周龄时髓质和皮质面积明显减少,髓质占胸腺总面积比值显著小于WKY。这些结果与之前文献所描述的相符,可以认为SHR大鼠胸腺衰老的过程要明显快于WKY。我们的研究结果表明在6周龄时SHR血压开始升高,显著高于WKY大鼠,在8周龄时经过QYQ与Can干预2周后显著降低了SHR大鼠的血压,而且QYQ还在8周龄时增加了SHR大鼠的胸腺指数。在8周龄时WKY和SHR大鼠胸腺开始出现萎缩,皮质和髓质面积减少,而SHR的髓质边界更加模糊,在QYQ和Can干预下大鼠胸腺皮质显著增加并高于SHR模型组和WKY组,且髓质边界比模型组清晰。这种现象可能反映了SHR大鼠血压与胸腺衰老之间的某种联系,我们推测在药物干预2周后降低了SHR大鼠的血压,改变了大鼠内环境,从而影响了大鼠胸腺的衰老过程。但是也有可能这种对于胸腺的保护效应是独立于降压效应之外的,因为虽然QYQ组降压效果不及Can组,但其胸腺指数和胸腺皮质髓质的面积均高于Can组。同时这些结果提示QYQ虽在降压方面不及Can效果明显,但QYQ在早期减缓胸腺衰老方面具有更显著的效果。而在12周龄和20周龄时,虽然QYQ和Can都表现出显著的降压效应,但对于胸腺保护方面并没有更明显的效果,提示QYQ或者Can对胸腺的保护作用可能主要集中在高血压升高的一定程度或时间范围内。鉴于SHR大鼠血压快速持续升高,与同周龄WKY大鼠相比,8周龄SHR收缩压已升高约50 mmHg,药物的胸腺保护效应应该更具有病理生理意义。
清肝益肾祛风复方是本课题组导师根据高血压的中医病因病机,结合古代经典方剂以及临床体会制定的治疗高血压的中药复方,在临床上能够显著降低高血压患者的血压,并能明显改善头晕,头胀等临床症状[15]。本研究通过观察SHR大鼠与WKY大鼠血压与胸腺的差异与变化情况,使用清肝益肾祛风的中药复方和坎地沙坦酯片进行干预,在早期均能够降低SHR大鼠血压以及延缓胸腺萎缩,提示其降压效应与保护胸腺之间可能存在着某种联系,而且清肝益肾祛风复方在降压之外具有更为显著的胸腺保护作用,反应出中医药的多途径多靶点的治疗优势,但其具体机制仍有待进一步研究阐明。
1 Quaglino D,Ronchetti I P.Cell death in the rat thymus:a minireview.Apoptosis,2001,6(5):389-401.
2 宋芳,王建军,李俊平.T细胞在胸腺内的分化发育.包头医学院学报,2001,17(1):75-77.
3 龚张斌,金国琴.胸腺衰老与免疫衰老.国外医学(老年医学分册),2009,30(4):145-149.
4 王通,曾耀英.胸腺保护与抗衰老.中国临床康复,2005,9(23):164-166.
5 Takeichi N,Suzuki K,Okayasu T,et al.Immunological depression in spontaneously hypertensive rats.Clin Exp Immunol,1980,21(1):120-6.
6 Ba D,Takeichi N,Kodama T,et al.Restoration of T cell depression and suppression of blood pressure in spontaneously hypertensive rats(SHR)by thymus grafts or thymus extracts.J Immunol,1982,128(3):1211-6.
7 Suzuki T,Oboshi S,Sato R.Periarteritis nodosa in spontaneously hypertensive rats--incidence and distribution.Acta Pathol Japon,1979,29(5):697-703.
8 巴德年.高血压大鼠(SHR)免疫缺陷机理分析.中国免疫学杂志,1985,1:3-8.
9 Purcell E S,Wood G W,Gattone V H.Immune system of the spontaneously hypertensive rat:II.Morphology and function.Anat Rec,1993,237(2):236-42.
10 Pascual V H,Oparil S,Eldridge J H,et al.Spontaneously hypertensive rat:lymphoid depression is age dependent and mediated via a mononuclear cell subpopulation.Am J Physiol,1992,262(2):R1-7.
11 Takeichi N,Ba D,Kobayashi H.Natural cytotoxic autoantibody against thymocytes in spontaneously hypertensive rats.Cell Immunol,1981,60(1):181-90.
12 Compton M M,Caron L A,Cidlowski J A.Glucocorticoid action on the immune system.J Steroid Biochem,1987,27(1-3):201-8.
13 Hashimoto K,Makino S,Hirasawa R,et al.Abnormalities in the hypothalamo-pituitary-adrenal axis in spontaneously hypertensive rats during development of hypertension.Endocrinology,1989,125(3):1161-7.
14 Suzuki H,Delano F A,Jamshidi N,et al.Enhanced DNA fragmentation in the thymus of spontaneously hypertensive rats.Am J Physiol,1999,276(2):H2135-40.
——以起源权属为例

