冠状动脉CT血管造影检查后短时间内行冠状动脉介入诊疗的安全性研究
耿 巍,张 瑶,田 祥,张 旗,刘倩梅,杨 颖
(河北省保定市第一中心医院心内二科,河北 保定 071000)
·论 著·
冠状动脉CT血管造影检查后短时间内行冠状动脉介入诊疗的安全性研究
耿 巍,张 瑶,田 祥*,张 旗,刘倩梅,杨 颖
(河北省保定市第一中心医院心内二科,河北 保定 071000)
目的探讨冠状动脉CT血管造影(CT angiography,CTA)检查后1周内再次应用造影剂行冠状动脉介入诊疗对患者肾功能的影响。方法 将行冠状动脉介入诊疗患者384例分为试验组(1周内已行冠状动脉CTA检查,再次行冠状动脉造影者)135例和对照组(只行1次冠状动脉造影者)249例,监测2组术前和术后1 d、2 d、3 d血肌酐、胱抑素C水平和造影剂肾病(contrast induced nephropathy,CIN)发生率。结果2组血肌酐、估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)、胱抑素C水平组间差异均无统计学意义(P>0.05),但时点间差异均有统计学意义(P<0.01)。共发生CIN 16例,试验组6例(4.44%),对照组10例(4.02%),2组CIN发生率差异无统计学意义(P>0.05)。试验组介入治疗率明显高于对照组(54.07%vs33.33%),其差异有统计学意义(P<0.01)。结论eGFR≥60 mL·min-1·1.73 (m2)-1的患者行冠状动脉增强CTA后1周内进一步行冠状动脉介入诊疗对肾功能的影响较小,在临床中是安全可行的。
冠状动脉疾病;冠状血管造影术;造影剂肾病
造影剂肾病(contrast induced nephropathy,CIN),又称造影剂相关的急性肾损伤,是经血管内注射含碘造影剂后出现的医源性急性肾衰竭[1],目前已经成为仅次于手术、严重低血压导致医源性急性肾衰竭的第三大原因[1-2]。CIN是造影剂应用过程中的一种严重并发症,可能导致患者住院时间延长、心血管事件、肾衰竭,甚至死亡[3-5]。虽然CIN存在一系列的严重后果,但基础肾功能正常的患者发生率较低,仅为0.6%~2.3%,在具有危险因素的患者中发生率显著升高,可高达50%[6]。目前由于患者首次医疗接诊单位和患者个体化及病情的差异,临床工作中存在已行冠状动脉CT血管造影(CT angiography,CTA)后短时间内需再次行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)诊断或治疗的情况,而国内外指南中对重复应用造影剂的最短时间间隔尚无明确定论[7]。本研究旨在探讨短时间内重复应用造影剂对患者肾功能的影响,以进一步评价其安全性。
1 资料与方法
1.1 一般资料 选取2014年11月—2015年6月就诊于河北省保定市第一中心医院心内科行冠状动脉造影和(或)PCI的患者384例为研究对象。依据冠状动脉造影术前1周内是否行冠状动脉增强CTA检查分为2组。试验组(1周内已行增强CTA 检查,因冠状动脉CTA结果不能满足诊断需要或冠状动脉存在严重狭窄,需进一步行冠状动脉造影检查者)135例,男性69例,女性66例,年龄36~74岁,平均(58.85±7.82)岁;体质量指数(body mass index,BMI)26.10±3.12;基础疾病:糖尿病43例(31.85%),高血压85例(62.96%),高脂血脂48例(35.56%),贫血10例(7.41%)。对照组(只行1次冠状动脉造影者)249例,男性145例,女性104例,年龄26~74岁,平均(57.64±8.95)岁; BMI 26.10±3.12;基础疾病:糖尿病80例(32.13%),高血压159(63.86%),高脂血脂105(42.17%),贫血20例(8.03%)。2组性别、年龄、BMI及基础疾病等差异均无统计学意义(P>0.05),具有可比性。
1.2 纳入标准及排除标准 纳入标准:①患者18周岁以上;②有典型或不典型心绞痛症状,需进一步行冠状动脉造影诊断和(或)PCI;③术前血肌酐正常或估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)≥60 mL·min-1·1.73(m2)-1;④同意参加本研究并签署知情同意书。排除标准:①年龄≥75岁;②含碘造影剂过敏;③血流动力学不稳定;④血肌酐>132.6 μmol/L;⑤eGFR<60 mL·min-1·1.73(m2)-1;⑥严重肝肾功能障碍;⑦近期曾使用大量肾毒性药物(氨基糖苷类抗生素、二甲双胍或其他明确的肾毒性药物);⑧患者或家属拒绝参加本研究。本研究已得到医院伦理委员会的审核批准。
1.3 研究方法 记录研究对象的临床资料,造影剂剂量,依据迈赫兰评分量表进行危险因素的分层和评估。所有患者均使用低渗性或等渗性非离子型含碘造影剂。
1.4 观察指标 所有患者均于术前和术后第1天、第2天、第3天抽取晨起空腹静脉血,进行血肌酐、胱抑素C检测。根据改良的简化MDRD公式计算eGFR,eGFR [mL·min-1·1.73(m2)-1]= 175×SCr/(mg/dl)-1.234×年龄-0.203×(0.79女性)。
1.5 诊断标准 依据欧洲泌尿生殖放射协会确定的CIN诊断标准:使用造影剂后48~72 h内,肌酐绝对值升高≥44.2 μmol/L或较基础值升高≥25%,并排除其他原因导致的肾脏损害。
1.6 统计学方法 应用SPSS 17.0统计软件处理数据。计量资料比较分别采用t检验和重复测量的方差分析;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组不同时点血肌酐、eGFR和胱抑素C水平比较 2组血肌酐在术后第1天稍降低,2组eGFR在术后第1天升高而随后降低,试验组胱抑素在术后第1天稍降低而术后第2天、第3天稍升高,对照组胱抑素在术后第1天逐渐升高;2组血肌酐、eGFR和胱抑素C水平在时点间差异均有统计学意义(P<0.01),而在组间以及组间·时点间交互作用差异均无统计学意义(P>0.05)。见表1。
表1 2组术前术后血肌酐、eGFR和胱抑素C水平动态变化
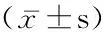

组别 例数血肌酐(μmol/L)术前术后第1天术后第2天术后第3天试验组 13566.83±14.2165.35±14.4966.86±14.9366.22±13.55对照组 24969.41±14.1567.68±12.1768.98±12.7968.80±12.14组间 F=3.050 P=0.082时点间 F=10.325 P=0.000组间·时点间F=0.253 P=0.790组别 例数eGFR[mL·min-1·1.73(m2)-1]术前术后第1天术后第2天术后第3天试验组 135109.76±27.83113.47±28.27108.71±25.29109.79±22.89对照组 249105.75±22.41107.98±21.24105.32±21.74105.76±20.53组间 F=3.269 P=0.071时点间 F=11.788 P=0.000组间·时点间F=0.871 P=0.435组别 例数胱抑素C(mg/L)术前术后第1天术后第2天术后第3天试验组 1350.99±0.160.97±0.151.00±0.150.99±0.14对照组 2490.96±0.140.97±0.140.99±0.140.99±0.14组间 F=0.519 P=0.472时间点 F=19.577 P=0.001时间·组点间F=0.688 P=0.502
2.2 2组CIN发生率比较 384例患者共发生CIN 16例(4.17%),其中试验组6例(4.44%),对照组10例(4.02%),2组CIN发生率差异无统计学意义(P>0.05),见表2。
2.3 2组其他指标比较 2组主动脉内球囊反搏、慢性心力衰竭和CIN风险评分比较差异均无统计学意义(P>0.05);试验组介入治疗的例数和造影剂用量多于对照组,差异有统计学意义(P<0.01)。见表3。
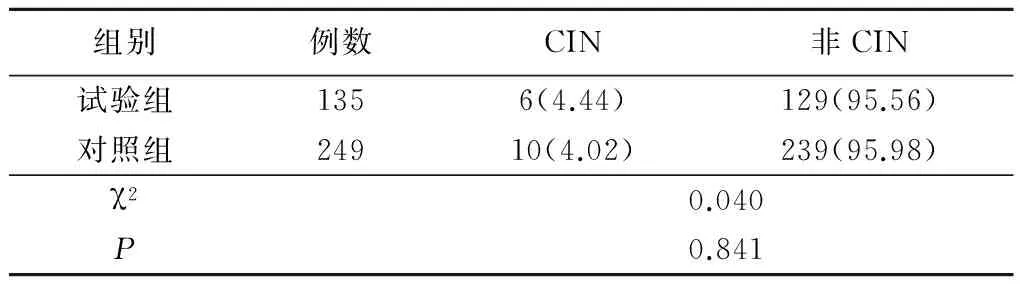
表2 2组CIN发生率比较
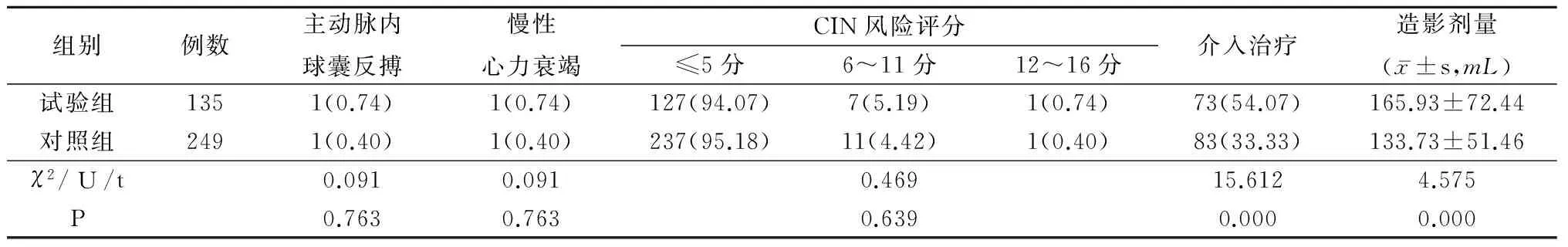
表3 2组其他指标比较
3 讨 论
CIN是血管内注射含碘造影剂后发生的医源性急性肾功能损害,大约占医院获得性急性肾衰竭的12%[8]。应用造影剂之前肾功能正常的住院患者CIN的发生率可达5%[9]。对于eGFR>45 mL·min-1·1.73(m2)-1的门诊患者,CIN的发生率约为2%[10],甚至不足1%[11]。因此,CIN在基础肾功能正常的患者中并不常见,更多见于肾功能损害的患者尤其是糖尿病肾病[12],在慢性肾脏疾病、糖尿病或应用肾毒性药物的人群中,CIN的发生率可能增加至50%[13]。在本研究中纳入的均为eGFR≥60 mL·min-1·1.73(m2)-1患者,CIN的发生率为4.17%。目前CIN的机制尚未完全阐述清楚,可能的机制包括:肾血流减少,尤其是肾髓质缺血,活性氧的形成,一氧化氮的生成减少,以及肾小管上皮和血管内皮的损伤[2]。目前研究显示水化是降低CIN发生风险的关键措施[14],尚无其他确切有效药物。近年研究表明他汀类药物对预防CIN可能有一定效果[15-17]。
血管内注射造影剂存在不同程度的肾脏损害风险。CIN的发生率受相关危险因素的影响。人们普遍认为慢性肾脏疾病是CIN最重要的一个危险因素,已经有多变量分析研究表明慢性肾脏疾病是预测CIN的一个独立危险因素[18-19]。Mehran 等[20]认为eGFR=60 mL·min-1·1.73(m2)-1对于识别可能发生CIN的高危人群是一个很好的分界点。eGFR>60 mL·min-1·1.73(m2)-1的患者应当被认为是正常的,除非他们有其他肾脏疾病的证据[7]。另外一个重要的危险因素是糖尿病,尤其是合并肾功能损害[2]。CIN是一种剂量依赖性疾病,造影剂的用量与CIN的发生存在密切关系[21]。著名的迈赫兰评分系统[19]对CIN的危险因素进行了系统的评估及分层。该评分系统主要包括低血压、主动脉球囊反搏、慢性充血性心力衰竭、慢性肾脏疾病、糖尿病、年龄>75岁、贫血以及造影剂剂量8个确定指标,随着分值的增加,CIN及透析的风险增加。若危险评分≥16,发生CIN的风险高达57.3%,进行透析治疗的风险达12.6%。当然,CIN的发生仍与造影剂的注射途径有关。Katzberg 等[22]综述表明肾功能不全患者进行冠状动脉增强CTA检查后发生CIN的比例低至5%,同时他们回访了1 075例进行冠状动脉CTA检查的肾功能不全患者,发现没有1例进行透析,也没有死亡。Kim等[23]研究表明eGFR为45~59、30~44、<30 mL·min-1·1.73(m2)-1的患者进行增强CTA检查后CIN的发生率分别为0.0%、2.9%和12.1%。许多研究已经表明动脉注射造影剂较静脉注射有较高的风险。
冠状动脉增强CTA检查作为一项无创性检查,有操作方便、费用低等优点,是目前临床医生了解患者冠状动脉情况的主要手段。采用血管增强CTA筛查冠心病后选择阳性患者再去行冠状动脉造影,比直接用冠状动脉造影筛查冠心病的方法,平均每人节省1 128美元;前者筛查的患者行冠状动脉PCI的比例(48%)明显高于后者(24%)[24]。本研究表明,经冠状动脉增强CTA初步筛查后进一步行冠状动脉造影的患者介入治疗率(54.07%)高于对照组(33.33%)(P<0.05),可以缩短患者住院时间、提高安全性,同时可以提高介入患者阳性率。
目前国内外指南中对重复应用造影剂的最短时间间隔问题尚无明确定论[25]。重复应用造影剂会增加造影剂使用剂量,增加肾脏负荷,从而使CIN及透析风险增大,有研究表明临床实践中如有必要重复应用造影建议2次时间间隔最好超过14 d[7,25],这是肾脏可能的恢复时间,但是具体的最优时间间隔仍不确定[7]。本研究表明,针对行冠状动脉增强CTA后eGFR仍≥60 mL·min-1·1.73(m2)-1的患者1周内再次行冠状动脉诊疗过程,其肾功能无明显恶化,但需监测肾功能,重复应用造影剂的时间间隔需达到临床可接受的最长时间。目前由于患者首次医疗接触单位、患者个体化及病情的差异,临床工作中存在短时间内重复应用造影剂的情况,本研究结果为临床工作者提供了有利证据。
本研究存在的局限性:①仅为小样本、单中心前瞻性研究,研究结果可能存在偏倚,需要更多临床试验进行检验;②纳入对象均无肾脏疾患且基础肾功能无明显损害[eGFR≥60 mL·min-1·1.73(m2)-1],对存在基础肾脏疾病的患者不能作出进一步指导,需要进一步扩大样本量进行评价。
本研究结果证实,冠状动脉增强CTA检查可初步筛查冠心病患者,有利于提高介入治疗阳性率;对于eGFR≥60 mL·min-1·1.73(m2)-1的患者行冠状动脉增强CTA检查后1周内进一步行PCI诊疗过程,患者的肾功能无明显恶化,在临床中是安全可行的。
[1] Andreucci M,Faga T,Pisani A,et al. Prevention of contrast-induced nephropathy through a knowledge of its pathogenesis and risk factors[J]. Scientific World Journal,2014,2014:823169.
[2] Andreucci M,Faga T,Pisani A,et al. Acute kidney injury by radiographic contrast media:pathogenesis and prevention[J]. Biomed Res Int,2014,2014:362725.
[3] Ribichini F,Gambaro G,Graziani MS,et al. Comparison of serum creatinine and cystatin C for early diagnosis of contrast-induced nephropathy after coronary angiography and interventions[J]. Clin Chem,2012,58(2):458-464.
[4] Seeliger E,Sendeski M,Rihal CS,et al. Contrast-induced kidney injury:mechanisms,risk factors,and prevention[J]. Eur Heart J,2012,33(16):2007-2015.
[5] James MT,Samuel SM,Manning MA,et al. Contrast-induced acute kidney injury and risk of adverse clinical outcomes after coronary angiography:a systematic review and meta-analysis[J]. Circ Cardiovasc Interv,2013,6(1):37-43.
[6] Neyra JA,Shah S,Mooney R,et al. Contrast-induced acute kidney injury following coronary angiography:a cohort study of hospitalized patients with or without chronic kidney disease[J]. Nephrol Dial Transplant,2013,28(6):1463-1471.
[7] Stacul F,van der Molen AJ,Reimer P,et al. Contrast induced nephropathy:updated ESUR Contrast Media Safety Committee guidelines[J]. Eur Radiol,2011,21(12):2527-2541.
[8] Gleeson TG,Bulugahapitiya S. Contrast-induced nephropathy[J]. AJR Am J Roentgenol,2004,183(6):1673-1689.
[9] Curtis LM,Agarwal A. HOpe for contrast-induced acute kidney injury[J]. Kidney Int,2007,72(8):907-909.
[10] Solomon R. Contrast-induced acute kidney injury:is there a risk after intravenous contrast?[J]. Clin J Am Soc Nephrol,2008,3(5):1242-1243.
[11] Weisbord SD,Palevsky PM. Prevention of contrast-induced nephropathy with volume expansion[J]. Clin J Am Soc Nephrol,2008,3(1):273-280.
[12] Katzberg RW,Newhouse JH. Intravenous contrast medium-induced nephrotoxicity:is the medical risk really as great as we have come to believe?[J]. Radiology,2010,256(1):21-28.
[13] Sadat U,Usman A,Boyle JR,et al. Contrast Medium-Induced Acute Kidney Injury[J]. Cardiorenal Med,2015,5(3):219-228.
[14] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会.含碘对比剂在心血管疾病中临床应用的专家共识(2012)[J].中华心血管病杂志,2013,41(2):94-98.
[15] Andreucci M. Statins in CIN:a problem at least partly solved?[J]. G Ital Nefrol,2013,30(3).pii:gin/30.3.9.
[16] Peruzzi M,De Luca L,Thomsen HS,et al. A network meta-analysis on randomized trials focusing on the preventive effect of statins on contrast-induced nephropathy[J]. Biomed Res Int,2014,2014:213239.
[17] Leoncini M,Toso A,Maioli M,et al. Statin treatment before percutaneous cononary intervention[J]. J Thorac Dis,2013,5(3):335-342.
[18] Brown JR,DeVries JT,Piper WD,et al. Serious renal dysfunction after percutaneous coronary interventions can be predicted[J]. Am Heart J,2008,155(2):260-266.
[19] Mehran R,Aymong ED,Nikolsky E,et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention:development and initial validation[J]. J Am Coll Cardiol,2004,44(7):1393-1399.
[20] Mehran R,Nikolsky E. Contrast-induced nephropathy:definition,epidemiology,and patients at risk[J]. Kidney Int Suppl,2006,(100):S11-15.
[21] Kane GC,Doyle BJ,Lerman A,et al. Ultra-low contrast volumes reduce rates of contrast-induced nephropathy in patients with chronic kidney disease undergoing coronary angiography[J]. J Am Coll Cardiol,2008,51(1):89-90.
[22] Katzberg RW,Lamba R. Contrast-induced nephropathy after intravenous administration:fact or fiction?[J]. Radiol Clin North Am,2009,47(5):789-800.
[23] Kim SM,Cha RH,Lee JP,et al. Incidence and outcomes of contrast-induced nephropathy after computed tomography in patients with CKD:a quality improvement report[J]. Am J Kidney Dis,2010,55(6):1018-1025.
[24] Dewey M,Hamm B. Cost effectiveness of coronary angiography and calcium scoring using CT and stress MRI for diagnosis of coronary artery disease[J]. Eur Radiol,2007,17(5):1301-1309.
[25] 中华医学会放射学分会对比剂安全使用工作组. 碘对比剂使用指南(第2版)[J].中华放射学杂志,2013,47(10):869-872.
(本文编辑:许卓文)
Study on the safety of coronary artery interventional therapy after coronary computed tomographic angiography
GENG Wei, ZHANG Yao, TIAN Xiang*, ZHANG Qi, LIU Qian-mei, YANG Ying
(SecondDepartmentofCardiology,theCentralHospitalofBaodingCity,HebeiProvince,Baoding071000,China)
Objective The goal of this study was to investigate the effect on renal function in patients with coronary angiography or percutaneous coronary intervention(PCI) after coronary CT angiography(CTA) within 1 week. Methods A total of 384 patients underwent coronary angiography or angioplasty were enrolled into two groups:the test group 135 who were undergoing coronary angiography or angioplasty after coronary CTA within 1 week, and control group 249 who were undergoing coronary angiography only. Serum creatinine, cystatin C and the incidence of contrast induced nephropathy(CIN) were detected before procedure, after procedure 1 d, 2 d, 3 d. Results There was no significant difference in serum creatinine, estimated glomerular filtration rate(eGFR), and cystatin C between groups before and after contrast exposure(P>0.05). But there was significatnt difference between different point(P<0.01). The study resulted in 16 cases of CIN, and there was no significant difference in the incidence of CIN between two groups(4.44%vs4.02%,P>0.05). The difference of PCI between the two groups was statistically significant(P<0.01), and the PCI procedure in test group was significantly higher than that in control group(54.07%vs33.33%). Conclusion It is safe and feasible for patients with an eGFR≥60 mL·min-1·1.73 (m2)-1to received coronary angiography or PCI after CTA within 1 week, and it has little impact on the renal function.
coronary artery disease; coronary angiography; contrast induced nephropathy
2016-10-11;
2016-10-31
耿巍(1981-),男,河北保定人,河北省保定市第一
R541.4
A
1007-3205(2017)03-0266-05
10.3969/j.issn.1007-3205.2017.03.005
中心医院副主任医师,医学博士,从事心血管内科疾病诊治研究。
*通讯作者。E-mail:15903126523@163.com

