CT引导下直肠癌根治术后局部复发冷冻消融治疗的研究
袁 媛,钱朝霞,李文涛
1.上海交通大学医学院附属国际和平妇幼保健院放射科,上海200030;2.复旦大学附属肿瘤医院介入治疗科,复旦大学上海医学院肿瘤学系,上海200032
CT引导下直肠癌根治术后局部复发冷冻消融治疗的研究
袁 媛1,钱朝霞1,李文涛2
1.上海交通大学医学院附属国际和平妇幼保健院放射科,上海200030;2.复旦大学附属肿瘤医院介入治疗科,复旦大学上海医学院肿瘤学系,上海200032
背景与目的:结直肠癌的局部复发是接受根治性手术切除的患者治疗失败的主要原因之一。该研究旨在探索直肠癌根治术后局部复发冷冻消融治疗的可行性、安全性及有效性。方法:2013年10月—2015年1月共入组22例直肠癌根治术后局部复发患者,行27次冷冻消融术,术后随访12~32个月。治疗后影像学随访采用盆腔增强CT或MRI。统计技术成功率、并发症发生及处理情况、1年内靶病灶局部控制率,比较术前、术后患者疼痛评分。结果:该组研究技术成功率为100%,主要并发症发生率为18.5%,包括小便困难、患侧肌力下降、脓肿形成、重度组织冻伤。术后1年内靶病灶局部控制率为72.7%,局部病灶进展时间为(11.1±4.3)个月。患者术前与术后第3天进行数字疼痛评分(numerical rating scale,NRS),术前与术后6个月NRS差异有统计学意义(P<0.05);术前与术后12个月NRS差异无统计学意义(P=0.854)。结论:CT引导下冷冻消融作为一种治疗直肠癌根治术后局部复发的新方法,安全可行,靶病灶局控率高,短期内疼痛缓解明显。
直肠癌;局部复发;冷冻消融
2015年国家癌症中心首次发布的我国居民癌症现患数据显示,结直肠癌5年患病率跃居第2位[1]。目前,结直肠癌5年生存率约为60%,约有一半的患者死于肿瘤的复发和转移。结直肠癌的局部复发是接受根治性手术切除的患者治疗失败的主要原因之一,10%~25%最终将出现局部复发[2]。直肠癌局部复发的治疗为结直肠癌治疗的难点,治疗效果相对较差。手术治疗风险高,并发症及死亡率高;放疗对出血和疼痛症状有一定改善,但对其他症状的控制作用非常有限;化疗主要作为一种姑息性治疗手段或放疗增敏剂。本研究为直肠癌根治术后局部复发冷冻消融治疗的前瞻性研究,旨在探索其可行性、安全性及有效性,有望为直肠癌根治术后的局部复发提供一种新的治疗方法。
1 资料和方法
1.1 患者选择
本研究经每位患者知情同意。入组标准:① 直肠癌术后复发病理诊断明确;② 术后二线化疗及放疗失败;③ 年龄18~75岁。排除标准:① 病灶紧邻膀胱或肠道空腔脏器,病灶位于皮下或已侵犯皮肤;② 血小板少于75×109个/L或国际标准化比值大于1.5;③ 重要脏器功能衰竭。
1.2 治疗过程
患者直肠癌术后复发门诊或住院经CT(购自荷兰Philips公司,64排)引导下穿刺活检明确病理诊断,在完善相关检查、排除手术禁忌后,行CT引导下冷冻消融术。冷冻针型号(Cryo-Hit,GALIL MEDICAL,17G),术中采用氩气制冷,冷冻中心区域温度可达-140 ℃,单针的制冷范围为长4 cm、最大径2.5 cm的椭球形,均经历2次冻-融循环。若盆腔病灶靠近膀胱,术前插导尿管排空膀胱;若盆腔病灶与邻近肠道难分辨,术前4 h口服复方泛影葡胺针6支(76%×20 mL)显示肠道。保证冰球覆盖范围超过病灶边缘0.5 cm或完全覆盖病灶。
1.3 随访与评估
统计技术成功率、并发症发生率,记录术前及术后患者数字疼痛评分(numerical rating scale,NRS)。治疗后影像学随访采用盆腔增强CT或MRI检查,术后的前3个月至少随访1次,以后每3个月1次。术后疗效评估采用修订的实体瘤疗效评价标准,局部疗效采用靶病灶局部控制率和局部病灶无进展期两个指标。
1.4 统计学处理
采用SPSS 13.0分析软件,术前、术后NRS值的比较采用配对t检验,采用Kaplan-Meier法进行生存分析,P<0.05为差异有统计学意义。
2 结 果
2.1 患者资料
2013年10月—2015年1月共入组22例直肠癌根治术后局部复发患者,其中男性13例,女性9例,年龄范围41~75岁,平均(58±8.9)岁。入组患者均经CT引导下穿刺活检明确病理诊断,病灶大小(4.2±1.1) cm。在22例患者中,骶前复发15例,侧方复发5例,会阴复发2例。19例(86%)患者具有明显的自觉症状,包括骶前疼痛、会阴部坠胀或疼痛、下肢疼痛或麻木感、里急后重感、排尿困难和血尿等(表1)。

表1 直肠癌根治术后局部复发的症状Tab. 1 Symptoms of local recurrence after radical resection of rectal carcinoma
2.2 治疗及并发症情况
2013年10月—2015年1月共22例直肠癌根治术后局部复发患者,行27次冷冻消融,5例患者行2次盆腔冷冻消融术。本组研究技术成功率为100%,主要并发症发生率为18.5%(5/27),包括小便困难、患侧肌力下降、骶前脓肿和重度组织冻伤。2例小便困难膀胱区热敷无效后予以导尿,导尿管均在术后3天内拔除。1例术后患侧下肢肌力由4级降为2级,予以甘露醇脱水、弥可保口服营养神经,术后1个月随访肌力基本恢复。1例骶前脓肿予以脓肿引流、每天2次甲硝唑冲洗及抗生素静脉滴注,术后2周脓腔消失。1例Ⅳ°局部冻伤,予以清创、切除坏死组织、冲洗创面,后分次臀大肌填充、植皮修复(图1)。
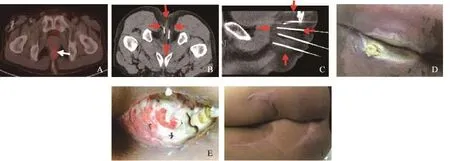
图1 Ⅳ°局部冻伤及其处理Fig. 1 Ⅳ°local frostbite and its managements
2.3 随访评估
患者随访从末次盆腔肿瘤冷冻消融术后第1天开始至患者死亡或最后1次随访,共随访12~32个月,平均(18.0±5.8)个月。术前、术后3天、术后6个月和术后12个月NRS分别为(4.3±2.4)、(1.4±1.2)、(2.7±1.9)和(4.5±2.7)分。患者术前与术后第3天NRS疼痛评分,术前与术后6个月NRS差异有统计学意义(P<0.05);术前与术后12个月NRS差异无统计学意义(P=0.854)。术后1年内靶病灶局部控制率为72.7%,局部病灶进展时间为(11.1±4.3)个月(图2)。

图2 局部病灶进展时间Fig. 2 Time to progression of local lesion
3 讨 论
直肠癌的局部复发定义为发生在小骨盆内的任何直肠癌的复发。目前直肠癌术后局部复发的分类尚未有准确地定义及界定,仅有荷兰的一个前瞻性临床研究[3]的后续随访分析对局部复发进行了较为明确的分类,也是目前应用最广泛的分类方法,研究根据随访影像学复发位置将局部复发分为骶前复发、前方复发、吻合口复发、侧方复发和会阴复发5种类型。直肠癌术后局部复发初期缺乏特异症状,多数患者无明显不适。局部复发的诊断强调规律的定期随访,在一项671例患者的随访研究中发现,70%的局部复发是在术后常规随访过程中发现的[4]。局部复发严重影响直肠癌患者的生活质量和生存期,其治疗为结直肠癌治疗的难点,治疗效果相对较差。手术治疗风险高,并发症及死亡率高;放疗对出血和疼痛症状有一定改善,但对其他症状的控制作用非常有限;化疗主要作为一种姑息性治疗手段或放疗增敏剂。
冷冻消融又称冷冻疗法或冷冻外科。其原理为探针穿刺肿瘤后首先迅速降温(核心温度可达-160~-196 ℃)形成冰球,维持一段时间后再快速升温,此一降一升为1个循环,如此经过几个循环反复冻融使肿瘤区域坏死。降温后细胞内和细胞外迅速形成冰晶,导致肿瘤细胞脱水、破裂;同时,冷冻使微血管收缩、血流减慢、微血栓形成,阻断血流,导致肿瘤细胞缺血坏死。
目前,应用较为广泛的冷冻系统多基于氩气制冷,主要有Cryohit和Cryocare两种系统,可允许放置1~15个直径1.5~2.4 mm的冷冻探针。每个探针通过冷冻-融化-冷冻模式达到所在区域的肿瘤坏死,治疗过程中通过B超、CT或MRI的介导,肿瘤组织内形成的冰球清晰可见,使消融区域与周围组织之间形成鲜明的边界[5]。当肿瘤靠近重要组织脏器,由于冰球对周围组织结构的损伤可限制在其最外侧边界的3~7 mm内[6],操作者可据此最大限度地灭活肿瘤病灶同时不损及周围重要组织脏器。冷冻治疗中冰球明确的可见性显著增加了操作安全性及术者信心,使其应用日益广泛。国际上,在2000年冷冻消融首先应用于前列腺癌的治疗[7],后来逐渐扩展到肝、肺、肾、乳腺、子宫、卵巢、骨、皮肤与各种软组织的良恶性肿瘤。直肠癌术后复发冷冻消融治疗的研究报道很少,分析原因可能有:① 盆腔结构复杂,肠管、输尿管、膀胱、子宫和神经等组织脏器的干扰使得治疗风险相对较高;② 即使有少量报道,但缺乏长期的随访及有效的分析,疗效不能肯定,使治疗者信心不足。根据文献报道,盆腔肿瘤冷冻消融的并发症有疼痛、出血、血小板降低、肠穿孔、肠梗阻、膀胱损伤、神经损伤、组织冻伤和冷休克等,其中,冷休克为最严重的并发症,主要由于肿瘤消融、大量炎症因子释放入血造成[8]。
在前期工作中,本中心对部分直肠癌术后复发患者进行射频消融治疗,发现患者的耐受性较差,可能是相比冷刺激而言神经对热刺激更为敏感;此外,由于缺乏明确的消融边界,为避免累及周围重要组织器官,在治疗过程中较为保守。而CT引导下冷冻消融明确的低密度边界,可以通过逐渐增大冷冻功率、降低神经的敏感性从而提高患者的耐受性。为此,我们进行了本前瞻性研究,探索直肠癌根治术后局部复发冷冻消融治疗的可行性、安全性及有效性,以期为其提供一种新的治疗方法。本组研究技术成功率为100%,主要并发症发生率为18.5%,无围手术期死亡发生。本研究最严重的并发症为1例Ⅳ°局部冻伤,通过清创、创面冲洗、切除坏死组织,然后分次臀大肌填充、植皮完成最终修复。分析原因,尽管我们按照一般标准即冷冻范围超过肿瘤10 mm,但由于病灶较靠近皮肤,缺乏肌肉组织的保护,而脂肪组织对低温的耐受较差,易发生脂肪溶解。本研究术后患者短期内疼痛缓解明显,术前与术后第3天NRS,术前与术后6个月NRS差异有统计学意义,患者口服镇痛剂剂量明显减少。冷冻消融对疼痛的缓解作用在骨肿瘤报道较多[9]。术后1年内靶病灶局部控制率为72.7%,局部病灶进展时间为(11.1±4.3)个月。目前尚无直肠癌根治术后局部复发冷冻消融治疗的长期随访数据,仅有徐克成等[10]报道的6例复发性Ⅲ期直肠肛管癌冷冻-I125粒子治疗情况,且取得较好的近期疗效,3例生存2年以上,1例已无病生存41个月。也有研究者认为,冷冻联合经动脉区域化疗、I125粒子植入、腹腔热灌注化疗等可能会有更好的疗效。
综上,直肠癌根治术后局部复发的冷冻消融治疗患者耐受性良好,安全性高;短期内可以明显缓解疼痛症状,提高生活质量。靶病灶的1年局部控制率较高,相关的联合治疗研究及长期随访有待开展。
[1] ZHENG R, ZENG H, ZHANG S, et al. National estimates of cancer prevalence in China, 2011 [J]. Cancer Lett, 2016, 370(1): 33-38.
[2] 蔡三军, 章 真, 杜 祥. 循证结直肠肛管肿瘤学 [M]. 上海: 上海科学技术出版社, 2016.
[3] KUSTERS M, MARIJNEN C A, RUTTEN H J, et al. Patterns of local recurrence in rectal cancer; a study of the Dutch TME trial [J]. Eur J Surg Oncol, 2010, 36(5): 470-476.
[4] KODEDA K, DERWINGER K, GUSTAVSSON B, et al. Local recurrence of rectal cancer: a population-based cohort study of diagnosis, treatment and outcome [J]. Colorectal Dis, 2012, 14(5): e230-e237.
[5] DUPUY D E. Image-guided thermal ablation of lung malignancies [J]. Radiology, 2011, 260(3): 633-655.
[6] HINSHAW J L, LEE F T, LAESEKE P F, et al. Temperature Isotherms during pulmonary cryoablation and their correlation with the zone of ablation [J]. J Vasc Interv Radiol, 2010, 21(9): 1424-1428.
[7] GAGE A A, HUBEN R P. Cryosurgical ablation of the prostate[J]. Urol Oncol, 2000, 5(1): 11-19.
[8] NIU L Z, LI J L, XU K C, et al. Percutaneous cryoablation for liver cancer [J]. J Clin Transl Hepatol, 2015, 2(3): 182-188.
[9] FOSTER R C, STAVAS J M. Bone and soft tissue ablation[J]. Semin Intervent Radiol, 2014, 31(2): 167-179.
[10] 徐克成, 牛立志. 肿瘤冷冻治疗学 [M]. 上海: 上海科技教育出版社, 2007.
CT guided cryoablation in local recurrence after radical resection of the rectal carcinoma
YUAN
Yuan1, QIAN Zhaoxia1, LI Wentao2(1. Department of Radiology, the International Peace Maternity & Child Health Hospital , Shanghai Jiao Tong University School of Medicine, Shanghai 200030, China; 2. Department of Interventional Radiology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
Background and purpose: The local recurrence is one of the main causes of treatment failure for rectal carcinomas after radical resection. This study aimed to investigate the feasibility, safety, and efficacy of CT guided cryoablation in local recurrence after radical resection of rectal carcinomas. Methods: From Oct. 2013 to Jan. 2015, a total of 22 patients were enrolled in this study, and a follow-up of 12-32 months were performed. The image follow-up was by contrast-enhanced CT or MRI of pelvic. The technical success rate, complications and managements, and 1-year local control rate were recorded. The degree of pain between preablation and postablation was compared by scores of numerical rating scale (NRS). Results: The technical success rate was 100%. The main complication rate was 18.5%, including dysuresia, muscle strength decreased of af f ected side, abscess formation, severe frostbite. The 1-year local control rate was 72.7%, and the time to progression of local lesion were (11.1±4.3) months. Scores of NRS had signif i cant dif f erence between preablation and 3-day postablation, and preablation and 6-month postablation (P<0.05). There was no signif i cant dif f erence between preablation and 12-month postablation (P=0.854). Conclusion: CT-guided cryoablation as a new method for local recurrence after radical resection of rectal carcinomas was safe and feasible, which had high rate of local control, and relieved pain obviously for a period of time.
Rectal carcinoma; Local recurrence; Cryoablation
LI Wentao E-mail: liwentao98@126.com
10.19401/j.cnki.1007-3639.2017.02.010
R735.3+7
A
1007-3639(2017)02-0140-05
2016-09-15
2016-12-28)
李文涛 E-mail:liwentao98@126.com

