正向夹层再进入技术在冠状动脉慢性完全闭塞病变介入治疗中的应用
孟帅 金泽宁
·经验交流·
正向夹层再进入技术在冠状动脉慢性完全闭塞病变介入治疗中的应用
孟帅 金泽宁
慢性完全闭塞病变; 经皮冠状动脉介入治疗; 正向夹层再进入技术
冠状动脉慢性完全闭塞病变(chronic total occlusion,CTO)定义为病程>3个月(已知或确定冠状动脉闭塞持续时间>3个月),冠状动脉造影所示局部管腔闭塞、前向血流完全消失,远端血流心肌梗死溶栓试验(thrombolysis in myocardial infarction,TIMI)0级,或仅见少许前向血流通过、但无远端血管充盈(TIMI血流Ⅰ级),也称为“功能性”CTO。CTO患者在临床中占所有接受经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)患者的10%~20%[1]。与其他冠状动脉狭窄性病变不同,CTO行PCI的技术难度大,传统PCI技术处理CTO的成功率为50%~60%。近年来随着众多新技术、新设备的出现,经验丰富的介入医师开通CTO的成功率可达到90%[2]。
CTO行PCI失败的主要原因是导丝常常进入了血管内膜下,而无法通过闭塞段到达远段血管真腔。这一点已通过血管内超声(intravascular ultrasound,IVUS)得到证实[3]。内膜下寻径及再进入(subintimal tracking and reentry,STAR)技术是指用导丝将内膜下撕裂出缝隙,将导丝经缝隙由内膜下穿出再次进入到血管真腔中。STAR技术的缺点是可控性差,同时存在损失分支血管的风险[4]。正向夹层再进入(antegrade dissection reentry,ADR)技术是在STAR技术基础上的改良,可以通过BridgePoint Medical System辅助实现。
2008年,波士顿科学公司推出了处理CTO的专用BridgePoint Medical System,包括CrossBossTM导管、StingrayTM导管以及StingrayTM导丝三个部分(图1)。在FAST-CTOs试验[1]中,16家中心共入选147例CTO患者,采用ADR技术,应用BridgePoint Medical System对CTO进行处理,手术成功率较传统介入手术方式显著提高,30 d内主要不良心血管事件(MACE)发生率降低 (4.8%比6.9%,P=0.040),而且显著缩短了手术时间及X线暴露时间(105 min比146 min;44 min比53 min,P=0.000)。目前,ADR技术在国际上已成为CTO行PCI的三种主要方法之一,虽然近两年在国内得到开展,但应用范围小,而且国内医学对BridgePoint Medical System的使用并未十分熟悉。
1 ADR技术专用设备BridgePoint MedicalSystem的构成
1.1 CrossBossTM导管
CrossBossTM的远端是一个亲水涂层的3 F(1 mm)无创钝圆形头端,轴杆由多股导丝盘绕而成。旋转导管的尾端装置时,可提供1∶1的扭矩。CrossBossTM导管为金属中空导管,内部可容纳0.014 in(1 in=2.54 cm)导丝。应用导引导丝将CrossBossTM调至CTO闭塞段近端,然后快速旋转并推送CrossBossTM尾端装置,由多股导丝盘绕的轴杆提供1∶1扭矩传导,头端可钻通CTO纤维帽及闭塞段,相当于用无创钝圆形亲水涂层头端把冠状动脉进行钝性分离,同时难以穿过血管外膜,避免了冠状动脉穿孔破裂等严重并发症。
1.2 StingrayTM球囊及StingrayTM导丝
StingrayTM球囊为采用特殊制造工艺的扁平球囊,其上有2个呈180°相反方向的出口,术者可通过两个不透光的标记带实现精准定位。StingrayTM导丝头端有一个长度为0.18 mm的探针,导丝头端预塑形角度为28°,可以通过该探针使导引钢丝重新进入血管真腔。
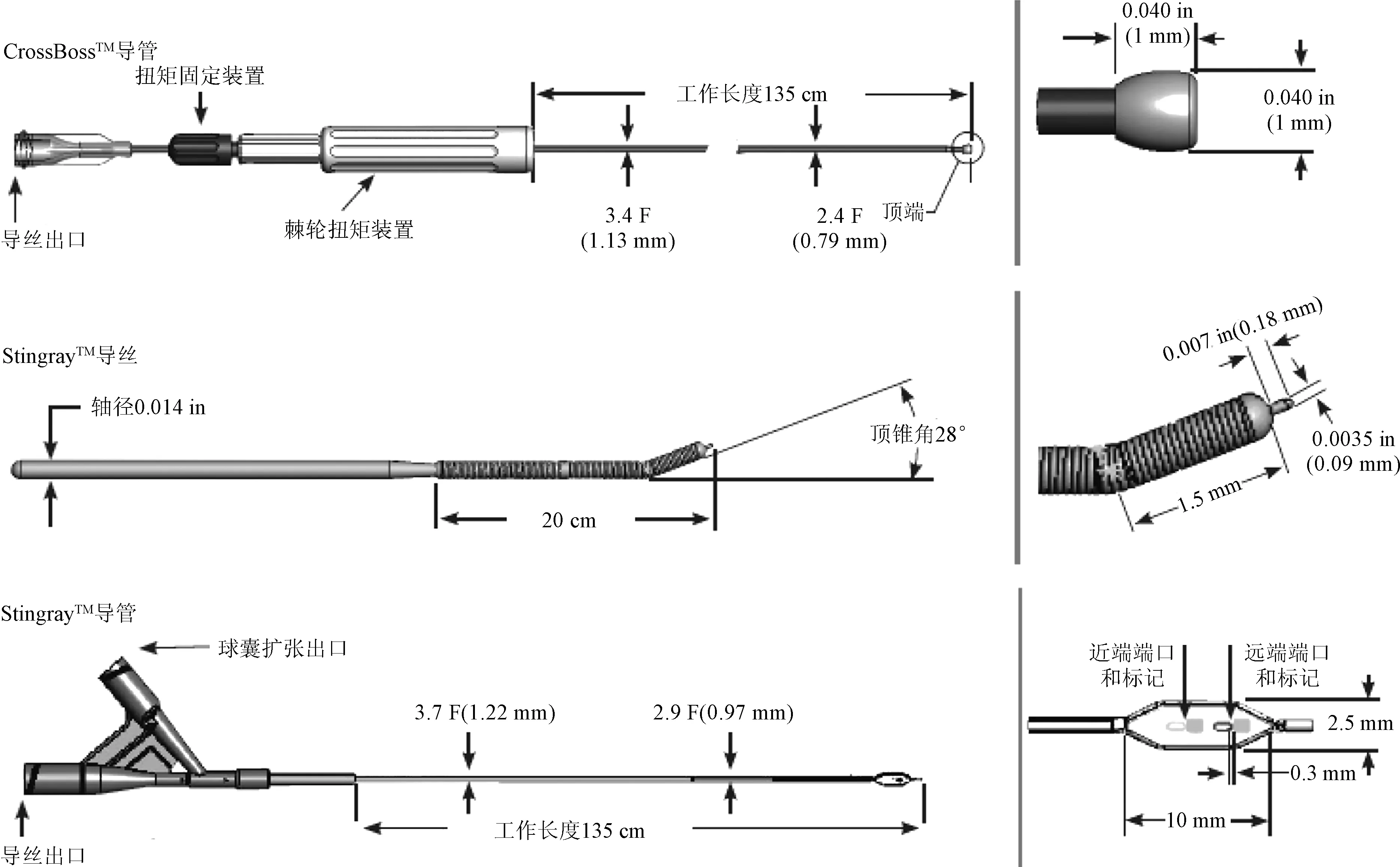
图1 正向夹层再进入技术专用设备BridgePoint Medical System(1 in=2.54 cm)
2 应用CrossBossTM导管通过闭塞段近端纤维帽(图2)
CrossBossTM导管的头端为一个亲水涂层覆盖的无创钝圆形结构,将CrossBossTM导管推至闭塞近端,头端顶住近端纤维帽,通过快速旋转进入到纤维帽内。导管头端顺着闭塞近端纤维帽的薄弱点前进,尽管20%~30%的概率直接进入远端的血管真腔,但大部分情况下,会安全地在血管内膜下顺着血管的走形前进。CrossBossTM导管缺点有两点:钝性分离可能会损失分支;该导管较硬,增加了在迂曲血管中操作的难度。
CrossBossTM导管内部可兼容0.014 in导丝,通常选择工作型系列导丝,如BMW或 Rinato导丝作为前导,引导CrossBossTM导管进入到冠状动脉内;或当装置通过闭塞段后探测是否进入远端真腔。如果CrossBossTM导管不能顺利地向前推送,需要退出装置,用1.5 mm预扩张球囊进行扩张后再次送入CrossBossTM导管。CrossBossTM导管的主要工作原理是通过术者快速旋转产生的扭力和8 F指引导管提供的支撑力共同形成前进力,从而在斑块内或内膜下前行通过CTO部位。操作过程中要注意,尾端装置旋转时导丝必须退回到尾端装置内。CrossBossTM导管可以直接推送至远端真腔,顺着导丝进入到内膜下,也可以顺其自然扩大内膜下的空间,为ADR技术做充分准备。
在迂曲血管的操作中,CrossBossTM导管很容易被从真腔推送至内膜下。但由于其头端是钝型设计,目前尚未有到达血管外膜、造成血管破裂的报道,这也证实了CrossBossTM导管的安全性[5]。
CTO的形态是多种多样的,没有一种装置可以解决所有的病变。CrossBossTM导管的问题是很难通过严重钙化病变,并且在极度扭曲的血管中,导管向前的推送力也会削减。但是,在传统正向导丝技术失败的时候,应用CrossBossTM导管可以缩短手术时间,尝试ADR技术。
3 应用StingrayTM球囊及StingrayTM导丝进行内膜下再进入(图3)
CTO无法成功开通的主要原因之一就是正向导丝进入内膜下的假腔,而又无法再次从假腔进入到远段血管真腔中。StingrayTM球囊为扁平形状,用对比剂以6 atm(1 atm=101.325 kPa)的压力充盈球囊时,StingrayTM球囊可以充盈整个内膜下空间,环抱住血管,球囊上的2个呈180°相反方向的出口之一就会指向血管真腔。StingrayTM球囊内充满对比剂,在X线透视下可以判断StingrayTM导丝是否指向血管真腔。若StingrayTM导丝选择的出口指向血管外膜,可将该导丝旋转180°后进入另一个出口即可指向血管真腔。StingrayTM导丝头端为硬而短的探针,使用StingrayTM导丝穿透血管内膜后,即可交换为Pilot 200导丝通过穿破口送至血管远段。一般导丝造成的内膜下假腔空间往往不够大,无法顺利地将StingrayTM球囊送至内膜下空间,而使用CrossBossTM导管造成的内膜下假腔空间更适合送入StingrayTM球囊。
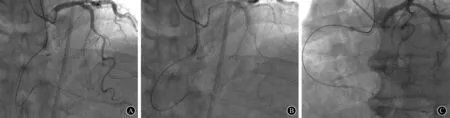
图3 应用StingrayTM球囊及StingrayTM导丝进行内膜下再进入 A:送StingrayTM球囊至内膜下扩张;B:送StingrayTM导丝穿破内膜片至真腔;C:交换工作导丝至远段真腔
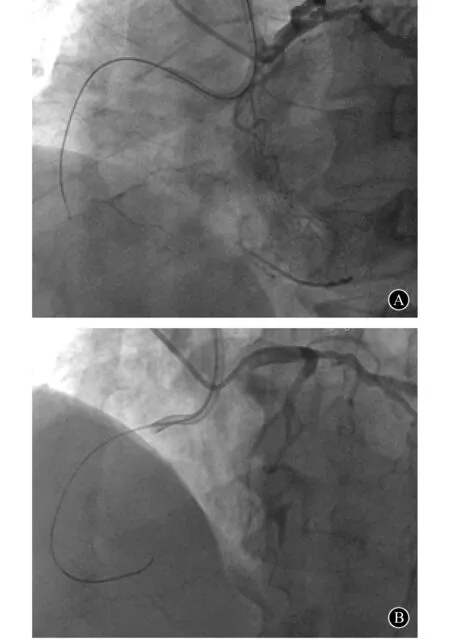
图2 应用CrossBossTM导管通过闭塞段近端纤维帽 A:crossboss导管顶住近段闭塞段纤维帽;B:快速旋转推送crossboss导管通过闭塞段
内膜下再进入失败的原因之一就是内膜下假腔空间向远段延伸,压迫远段血管真腔,所以在正向夹层形成的时候,不要从正向注射对比剂,避免夹层向远段撕裂,必要时可应用腔内影像学辅助判断[6];失败的另一个原因是StingrayTM导丝进入到远段很小的血管真腔内。因此,尽早决定使用ADR技术可避免导丝进入内膜下的距离过长而导致再进入的位置太远[6]。进行对侧造影来观察血管远段情况,可以帮助更好地进行ADR技术[7]。
4 总结
BridgePoint Medical System是第一个专为应用ADR技术处理CTO而设计的装置。CrossBossTM导管有时可以快速地从近段血管真腔通过闭塞段到达远段真腔,在处理支架内再狭窄或闭塞时也可得以利用[8]。当CrossBossTM导管未能直接到达远段真腔而是沿着导丝进入到内膜下时,导管可以扩大内膜下空间,为后面应用StingrayTM球囊而做准备。应用StingrayTM球囊及StingrayTM导丝进行内膜下再进入成功的条件之一是进行对侧造影使闭塞远段血管真腔被对比剂填充,找到最佳的再进入位置,并可以在后期通过对侧造影证实导丝位置是否在真腔内。由于StingrayTM导丝头端为硬而短的探针,再进入时一定要确认其从StingrayTM球囊的出口出来是朝向血管真腔而不是血管外膜,所以操作时要更加仔细和轻柔。在处理CTO时,ADR技术与传统的导丝升级技术的结合不但降低了冠状动脉穿孔发生率,而且提高了导丝进入内膜下假腔后重新再进入血管真腔的成功率。
目前,美国CTO行PCI中35%~40%患者接受了导丝升级技术PCI,20%患者接受了逆向PCI,其余约30%患者接受了ADR技术治疗[5]。我国医疗机构尚未普及BridgePoint Medical System,对其应用经验不足,ADR技术使用有限。因此,需要在未来的介入实践中积极使用ADR技术,为CTO处理积累临床经验,使更多患者获益。
[1] Whitlow PL, Burke MN, Lombardi WL, et al. Use of a novel crossing and re-entry system in coronary chronic total occlusions that have failed standard crossing techniques: results of the FAST-CTOs (Facilitated Antegrade Steering Technique in Chronic Total Occlusions) trial. JACC Cardiovasc Interv,2012,5(4):393-401.
[2] Michael TT, Papayannis AC, Banerjee S, et al. Subintimal dissection/reentry strategies in coronary chronic total occlusion interventions. Circ Cardiovasc Interv,2012,5(5):729-738.
[3] Mogabgab O, Patel VG, Michael TT, et al. Long-term outcomes with use of the CrossBoss and stingray coronary CTO crossing and re-entry devices. J Invasive Cardiol,2013,25(11):579-585.
[4] Fefer P, Knudtson ML, Cheema AN et al. Current perspective on coronary chronic total occlusions: the Canadian Multicenter Chronic Total Occlusions Registry. J Am Coll Cardiol, 2012,59(11): 991-997.
[5] Wosik J, Shorrock D, Christopoulos G,et al. Systematic Review of the BridgePoint System for Crossing Coronary and Peripheral Chronic Total Occlusions. J Invasive Cardiol,2015,27(6):269-276.
[6] Danek BA, Karatasakis A, Karmpaliotis D,et al. Use of antegrade dissection re-entry in coronary chronic total occlusion percutaneous coronary intervention in a contemporary multicenter registry.Int J Cardiol,2016,214:428-437.
[7] Werner GS, Schofer J, Sievert H, et al. Multicentre experience with the BridgePoint devices to facilitate recanalisation of chronic total coronary occlusions through controlled subintimal re-entry. EuroIntervention,2011,7(2):192-200.
[8] Papayannis A, Banerjee S, Brilakis ES. Use of the Crossboss catheter in coronary chronic total occlusion due to in-stent restenosis. Catheter Cardiovasc Interv,2012 ,80(2):E30-36.
10.3969/j.issn.1004-8812.2017.02.010
100029 北京,首都医科大学附属北京安贞医院急诊危重症中心 北京市心肺血管疾病研究所
金泽宁, Email:jinzening@hotmail.com
R541.4
2016-10-25)

