鲍曼不动杆菌中耐消毒剂基因qacEΔ1-sul1和Ⅰ类整合酶的携带情况调查
陈秋霞,赵苏瑛
(南京中医药大学附属江苏省中医院检验科,江苏 南京 210029)
鲍曼不动杆菌中耐消毒剂基因qacEΔ1-sul1和Ⅰ类整合酶的携带情况调查
陈秋霞,赵苏瑛
(南京中医药大学附属江苏省中医院检验科,江苏 南京 210029)
目的 调查分析我院临床分离的鲍曼不动杆菌菌株中耐药基因的分布情况及部分多重耐药株的流行病学特点。方法收集2016年1~6月我院院内分离的150株鲍曼不动杆菌,MIC法测定其对抗生素的敏感性;将对三类以上抗生素耐药的菌株定义为多重耐药菌,运用PCR法检测qacEΔ1-sul1和intI 1基因在所分离菌株中的分布,并用PFGE法对其中多重耐药鲍曼不动杆菌进行分子分型。结果鲍曼不动杆菌敏感率排行前三的药物为妥布霉素(50.0%)、庆大霉素(44.2%)和亚胺培南(42.4%);84株多重耐药鲍曼不动杆菌中排行前三的药物为美罗培南(33.3%)、头孢哌酮(33.3%)和左氧氟沙星(13.1%);qacEΔ1-sul1和intI 1在鲍曼不动杆菌中的携带率为46.2% (85/150)和58.0%(88/150);在多重耐药鲍曼不动杆菌中的携带率为59.5%(49/84)和83.4%(70/84)。多重耐药鲍曼不动杆菌经PFGE分型可分为14个克隆,其中A克隆最多见,在ICU、呼吸科和急诊病房均存在集中流行,神经内科和老年科以C克隆多见,其余均为散在流行。结论qacEΔ1-sul1和intI 1在鲍曼不动杆菌中的携带率很高,在多重耐药株中更高,说明I类整合子是鲍曼不动杆菌产生耐药的原因之一,研发新的消毒剂以消除鲍曼不动杆菌在院内的流行迫在眉睫,此外同一克隆株在同一病区的集中流行和在病区间的交叉流行提示应采取进一步的感染控制和隔离措施。
鲍曼不动杆菌;qacEΔ1-sul1;Ⅰ类整合酶
鲍曼不动杆菌是一类在外界环境中普遍存在的常见条件致病菌,主要可引起呼吸道感染、泌尿生殖道感染和血流感染等[1]。近年来,鲍曼不动杆菌在引起医院感染的病原菌中呈逐年上升的趋势。由于其易形成对抗生素的多重耐药和泛耐药并且能在物体表面存活数周至数月,并对院内常用的消毒剂产生耐药,因此极易在院内播散造成大面积流行,使临床抗感染治疗面临巨大挑战[2]。本研究拟对本院2016年上半年所分离的鲍曼不动杆菌进行流行病学调查研究,分析耐消毒剂基因qacEΔ1-sul1和整合酶基因intI 1在临床菌株中的携带情况,为治疗和预防鲍曼不动杆菌在医院内的流行提供理论指导。
1 资料与方法
1.1 一般资料 菌株来源于我院2016年1~6月临床分离的150株鲍曼不动杆菌,其中剔除同一患者相同部位分离出的重复菌株,所有临床菌株的分离培养和鉴定按照《全国临床检验操作规程》进行[3]。
1.2 实验仪器和试剂 PCR扩增仪购自德国Eppendorf公司,电泳仪购自美国Bio-Rad公司,PCR试剂、DNA Marker均购自南京天为生物科技有限公司,VITEK 2 compact全自动细菌鉴定药敏仪购自法国生物梅里埃公司。
1.3 实验方法
1.3.1 药物敏感性试验 鲍曼不动杆菌对常用抗生素的敏感性测定采用MIC法,结果判定参照2015年CLSI标准[4],质控菌株为大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853以及金黄色葡萄球菌ATCC29213[3]。
1.3.2 PCR扩增耐药基因鲍曼不动杆菌的DNA采用煮沸法提取[5],扩增引物由上海英潍捷基生物有限公司合成,具体序列如表1所示,16S rRNA基因作为PCR内参。反应采用20 μL体系,具体为10 μL Taq Mix(天为生物),1 μL DNA模板,上下游引物各1 μL,和7 μL无菌蒸馏水。扩增条件设置为:94℃预变性5 min,94℃30 s,55℃60 s,72℃60 s扩增30个循环。PCR产物经1%琼脂糖凝胶电泳后用EB染色后在紫外凝胶成像仪下观察目的条带。
1.3.3 脉冲场凝胶电泳(PFGE)分子分型 纯化后的细菌基因组DNA经ApaI限制性内切酶(TaKaRa)消化过夜后在脉冲场凝胶电泳仪上电泳20 h[6],具体参数为电压5 V/cm,转换时间5~20 s,电场夹角120°,电泳分子量标准为沙门菌(Braenderup)H9812菌株[7]。电泳后凝胶用EB染色后观察,结果判读采用Tenover等的方法[8]。所有试验数据采用EpiData3.1软件建立数据库,使用BioNumerics(Applied Maths,Kortrijk,Belgium)软件进行相似性分析,各型之间的亲缘关系使用聚类分析。
1.4 统计学方法 应用SPSS18.0统计学软件进行数据分析,组间计数资料比较采用χ2检验,以P<0.05为差异具有统计学意义。
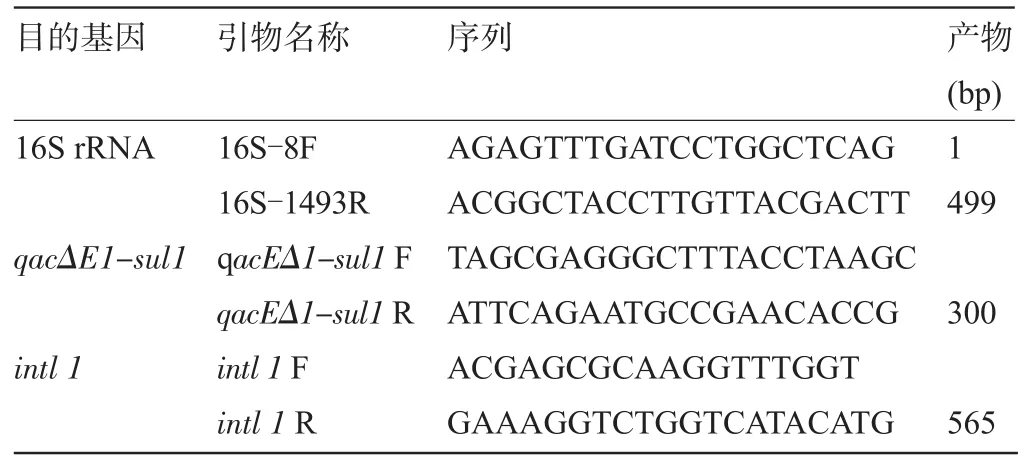
表1 本试验所用的引物序列及扩增片断大小
2 结 果
2.1 鲍曼不动杆菌对常用抗生素的药敏结果 鲍曼不动杆菌对妥布霉素敏感率最高,为50.0%,其次为庆大霉素和亚胺培南,分别为44.2%和42.4%;多重耐药鲍曼不动杆菌对药物的敏感率更低,最高的为美罗培南和头孢哌酮,均为33.3%,其次为左氧氟沙星,为13.1%,其余药物的敏感性均在10%及以下(见表2),常用药物中除氨苄西林、氨曲南和美罗培南外,其他受试药物在鲍曼不动杆菌组群中的敏感性与多重耐药菌株比较差异均具有显著统计学意义(P<0.01)。
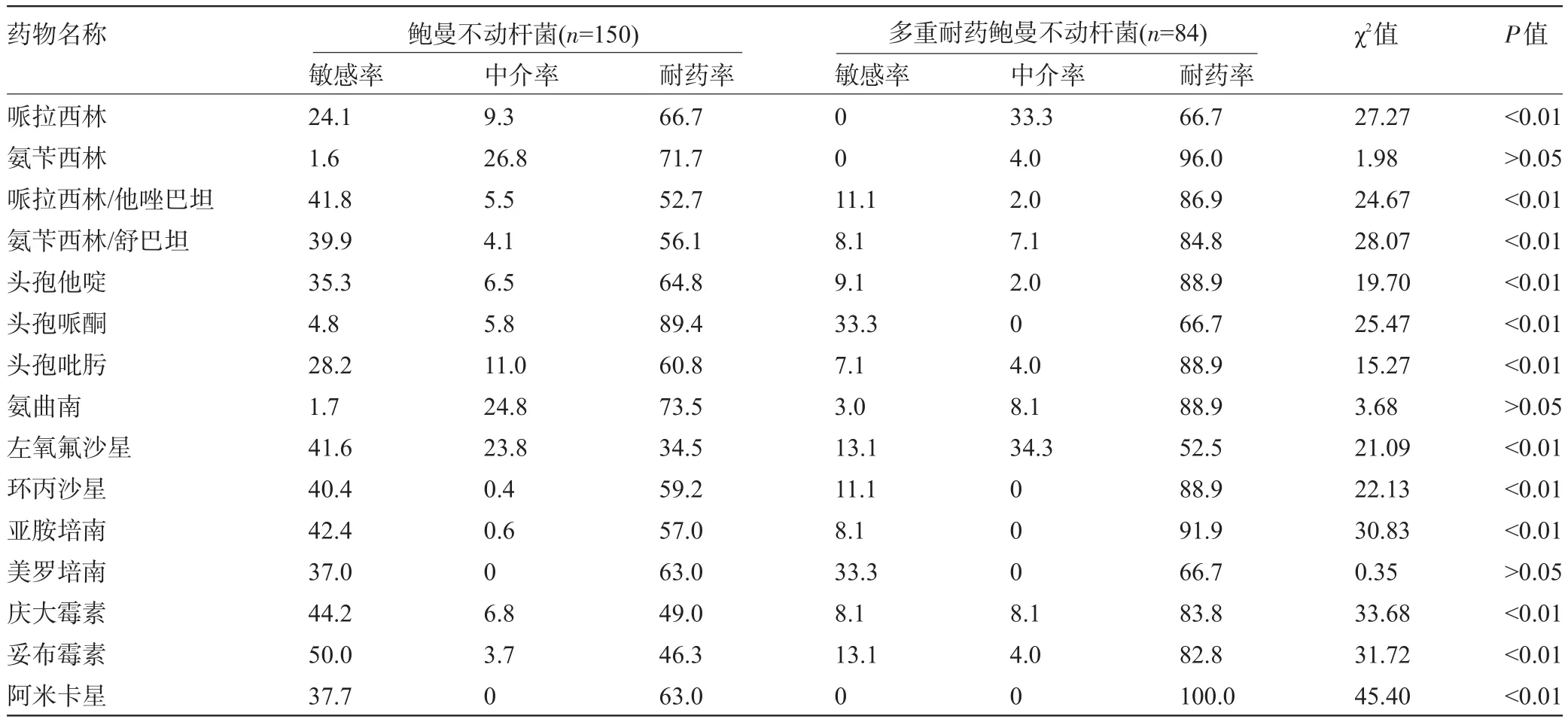
表2 鲍曼不动杆菌及其多重耐药株对常用抗生素的敏感率分布(%)
2.2 耐药基因在菌株中的分布 150株鲍曼不动杆菌中有88株检出intl 1,携带率为58.7%,85株检出qacΔE 1-sul1,携带率约为56.7%,84株多重耐药鲍曼不动杆菌中共有70株检出intl 1,携带率为83.3%,49株检出qacΔE 1-sul1,检出率约为58.3%,intl 1的携带率在两组间差异具有显著统计学意义(χ2=14.94,P<0.01),而耐消毒剂基因qacΔE 1-sul1的携带率差异无统计学意义(χ2=0.0611,P>0.05)。
2.3 多重耐药鲍曼不动杆菌的分子分型及病区分布 84株多重耐药鲍曼不动杆菌经PFGE检测后共可分成14个克隆,其中以A克隆最为常见,共40株,占47.6%,包括A1亚型29株及A2亚型11株;B克隆10株;C克隆18株,其中C1亚型14株,C2亚型4株,其余均为散发克隆。各克隆株在病区的分布见表3,各病房内均存在同一克隆株流行;其中ICU,呼吸科和急诊病房内以A克隆为主,神经内科和老年科以C克隆为主。
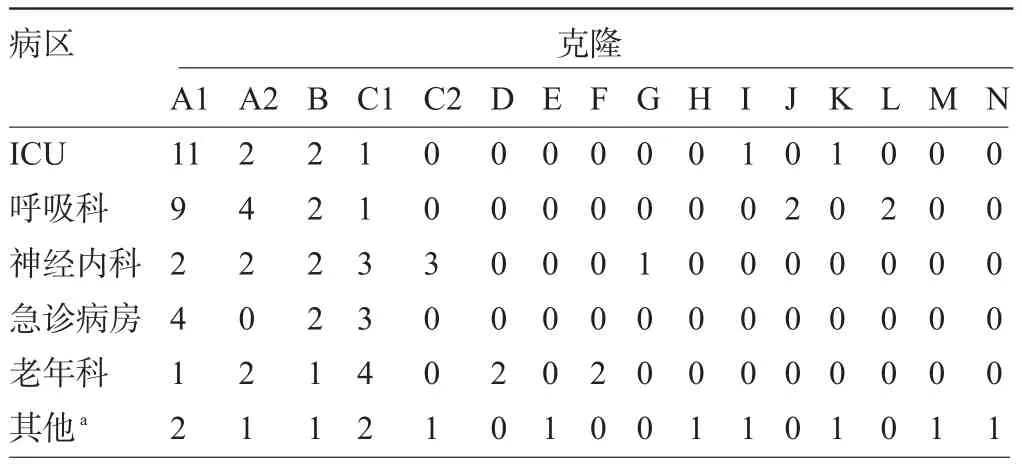
表3 多重耐药鲍曼不动杆菌各克隆株在病区的分布(株)
3 讨 论
鲍曼不动杆菌是近年来院内感染的常见病原菌,由于其在外界的生存能力强且易产生耐药性,因此鲍曼不动杆菌的感染一直是临床治疗上的难题。本试验中我们的研究对象为我院2016年上半年自临床患者中分离的150株鲍曼不动杆菌,其中84株是多重耐药株。鲍曼不动杆菌总体而言对大多数常用抗生素耐药率偏高,尤其是多重耐药鲍曼不动杆菌,敏感率最高的左氧氟沙星耐药率也在50%以上,亚胺培南、头孢吡肟、头孢他啶、头孢哌酮、氨曲南及环丙沙星等的耐药率均在90%左右。
qacΔE1基因编码的是一种跨膜蛋白,位于Ⅰ类整合子的保守序列,该产物对季胺盐类消毒剂能产生耐药[9],季胺盐类化合物是院内常用的消毒剂,如苯扎溴胺、新洁尔灭等。Sul1基因编码的是对磺胺类药物具有抗性的二氢叶酸合成酶,该基因也位于Ⅰ类整合子3'端的保守序列上[10],由于qacEΔ1和sul1基因相连,因此我们本试验中所设计的引物横跨qacEΔ1和sul1,称做qacΔE1-sul1。IntI 1编码的是I类整合酶,属于Ⅰ类整合子的一部分,细菌通过整合酶表达各种耐药组分,并在细菌间传播。本试验中qacΔE1-sul1在150株鲍曼不动杆菌中的检出率为46.2%,IntI1的检出率为58.0%,而在84株多重耐药的鲍曼不动杆菌中qacΔ E1-sul1的检出率为59.5%,稍高于群体内的平均水平,IntI1的检出率为83.4%,远高于群体水平,两者之间差异具有显著统计学意义。这说明鲍曼不动杆菌中很大一部分携带耐季胺类消毒剂的基因,在多重耐药的鲍曼不动杆菌中该基因的携带率更高,这类菌能耐受医院内平时常用的皮肤黏膜消毒剂或是地面空气消毒剂,因此在环境中能长期存在,不易杀灭,是引起院内感染的危险因素,因此开发新的消毒剂迫在眉睫。IntI1在多重耐药鲍曼不动杆菌中的携带率高达83.4%,这一现象恰好说明I类整合子在细菌的耐药中扮演了重要角色,是鲍曼不动杆菌产生耐药的原因之一。
对多重耐药的鲍曼不动杆菌进行分型后发现,不同病区内有同一克隆株的流行,说明院内存在交叉感染,同一病区内流行多个克隆株但以某一克隆株为主,说明同一病区内经常是多个型别的多重耐药鲍曼不动杆菌同时流行且多重耐药鲍曼不动杆菌有集中流行的特点,动态监测这类菌株的产生并及时采取措施阻止其进一步扩散是很必要的。
本研究结果显示,院内鲍曼不动杆菌对常用抗生素的耐药情况十分严重,尤其是多重耐药株的出现,使临床的治疗更加困难。qacΔE1-sul1基因在鲍曼不动杆菌中的广泛存在使其在院内长期生存并引发机会感染。鲍曼的耐药是多个基因协同作用的结果,其中Ⅰ类整合子起了重要作用,它把多个耐药盒整合在一起在细菌间传播从而引起多重耐药。因此对这类细菌进行感染监控和采取预防措施是阻止其在院内发生感染爆发流行的最好方式。
[1]Zhang HZ,Zhang JS,Qiao L.The Acinetobacter baumannii group:a systemic review[J].World J Emerg Med,2013,4(3):169-174.
[2]Karaiskkos I,Giamarellou H.Multidrug-resistant and extensively drug-resistant Gram-negative pathogens:current and emerging therapeutic approaches[J].Expert Opin Pharmacother,2014,15(10): 1351-1370.
[3]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社,2006:890-912.
[4]Clinical and Laboratory Standard Institute.Performance standards for antimicrobial susceptibility testing:seventeenth informational supplement M100-S25[S].Wayne,PA:CLSI,2015.
[5]Juhasz E,Krizsan G,Lengyel G,et al.Infection and colonizationby Stenotrophomonas maltophilia:antimicrobial susceptibility and clinical background of strains isolated at a tertiary care centre in Hungary [J].Ann Clin MicrobiolAntimicrob,2014,13:333.
[6]Kaufmann ME,Pitt TL.Pulsed-field gel electrophoresis of bacterial DNA[M]//Methods in practical laboratory bacteriology.CRC Press: Boca Raton,FL,1994:83-92.
[7]金辉,徐小敏,糜祖煌.鲍曼不动杆菌的耐药基因分型与脉冲场凝胶电泳分型的比较[J].环境与职业医学,2010,27(4):219-225.
[8]Tenover FC,Arbeit RD,Goering RV,et al.Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis:criteria for bacterial strain typing[J].J Clin Microbiol,1995,33 (9):2233-2239.
[9]Liaw SJ,Lee YL,Hsueh PR.Multidrug resistance in clinical isolates of stenotrophomonas maltophilia:roles of integrons,efflux pumps, phosphoglucomutase(SpgM),and melanin and biofilm formation[J]. Int JAntimicrobAgents,2010,35(35):126-130.
[10]Hu LF,Chang X,Ye Y,et al.Stenotrophomonas maltophilia resistance to trimethoprim/sulfamethoxazole mediated by acquisition of sul and dfrA genes in a plasmid-mediated class 1 integron[J].Int J AntimicrobAgents,2011,37(3):230-234.
Investigation of antibiotic resistance genes qacEΔ1-sul1 and intI 1 in Acinetobacter baumannii.
CHEN Qiu-xia, ZHAO Su-ying.Department of Clinical Laboratory,Jiangsu Province Hospital of TCM,Affiliated Hospital of Nanjing University of TCM,Nanjing 210029,Jiangsu,CHINA
ObjectiveTo investigate the profiles of antibiotic resistance genes and molecular typing of Acinetobacter baumannii isolates collected from clinical specimens in our hospital.MethodsThis study included 150 A.baumannii isolates collected from Jan.2016 to Jun.2016.Antibiotic susceptibility test was determined by minimum inhibitory concentration(MIC).A.baumannii isolates that were resistant to three or more antibiotics were identified as multidrug resistant.qacEΔ1-sul1 and intI 1 genes were analyzed by PCR,and molecular typing for 84 multidrug resistant A.baumannii isolates was performed by PFGE.ResultsThe most susceptible antibiotics for A.baumannii were Tobramycin (50.0%),Gentamicin(44.2%)and Imipenem(42.4%),while in the 84 multidrug resistant A.baumannii,the most susceptible antibiotics were Meropenem(33.3%),Cefoperazone(33.3%)and Levofloxacin(13.1%).Among 150 A.baumannii isolates,85(46.2%)harbored qacEΔ1-sul1 and 88(58.0%)for intI l,while in 84 multidrug resistant A.baumannii,49 (59.5%)for qacEΔ1-sul1 and 70(83.4%)for intI 1.Multidrug resistant A.baumannii isolates belonged to 14 clones according to the PFGE,with A clone as the main type,which was prevalent in ICU,Respiration Department and Emergency Ward.C clone was prevalent in Neurology Department and Geriatrics Department.ConclusionqacEΔ1-sul1 and intI 1 genes were common in A.baumannii,and the carriage rate of intI l was especially high in multidrug resistant A.baumannii isolates,which provides the evidence that intI l was responsible for the drug resistance of A.baumannii.Clonal dissemination provides evidence for the prevalence of multidrug-resistant A.baumannii among clinical isolates.It is suggested that there is an urgent need for new antibiotics.
Acinetobacter baumannii;qacEΔ1-sul1;intI 1
R37
A
1003—6350(2017)03—0426—03
10.3969/j.issn.1003-6350.2017.03.027
2016-07-15)
赵苏瑛。E-mail:43315349@qq.com

