人参皂苷rg3联合rh-ES治疗乳腺癌荷瘤小鼠的实验研究
李根,陈文文,梁华,王玉兰
(四川省成都市妇女儿童中心医院 药剂科,四川 成都 610091)
乳腺癌是女性高发肿瘤,流行性病学调查显示,乳腺癌是女性首位恶性肿瘤,每年发病率约42/10万,并且逐年增高[1]。放化疗是乳腺癌常用治疗方案,但传统的放化疗药物具有较强毒副作用,并易出现耐药。在这种情况下,临床开始探究使用植物来源的天然化合物治疗乳腺癌的可行性[2]。已有研究[3]表明,人参皂苷rg3是人参根部提取的单体成分,对多种肿瘤细胞生长、浸润以及转移具有抑制作用,并且毒副作用较低。重组人血管内皮抑素(rh-ES,恩度)则是临床常用的非小细胞肺癌治疗药物,其在乳腺癌中的价值如何,临床研究较少。本研究分析了人参皂苷rg3及人参皂苷rg3联合恩度对MCF-7乳腺癌细胞移植小鼠的治疗作用。
1 材料与方法
1.1 实验动物
购买72只雌性裸小鼠,SPF级,体质量15~20 g,购买自中科院国家啮齿类上海实验分中心,3~4周龄。
1.2 实验仪器与药品
流式细胞仪由美国DD细胞公司生产;PCR仪由美国MJ Research公司生产;紫外分光光度仪由日本Shimadzu公司生产;凝胶图像分析系统由美国PALL公司生产。恩度由山东先声麦得津生物制药有限公司提供;人参皂苷rg3由辽宁生物医药科技有限公司提供;VEGF兔抗人单克隆抗体由美国eBioscience公司提供;BAD显色试剂盒由福州迈新生物技术有限公司提供;小牛血清由杭州四季青生物工程材料有限公司提供。
1.3 模型制备与干预方法。
将MCF-7细胞取出后,于无菌环境下PBS洗点3次,滴入0.2 mL胰蛋白酶,置于温箱内培养10 min,待细胞复苏后,置于100 mL 10%小牛血清+100 IU/mL青霉素+0.03%L-谷氨酞胺溶液内,室温环境培养,连续培养3代。取对数生长期的MCF-7细胞,选用30 mL胰蛋白酶消化,并选用台盼蓝染液进行细胞计数,计数在95%显示穿代成功。于显微镜下将细胞数调整至5×107个/mL,并其接种至小鼠右侧乳房,待造模成功后,采用随机数字表法分为对照组(等量生理盐水注射)、人参皂苷组(静注人参皂苷rg3 5 mg/kg,隔日1次)、恩度组(静注10 mg/kg,隔日1次)、联合组(静注恩度10 mg/kg+人参皂苷rg3 5 mg/kg,隔日1次)各18只,干预时间3周。
1.4 指标检测方法
1.4.1 肿瘤质量、体积测量 干预3周后,脱颈处死小鼠,取出瘤体,计算瘤体质量及体积:肿瘤体积=1/12πab2,抑瘤率=(1-治疗组瘤重/对照组瘤重)×照组瘤重。
1.4.2 流式细胞术 取各组样本剪碎后制备成细胞悬液,2 500r/min离心10 min,沉淀后悬PBS洗涤2次,70%酒精固定25 min,滴入15 mL 10%Trition X-100孵化15 min,滴入0.2 mg/mL Rnase孵化10 min,选用碘化丙啶几Annexin-V进行双染色,病选用流式细胞仪检测细胞周期情况。
1.4.3 RT-PCR 根据TRIZol法提取样本总RNA,收集沉淀下来的核酸,并选用冷乙醇洗涤2次,干燥后选用50 mL 0.2% DEPC进行水解,选用DNA/RNA紫外检测仪检测其含量。根据MMLV逆转录酶方法进行cDNA制备操作,取5 µL cDNA选用Taq酶进行扩增,将样本PCR反应,条件为:95 ℃,60 s;55 ℃,60 s;72 ℃,30 s,32 个循环。将所得物置于1.5%琼脂糖凝胶上电泳20 min,选用凝胶成像系统进行定量分析。
1.4.4 Western blot 将样本剪碎后加入至400 µL裂解液内,碾碎组织,裂解30 min后,2 500r/min离心10 min,取上清并冷藏待用。取100 µg样本,滴入10 mL Tris2HCL,15 mL二硫苏糖醇,10 mL PL,震荡均匀,于100 ℃下变性5 min,滴至不连续聚丙烯酰胺凝胶样品孔内,电泳,VEGF兔抗人单克隆抗体一抗,山羊IgG二抗,ECL显色,并镜检[4]。
1.4.5 免疫组化 将样本常规包埋切片后,脱蜡水化,并选用500 mL柠檬酸盐缓冲液进行抗原修复,PBS洗涤3次,MMP-2、MMP-9兔抗人单克隆抗体一抗,羊抗兔IgG二抗;DAB显色,苏木素复染,镜检。
1.5 统计学处理
统计软件采用SPSS 16.0,采用均数±标准差(±s)进行统计描述,多组间比较采用单因素方差分析法,组间两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠肿瘤质量、体积及抑制率比较
人参皂苷组、恩度组、联合组组小鼠的肿瘤质量、体积均明显低于对照组(均P<0.05);联合组的肿瘤质量、体积均明显低于人参皂苷组、恩度组(均P<0.05),抑制率明显大于人参皂苷组、恩度组(均P<0.05);人参皂苷组与恩度组间无统计学差异(P>0.05)(表1)。
表1 各组小鼠肿瘤质量、体积及抑制率比较(n=18,±s)
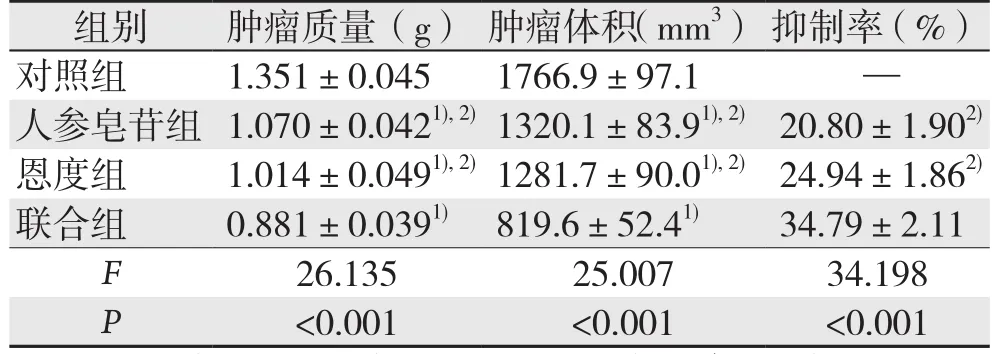
表1 各组小鼠肿瘤质量、体积及抑制率比较(n=18,±s)
注:1)与对照组比较,P<0.05;2)与联合组比较,P<0.05
组别 肿瘤质量(g) 肿瘤体积(mm3)抑制率(%)对照组 1.351±0.045 1766.9±97.1 —人参皂苷组 1.070±0.0421),2)1320.1±83.91),2)20.80±1.902)恩度组 1.014±0.0491),2)1281.7±90.01),2)24.94±1.862)联合组 0.881±0.0391) 819.6±52.41) 34.79±2.11 F 26.135 25.007 34.198 P<0.001 <0.001 <0.001
2.2 各组小鼠肿瘤组织中细胞周期分布情况比较
人参皂苷组、恩度组、联合组3组小鼠的G0/G1期、S期细胞比例均明显低于对照组,G2/M期细胞比例高于对照组(均P<0.05);联合组的G0/G1期、S期明显低于人参皂苷组、恩度组,G2/M期细胞比例明显高于人参皂苷组、恩度组(均P<0.05);人参皂苷组与恩度组间无统计学差异(均P>0.05)(表2)。
2.3 各组小鼠肿瘤组织中VEGF mRNA、蛋白的表达率比较
人参皂苷组、恩度组、联合组3组小鼠的V E G F m R N A、蛋白均明显低于对照组(均P<0.05);联合组的VEGF mRNA、蛋白均明显低于人参皂苷组、恩度组(均P<0.05);人参皂苷组与恩度组间无统计学差异(均P>0.05)(图1)(表3)。
表2 各组小鼠肿瘤组织中细胞周期分布情况比较(%,n=18,±s)

表2 各组小鼠肿瘤组织中细胞周期分布情况比较(%,n=18,±s)
注:1)与对照组比较,P<0.05;2)与联合组比较,P<0.05
组别 G0/G1期 S期 G2/M期对照组 53.29 33.18 12.46人参皂苷组 41.171),2) 29.111),2) 27.411),2)恩度组 38.201),2) 28.641),2) 29.531),2)联合组 31.161) 24.131) 34.881)F 42.180 21.694 49.807 P<0.001 <0.001 <0.001

图1 肿瘤组织中VEGF表达检测 A:VEGF mRNA检测;B:VEGF蛋白表达检测 1:对照组;2:人参皂苷组;3:恩度组;4:联合组
表3 各组小鼠肿瘤组织中VEGF mRNA、蛋白表达水平比较(光密度值,n=18,±s)

表3 各组小鼠肿瘤组织中VEGF mRNA、蛋白表达水平比较(光密度值,n=18,±s)
注:1)与对照组比较,P<0.05;2)与联合组比较,P<0.05
组别 VEGF mRNA VEGF蛋白对照组 1.294 0.562人参皂苷组 1.0441),2) 0.4611),2)恩度组 0.9381),2) 0.4451),2)联合组 0.7291) 0.2761)F 22.008 14.796 P<0.001 <0.001
2.4 各组小鼠肿瘤组织中MMP-2、MMP-9蛋白的表达率比较
人参皂苷组、恩度组、联合组3组小鼠肿瘤组织的MMP-2、MMP-9蛋白表达率明显低于对照组(均P<0.05);联合组的MMP-2、MMP-9蛋白明显低于人参皂苷组、恩度组(P<0.05);人参皂苷组与恩度组间无统计学差异(均P>0.05)(表4)。
表4 各组小鼠肿瘤组织中MMP-2、MMP-9蛋白表达率比较(%,n=18,±s)

表4 各组小鼠肿瘤组织中MMP-2、MMP-9蛋白表达率比较(%,n=18,±s)
注:1)与对照组比较,P<0.05;2)与联合组比较,P<0.05
组别 MMP-2 MMP-9对照组 34.06 32.96人参皂苷组 31.841),2) 28.501),2)恩度组 30.771),2) 28.111),2)联合组 27.091) 25.941)F 20.085 24.462 P<0.001 <0.001
3 讨 论
流行性病学研究[5]显示,乳腺癌与雌激素暴露存在密切联系,而我国日益增长的工业污染则进一步加剧了女性雌激素实际负荷量,最终导致我国乳腺癌发病率逐年增高。MCF-7细胞是一组以雌激素受体阳性为特征的人乳腺癌细胞,可特异性被雌激素及雌激素样活性因子激活,并增殖、分化[5-7],所以本研究选用MCF-7细胞进行乳腺癌小鼠的造模并研究了人参皂苷rg3联合恩度对肿瘤细胞的作用。
人参皂苷rg3是红参中提取的一种皂苷,对多种疾病具有改善、预防作用,如心脑血管疾病、冠心病、记忆力衰退等[8]。研究[9]表明,人参皂苷rg3对包括肺癌、胃癌等在内的多种肿瘤细胞具有抑制作用。本研究中,人参皂苷组、恩度组、联合组3组小鼠的肿瘤质量、体积均显著的低于对照组,并且联合组的肿瘤质量、体积均显著的低于人参皂苷组、恩度组,这表明人参皂苷rg3在抑制小鼠肿瘤增殖上具有显著疗效,如与恩度联合使用,这一抑制效用可进一步增强。对比各组小鼠肿瘤组织细胞周期发现,人参皂苷组、恩度组、联合组3组小鼠的G0/G1期、S期均显著的低于对照组,G2/M期细胞比例高于对照组;联合组的G0/G1期、S期显著的低于人参皂苷组、恩度组,G2/M期细胞比例显著的高于人参皂苷组、恩度组,这表明人参皂苷rg3可通过将肿瘤细胞周期阻滞在G2/M期来抑制肿瘤细胞增殖、侵袭,并且联合恩度使用,疗效更佳。
血管新生理论认为肿瘤增殖、分化与其内部毛细血管异常增生有关,而肿瘤新生血管生成影响因素则可能与以下几方面有关:⑴ 促血管生成因子与抑制因子平衡破坏;⑵ 内皮细胞与血管外基质几间质细胞相互作用[10];⑶ 血管内皮细胞内的相应靶点被激活,促使血管内皮基底膜降解,并诱导细胞外基质重塑[11]。VEGF是人体内最为重要的促血管生成因子,可与血管内皮细胞上的特异受体结合,并诱导血管生成[12]。本研究中,人参皂苷组、恩度组、联合组3组小鼠的VEGF mRNA、蛋白显著的低于对照组,提示人参皂苷rg3可通过抑制VEGF表达来降低肿瘤血管生成,并以此抑制肿瘤增殖、分化。此外,本研究还发现联合组的VEGF mRNA、蛋白显著的低于人参皂苷组、恩度组,这表明联合使用时,小鼠肿瘤VEGF的抑制作用更强。
MMPs是中性肤链内切酶家族,对多种细胞外基质具有降解作用。被破坏结构的血管将释放大量的血管生成因子,诱导内皮细胞迁移,参与肿瘤发生、发展[13]。MMP-9是MMPs家族分子量最大的酶,可被多种具有转移倾向的肿瘤细胞合成,并通过降解结构蛋白Ⅳ型胶原等来帮助肿瘤细胞突破各种屏障[14]。MMP-2同为MMPs家族成员,可作为酶原、糖基化参与物存在于人体各处。MMP-2对明胶,I、IV以及V型胶原具有裂解能力,并以此参与肿瘤侵袭过程[15]。本组研究中,人参皂苷组、恩度组、联合组三组小鼠的MMP-2、MMP-9蛋白显著的低于对照组;联合组的MMP-2、MMP-9蛋白显著的低于人参皂苷组、恩度组,这表明人参皂苷rg3+恩度对MMP-2、MMP-9的抑制效用最大,并以此降低肿瘤的侵袭性。本研究通过动物实验,对人参皂苷rg3+恩度的临床价值及作用机制进行分析,发现人参皂苷rg3+恩度可通过抑制促血管生成因子、MMPs家族表达,阻滞肿瘤细胞周期并降低肿瘤的侵袭性。但对于参皂苷rg3+恩度作用MCF-7乳腺癌细胞的信号路径以及具体靶点,我们尚无明确结论,这有待后续的研究。
综上所述,人参皂苷rg3联合恩度治疗MCF-7乳腺癌细胞移植小鼠,能显著减低M M P-2、MMP-9蛋白、VEGF mRNA、蛋白的表达,调节细胞周期分布,降低肿瘤侵袭性,从而达到抑制肿瘤的目的。
[1]孙大鹏, 顾立学, 李晨光, 等. 人参皂苷Rg3通过人乳腺珠蛋白A促进乳腺癌MDA-MB-231细胞凋亡及其可能的机制[J]. 中国肿瘤生物治疗杂志, 2017, 24(6):615–619. doi:10.3872/j.issn.1007–385X.2017.06.007.Sun DP, Gu LX, Li CG, et al. Ginsenoside Rg3 promotes the apoptosis of breast cancer MDA-MB-231 cells via regulation of mammaglobin-A expression[J]. Chinese Journal of Cancer Biotherapy, 2017, 24(6):615–619. doi:10.3872/j.issn.1007–385X.2017.06.007.
[2]陆玲玲. 人参皂苷Rg3联合索拉非尼对人肝癌细胞株侵袭与转移的影响[J]. 中国老年学杂志, 2016, 36(5):1067–1069. doi:10.3969/j.issn.1005–9202.2016.05.020.Lu LL. Effect of ginsenoside Rg3 plus sorafenib on invasiveness and metastasis of human liver cancer cells[J]. Chinese Journal of Gerontology, 2016, 36(5):1067–1069. doi:10.3969/j.issn.1005–9202.2016.05.020.
[3]孙大鹏, 鲁明明, 王硕, 等. 人参皂苷Rg3通过Ca2+/CaM信号系统抑制胃癌BGC-823细胞增殖及其可能的机制[J]. 中国肿瘤生物治疗杂志, 2015, 22(2):225–229. doi:10.3872/j.issn.1007–385X.2015.02.015.Sun DP, Lu MM, Wang S, et al. Ginsenoside Rg3 inhibits gastric cancer cell proliferation through Ca2 +/CaM kinase downregulation and NF-κ B inactivation[J]. Chinese Journal of Cancer Biotherapy,2015, 22(2):225–229. doi:10.3872/j.issn.1007–385X.2015.02.015.
[4]耿良, 范敬, 高启龙, 等. 人参皂苷Rg3和 PEG-PLGA-Rg3纳米微粒对Lewis 肺癌小鼠的作用及其机制[J]. 北京大学学报:医学版,2016, 48(3):496–501. doi:10.3969/j.issn.1671–167X.2016.03.021.Geng L, Fan J, Gao QL, et al. Preliminary study for the roles and mechanisms of 20(R)-ginsenoside Rg3 and PEG-PLGA-Rg3 nanoparticles in the Lewis lung cancer mice[J]. Journal of Peking University: Health Sciences, 2016, 48(3):496–501. doi:10.3969/j.issn.1671–167X.2016.03.021.
[5]Zhang Y, Liu QZ, Xing SP, et al. Inhibiting effect of Endostar combined with ginsenoside Rg3 on breast cancer tumor growth in tumor-bearing mice[J]. Asian Pac J Trop Med, 2016, 9(2):180–183.doi: 10.1016/j.apjtm.2016.01.010.
[6]周彤, 张丽红, 辛颖, 等. 20 (S)人参皂苷Rg3对糖尿病大鼠肾小管上皮细胞TGF-大鼠表达及凋亡的影响[J]. 中国老年学杂志, 2015, 35(18):5093–5094. doi:10.3969/j.issn.1005–9202.2015.18.020.Zhou T, Zhang LH, Xin Y, et al. Influence of 20 (S) ginsenoside Rg3 on TGF-β1 expression and apoptosis in renal tubular epithelial cells from diabetic rats[J]. Chinese Journal of Gerontology , 2015,35(18):5093–5094. doi:10.3969/j.issn.1005–9202.2015.18.020.
[7]李健莹, 栾晓娇, 王凯乾, 等. 人参皂苷Rg3固体分散体的制备及表征[J]. 中国药学杂志, 2015, 50(10):872–875.Li JY, Nuan XJ, Wang KQ, et al. Preparation and Characterization of Ginsenoside Rg3 Solid Dispersion[J]. Chinese Pharmaceutical Journal, 2015, 50(10):872–875.
[8]何斌, 钱立庭, 江浩. 人参皂苷Rg3对鼻咽癌放疗患者细胞免疫功能的影响[J]. 安徽医科大学学报, 2015, 50(9):1293–1296.He B, Qian LT, Jiang H. The effect of Rg3 ginsenosides on cellular immune function of nasopharyngeal carcinoma patients with radiotherapy[J]. Acta Universitatis Medicinalis Anhui, 2015,50(9):1293–1296.
[9]Wong AS, Che CM, Leung KW. Recent advances in ginseng as cancer therapeutics: a functional and mechanistic overview[J]. Nat Prod Rep, 2015, 32(2):256–272. doi: 10.1039/c4np00080c.
[10]成乐琴, 金富标. 柠檬汁辅助雪梨汁催化转化原人参二醇组皂苷制备稀有人参皂苷Rg3[J]. 河南工业大学学报:自然科学版, 2015,36(5):82–86.Cheng LQ, Jin FB. Snow pear juice catalytic conversion of protopanaxadiol type saponins to ginsenoside rg3 assisted by lemon juice[J]. Journal of Henan University of Technology: Natural Science Edition, 2015, 36(5):82–86.
[11]潘翠珊, 王风华, 翁艺芳, 等. 人参皂苷Rg3脂质体的处方优化及制备工艺研究[J]. 中药新药与临床药理, 2015, 26(1):113–117.Pan CS, Wang FH, Weng YF, et al. Study on Optimization of Formulation and Preparation Process of Ginsenoside Rg3 Liposomes[J]. Traditional Chinese Drug Research & Clinical Pharmacology, 2015, 26(1):113–117.
[12]蒋杰, 吴超, 鲁明明, 等. 介孔二氧化硅MCM-41 包载人参皂苷Rg3 纳米粒对人肺癌A549 细胞的作用研究[J]. 中国药学杂志,2016, 51(17):1478–1482.Jiang J, Wu C, Lu MM, et al. The Research of Mesoporous Silica Nanoparticles MCM-41 Loading Ginsenoside Rg3 for Human Lung Cancer Cells A549[J]. Chinese Pharmaceutical Journal, 2016,51(17):1478–1482.
[13]Kim SJ, An KK. Anti-breast cancer activity of Fine Black ginseng(Panax ginseng Meyer) and ginsenoside Rg5[J]. J Ginseng Res,2015, 39(2):125–134. doi: 10.1016/j.jgr.2014.09.003.
[14]郭跃龙, 钱静, 狄留庆, 等. 人参皂苷Rg3及人参皂苷Rh2在肠道菌群失调大鼠体内的药动学研究[J]. 中草药, 2016, 47(23):4198–4203. doi:10.7501/j.issn.0253–2670.2016.23.014.Guo YL, Qian J, Di LQ, et al. Pharmacokinetic study on ginsenoside Rg3 and ginsenoside Rh2 in gut microbiota dysbiosis rats[J].Chinese Traditional and Herbal Drugs, 2016, 47(23):4198–4203.doi:10.7501/j.issn.0253–2670.2016.23.014.
[15]张柘, 吴剑, 郑勇, 等. 人参皂苷Rg3抗骨肉瘤LJH-OS细胞裸鼠移植瘤的作用及其对肿瘤血管生成拟态的影响[J]. 中华实验外科杂志, 2015, 32(7):1569–1571. doi:10.3760/cma.j.issn.1001–9030.2015.07.024.Zhang Z, Wu J, Zheng Y, et al. Effect of ginsenoside-Rg3 on osteosrcoma cells LJH-OS xenograft in nude mice and vasculogenic mimicry[J]. Chinese Journal of Experimental Surgery, 2015,32(7):1569–1571. doi:10.3760/cma.j.issn.1001–9030.2015.07.024.

