酶解制备羊胎盘抗氧化肽工艺条件的优化
姜惠敏, 李 明,2, 曹光群*,2, 杨 成,2
酶解制备羊胎盘抗氧化肽工艺条件的优化
姜惠敏1, 李 明1,2, 曹光群*1,2, 杨 成1,2
(1.江南大学 化学与材料工程学院,江苏 无锡 214122;2.江南大学 食品胶体与生物技术教育部重点实验室,江苏 无锡214122)
对羊胎盘下脚料为原料制备羊胎盘抗氧化肽的工艺进行了研究。以DPPH自由基清除率和水解度为考察指标,分别采用4种蛋白酶酶解制备羊胎盘抗氧化多肽,结果表明木瓜蛋白酶酶解产物的自由基清除率最高且水解度适中,因此木瓜蛋白酶被确定为水解酶。通过单因素试验与二次响应面回归分析对酶解工艺参数进行了优化。最佳酶解条件为:底物质量浓度33 mg/ mL、pH 6.4、酶解温度55℃、加酶量4 900 U/g、酶解时间120 min,此时羊胎盘蛋白水解度为7.92%,10 mg/mL酶解产物对DPPH自由基、超氧阴离子自由基与羟基自由基的清除率分别可达92.15%、93.45%与46.88%,显示出较好的抗氧化活性。
羊胎盘;酶解;抗氧化肽;响应面法
与其它动物胎盘相比,羊胎盘与人胎盘的结构和成分最为相似,具有良好的营养价值[1]。羊胎盘中含有大量的表皮细胞生长因子、透明质酸刺激因子等生物活性因子,多种促进、改善组织新陈代谢的酶,17种氨基酸和14种矿物元素。而利用科学方法从羊胎盘中提取、纯化的活性物质,其主要成分为小分子多肽,具有提高机体免疫力、抗衰老、抗癌等作用,广泛应用于医疗保健、食品、化妆品等领域[2-3]。
羊胎盘抗氧化肽主要通过匀浆、低温离心、超滤的工艺从羊胎盘中提取得到,但产率极低且浸提液中的多肽及氨基酸含量甚微。绝大多数研究工作对提取过程中离心后的沉淀直接舍弃[4-6],而此物料富含蛋白质,若进一步水解成小分子活性肽,可使胎盘的应用价值得到充分的利用。蛋白质水解产生活性肽主要有酶法和化学法。化学法采用酸碱水解制备活性肽,对氨基酸会产生破坏作用,并且水解产物分子组成差异大、生产费用高。而酶法水解蛋白质的生产条件温和、安全性高、易于控制,因此已成为目前制备生物活性肽的主流方法[7-9]。作者以提取羊胎盘肽过程中低温离心所得残渣(即羊胎盘下脚料)为原料,采用酶法制备抗氧化肽,旨在为促进羊胎盘蛋白的深度开发、寻找具有抗氧化活性的新型多肽、充分利用农副加工业的废弃资源提供有效途径。
1 材料与方法
1.1 材料与试剂
羊胎盘:江苏小尾羊牧业科技有限公司提供;羊胎盘下脚料:提取天然羊胎盘活性肽后低温离心所得残渣,冷冻干燥后用粉碎机粉粹,过60目筛,冷藏备用;碱性蛋白酶:广西南宁庞博生物工程有限公司产品;胰蛋白酶:国药集团化学试剂有限公司产品;木瓜蛋白酶:上海源叶生物科技有限公司产品;中性蛋白酶:苏柯汉生物工程科技有限公司产品;1,1-二苯基-2-三硝基苯肼:阿法埃莎(天津)化学有限公司产品;谷胱甘肽:南京森贝伽生物科技有限公司产品;其余试剂均为分析纯,国药集团化学试剂有限公司产品。
1.2 仪器与设备
DFY-300型高速粉碎机:温岭市林大机械有限公司产品;JA1003型电子天平:上海精科天平厂产品;KDN-103F型自动定氮仪:上海纤检仪器有限公司产品;JJ-2型组织匀浆机:江苏省金坛市荣华仪器制造有限公司产品;LDZ4-2型自动平衡离心机:江苏省金坛市医疗仪器产品;PHSJ-3F型pH计:上海雷磁仪器厂产品。
1.3 方法
1.3.1 基本成分的测定 蛋白质测定:凯式定氮法[10];多糖:苯酚-硫酸法[11]。
1.3.2 蛋白酶活力的测定 蛋白酶活力测定采用Folin法[12]。
1.3.3 水解度的测定 水解度 (DH)的测定采用pH-stat法[13]。
1.3.4 抗氧化活性的测定 清除二苯代苦味肼基自由基(DPPH·)能力的测定采用分光光度法[14];清除超氧阴离子自由基(O2-·)能力测定采用邻苯三酚法[15];清除羟基自由基(OH·)能力测定采用邻二氮菲法[16]。
1.3.5 酶水解羊胎盘下脚料制备羊胎盘肽 准确称取一定质量的羊胎盘下脚料粉末,加入去离子水配成一定质量浓度的底物溶液,迅速升温至90℃,恒温15 min后,调节温度和pH值,加入蛋白酶酶解一定时间,水解结束后升温至90℃,保持20 min进行灭酶处理,冷却至室温,调节pH至中性,6 500 r/min下离心20 min,取上清液,冷冻干燥后进行分析测定。以酶解产物的DPPH·清除率和水解度为考察指标,选择最佳用酶。
1.3.6 酶解工艺参数的优化 固定酶解时间为120 min,对木瓜蛋白酶的水解工艺参数进行单因素优化试验,包括温度、加酶量、pH和底物质量浓度。
综合单因素试验结果,固定酶解时间为120 min,底物质量浓度为33 mg/mL,以温度(X1)、加酶量(X2)和pH(X3)3个因素作为自变量,以DPPH·清除率为响应值(Y),根据Box-Behnken中心组合设计原理[20],采用响应面法在3因素3水平上对木瓜蛋白酶酶解制备羊胎盘肽的工艺参数进行优化。试验因素和水平见表1。
2 结果与分析
2.1 基本成分
羊胎盘下脚料粉末中蛋白质质量分数为81.41%,多糖质量分数16.04%。可见,羊胎盘下脚料富含蛋白质,可作为蛋白资源进一步开发利用。

表1 响应面分析因素及水平表Table 1 Factors and levels of the response surface analysis
2.2 最适蛋白酶的选择
由于各种蛋白酶的作用位点不同以及底物特异性的差异,根据羊胎盘蛋白的氨基酸组成,筛选出木瓜蛋白酶、胰蛋白酶、中性蛋白酶和碱性蛋白酶等4种常见的蛋白酶,并在其最适条件下对羊胎盘下脚料进行水解。各种酶的反应条件见表2,酶解效果见图1。

表2 4种酶的最适水解条件Table 2 Optimal hydrolysis conditions for four proteases
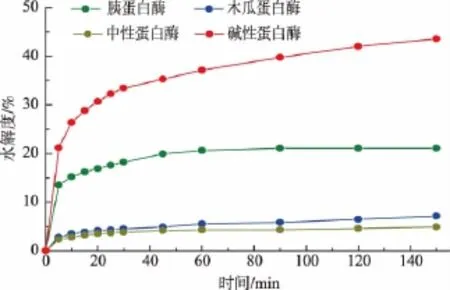
图1 各种蛋白酶对羊胎盘下脚料的酶解进程曲线Fig.1 Time courses of hydrolysis degree of sheep placenta byproduct proteins with four enzymes
水解度(DH)可量化反映酶解进程。但是,DH不同的条件下,由于蛋白酶对肽键的切割程度不同,会使相应的小分子多肽在质量浓度及性质上有所区别,所以只以DH为指标不能客观反映出水解的效果。本实验中,酶解羊胎盘下脚料的最终目的是获取具有抗氧化活性的小分子多肽,因此,确定以抗氧化活性作为第一指标,DH为第二指标进行研究。大量研究结果证实DPPH法能快速灵敏地反映外源抗氧化剂的抗氧化能力,所以实验中选择该方法来评价酶解产物的抗氧化活性的高低。结果见表3。
由图1和表3可知,4种蛋白酶对羊胎盘下脚料蛋白的酶解效果存在较大的差异。其中,碱性蛋白酶的酶解能力最高,但其酶解产物没有抗氧化活性;木瓜蛋白酶酶解产物的抗氧化活性最高,且水解度适中。此外,木瓜蛋白酶的最适pH值为中性,不需要在反应前后加入过多的碱来调节pH值,工艺简单、成本小,所以选用木瓜蛋白酶作为水解用酶。从图1还可看出,木瓜蛋白酶酶解反应进行到120 min后,水解度增加趋于平缓,综合考虑反应效率和成本,选择酶解的时间为120 min。
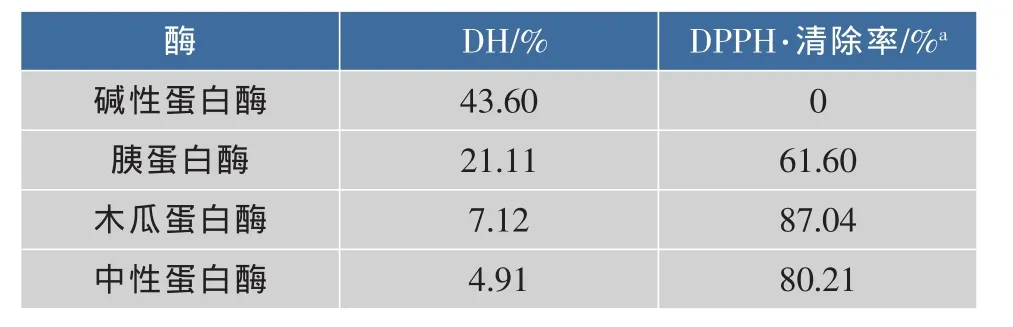
表3 不同酶解产物的水解度和DPPH·清除率Table 3 Degree of hydrolysis and DPPH radical scavenging activities of different hydrolysates
2.3 单因素试验
2.3.1 pH对酶解反应的影响 酶在特定pH条件下才有催化活性,pH过高或过低都可能会引起酶构象的改变而导致酶失活。此外,酶分子活性部位的解离和底物蛋白的解离也会随pH的变化而变化,从而影响酶分子与底物的结合与催化。固定酶解温度55℃,底物质量浓度20 mg/mL,加酶量5 000 U/g,水解120 min,研究pH对羊胎盘下脚料酶解的影响,结果见图2。
由图2可知,pH对酶解反应影响显著,当pH值低于6.5时,pH升高,DH增加,而酶解产物的DPPH·清除率变化不大;但在pH值超过6.5之后,pH升高,DH和酶解产物的DPPH·清除率均明显下降。因此选择酶解溶液的pH值为6.5。

图2 pH对DH和酶解产物DPPH·清除率的影响Fig.2 Effect of pH on DH and DPPH· scavenging activities
2.3.2 加酶量对酶解反应的影响 固定酶解温度55℃,底物质量浓度20 mg/mL,pH值6.5,水解120 min,研究加酶量对羊胎盘下脚料酶解的影响,结果见图3。随着加酶量的增多,DH明显增大。这说明在底物过饱和情况下,加酶量的增加可以提高底物与酶的结合效率,进而加快底物转化成产物的速率。但在加酶量超过5 000 U/g后,酶分子趋向于饱和,DH的增加也趋于平缓。另一方面,酶解产物的DPPH·清除率随着加酶量的增多而增大,在加酶量超过3 000 U/g后增幅变小,当加酶量为5 000 U/g时DPPH·清除率达到90.89%。综合考虑成本和效率等因素,选择加酶量为5 000 U/g。

图3 加酶量对DH和酶解产物DPPH·清除率的影响Fig.3 Effect of enzyme dosage on DH and DPPH· scavenging activity
2.3.3 温度对酶解反应的影响 固定加酶量5 000 U/g,底物质量浓度20 mg/mL,pH值6.5,水解120 min,研究温度对羊胎盘下脚料酶解的影响,结果见图4。由图4可知,随着温度升高,DH和酶解产物的DPPH·清除率都增大,当温度为55℃时,两者均达到最大,继续升高温度,DH和酶解产物的DPPH·清除率均降低。这是因为在适度范围内提高温度可加快反应速度,但过高的温度会使酶蛋白的结构发生改变,而导致酶活性降低。因此,选择酶解温度为55℃。
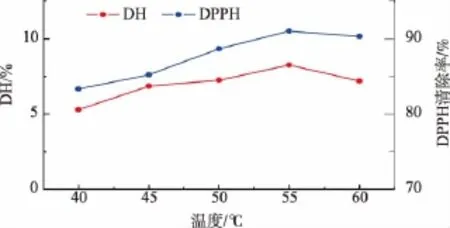
图4 温度对DH和酶解产物DPPH·清除率的影响Fig.4 Effect of temperature on DH andDPPH· scavenging activity
2.3.4 底物质量浓度对酶解反应的影响 固定酶解温度55℃,加酶量5 000 U/g,pH值6.5,水解120 min,研究底物质量浓度对羊胎盘下脚料酶解的影响,结果见图5。由图5可知,当底物质量浓度小于33 mg/mL时,酶未被饱和,DH随着底物质量浓度的增加而缓慢上升;但当底物质量浓度超过33 mg/mL时,DH迅速下降。这是由于底物质量浓度较低时,底物分子与酶分子间结合几率较低,反应速率慢,导致DH较低;而底物质量浓度较高时,底物蛋白之间会产生交联聚合现象,降低了体系内酶与底物分子接触的几率,反应速率减慢,从而导致酶解效率下降。当底物质量浓度为33 mg/mL时酶解产物的DPPH·清除率最高,达到92.14%。因此,选择33 mg/mL为最佳水解底物浓度。
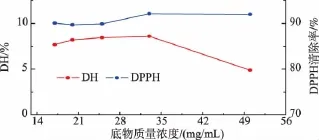
图5 底物质量浓度对DH和酶解产物DPPH·清除率的影响Fig.5 Effect of substrate concentration on DH and DPPH·scavenging activity
2.4 酶解工艺参数的响应面优化
2.4.1 响应面试验 响应面分析(RSA)法是一种寻找多因素体系中最佳条件或工艺的数学统计方法,能以最经济的方式对试验进行全面科学的研究,得到明确的结论,并对结果进行预测。它的突出优势是,在试验条件寻求过程中,可以连续地对试验各水平进行分析,而正交试验只能对孤立的试验点进行分析。按照表1中的因素和水平,对木瓜蛋白酶酶解羊胎盘下脚料制备羊胎盘肽的工艺参数进行响应面优化,试验结果及方差分析分别见表4和表5。
根据表4试验结果建立的响应值与各实验因子的数学回归模型为:
Y=91.16-0.70X1+0.12X2-1.29X3-0.87X1X2+ 1.43X1X3+1.9X2X3-5.01X12-1.87X22-5.79X32
从表5可以看出,回归方程失拟度P=0.478 4>0.05,检验不显著,说明拟合的二次回归模型是适当的;模型的P值<0.000 1,检验极显著,说明模型与实际情况拟合较好;复相关系数R2为0.997 4,说明实测值与预测值之间有高度的相关性。校正决定系数Adj R2为0.992 6,说明该模型能解释99.26%响应值的变化。由此可知,该模型可信度高,可作为进一步分析的依据。表5中还可以看出,温度和pH 2个因素的一次项,及温度、加酶量和pH 3个因素的二次项对酶解产物DPPH·清除率的影响均达到了极显著的水平(P<0.01)。由F值可知各因素对酶解产物DPPH·清除率的影响大小顺序为:pH>酶解温度>加酶量。

表4 响应面试验设计与结果Table 4 Experimental design and results of response surface analysis

表5 Y回归方程及各项的方差分析Table 5 Variance of the Y regression equation
2.4.2 交互作用对DPPH·清除率的影响 将回归方程中某一因素固定在初始水平,即得到另外两个因素对Y的模型,根据所得模型可绘制出相应的响应面分析图及等高线图。酶解温度(A)、加酶量(B)及pH(C)交互作用对DPPH·清除率(Y)的影响如图6、7、8所示。由图可知,酶解产物对DPPH·清除率随着pH、酶解温度和加酶量的增加而呈现先增加后减少的趋势。
通过二次多项数学模型解逆矩阵,得出酶解羊胎盘粉末的最佳工艺为底物质量浓度33 mg/mL、pH 6.4、酶解温度55℃、加酶量4 900 U/g、酶解时间 120 min。最佳条件下羊胎盘蛋白水解度为7.92%,10 mg/mL酶解产物最大DPPH·清除率预测值为91.27%。
采用上述最优工艺条件进行酶解验证试验。实际测得酶解产物的DPPH·清除率为92.15%,与理论预测值相比,相对误差仅为0.96%。所以,采用RSA法优化得到的木瓜蛋白酶酶解羊胎盘下脚料的工艺参数准确可靠,具有实用价值。
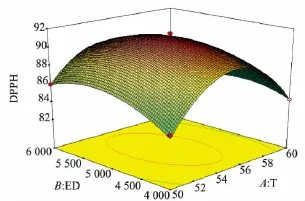
图6 加酶量和温度交互作用的响应曲面和等高线Fig.6 3D response surface plot(left)and the contour(right)of antioxidant activity showing effects of enzyme dosage(ED)and temperature(T)
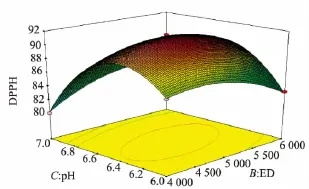
图7 pH和加酶量交互作用的响应曲面和等高线Fig.7 3D response surface plot(left)and the contour(right)of antioxidant activity showing effects of enzyme dosage(ED)and pH
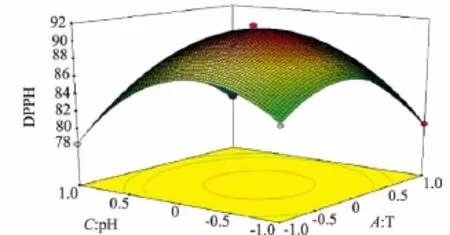
图8 pH和温度交互作用的响应曲面和等高线Fig.8 3D response surface plot(left)and the contour(right)of antioxidant activity showing effects of pH and temperature(T)
2.5 酶解产物的抗氧化活性
对一种抗氧化剂的作用评价与相应的试验体系紧密相关,单一体系往往很难全面体现其抗氧化能力,因此需采用不同体系来研究抗氧化剂的作用效果[17]。除了测定DPPH·清除率之外,通过测定酶解产物对O2-·和·OH的清除能力,对其体外抗氧化能力进行了评价。结果表明,当质量浓度为10 mg/mL时,酶解产物对O2-·和·OH的清除率分别可达93.45%与 46.88%,其 IC50分别为 1.69 mg/mL和10.68 mg/mL。以谷胱甘肽作为阳性对照,测得其清除这两种自由基的IC50值分别为0.045 mg/mL和1.659 mg/mL。与文献相比较,在相同浓度下,酶解产物对 O2-·的清除能力显著高于蛋清蛋白肽(27.87%)[18]和罗非鱼骨架蛋白肽(58.5%)[19]。此外,测得酶解产物清除DPPH·的IC50为1.70 mg/mL,明显低于猪胎盘肽(9.97 mg/mL)[20],高于藻蛋白肽(98 ug/mL)[21]。经过比较,可以看出酶解羊胎盘蛋白肽具有较高的抗氧化活性,但其分离纯化及药理作用机制有待于进一步深入地系统研究。
3 结语
1)以DPPH·清除率和水解度为考察指标,筛选出木瓜蛋白酶为酶解羊胎盘下脚料的最适蛋白酶。在单因素试验基础上采用响应面法优化了酶解羊胎盘蛋白的工艺参数。最佳酶解条件为:pH 6.4、温度55℃、加酶量4 900 U/g、底物质量浓度33 mg/ mL、水解时间120 min,此时水解度为7.92%,10 mg/mL酶解产物对DPPH·清除率达92.15%。
2)对酶解羊胎盘蛋白肽进行了体外抗氧化活性检测,发现其具有较高的DPPH·、O2-·和·OH清除率,显示出较好的抗氧化能力,可作为一种天然抗氧化肽清除机体内自由基、延缓机体衰老。
[1]WU Yun.Study on the new method of extraction placental peptide and analysis of nutritive composition in sheep’s placenta[J]. Food Science,2005,26(9):295-297.(in Chinese)
[2]KOVO M,SCHREIBER L,BEN-HAROUSH A,et al.The placental factor in early-and late-onset normotensive fetal growth restriction[J].Placenta,2013,34(4):320-324.
[3]WANG Bingxiang,GU Guosheng,LI Xinyu,et al.Separation and effect of low molecular placental polypeptide from goats on anti-oxidation activity of mice[J].Southwest China Journal of Agricultural Sciences,2011,24(10):315-318.(in Chinese)
[4]LIU Longxing,REN Xinghong,TANG Hejing,et al.Separation and purification of small-molecule peptides with immunomodulating activity from goat placenta[J].Food Science,2013,34(22):273-276.(in Chinese)
[5]LIU Wangwang,HUO Yinchen,CHENG Yongxia,et al.Polypeptide preparation of sheep placenta and its free radicals scavenging activity[J].China Brewing,2014,33(9):89-93.(in Chinese)
[6]WU Kaiping,WEI Hong,LIU Yu.Study on immunocompetence of sheep placental extract by E-Rosette test[J].Pharmaceutical Biotechnology,2005,12(6):393-396.(in Chinese)
[7]NAZEER R A,SRIVIDHYA T S.Antioxidant peptides from the protein hydrolysates of Conus betulinus[J].International Journal of Peptide Research and Therapeutics,2011,17(3):231-237.
[8]TANZADEHPANAH H,ASOODEH A,CHAMANI J.An antioxidant peptide derived from Ostrich(Struthio camelus)egg white protein hydrolysates[J].Food Research International,2012,49(1):105-111.
[9]NAQASH S Y,NAZEER R A.Optimization of enzymatic hydrolysis conditions for the production of antioxidant peptides from muscles of nemipterus japonicus and exocoetus volitans using response surface methodology[J].Peptides,2012,43(1):337-345.
[10]张水华.食品分析[M].北京:中国轻工业出版社,2006.
[11]WU Dan,NIE Wenjing,JIANG Yan,et al.Comparison of two methods for determination of the polysaccharide from the black mulberry[J].Food Science and Technology,2014,39(7):309-312.(in Chinese)
[12]郑宝东.食品酶学[M].南京:东南大学出版社,2006.
[13]Alder-nissen J.Enzymatic hydrolysis of food protein[M].London:Elsevier Applied Science Publishers Ltd,1986:12-14,39-41.
[14]SHAHIDI F,LIYANA-PATHIRANA C M,WALL D S.Antioxidant activity of white and black sesame seeds and their hull fractions[J].Food Chemistry,2006,99(3):478-483.
[15]MARKLUND S,MARKLUND G.Involvement of superoxide anion radicals in the autoxidantion of pyrogallol and a convenient assay for superoxide dismutase[J].European Journal of Biochemistry,1974,47(3):469-474.
[16]MULLER L,FROHLICH K,BOHM V.Comparative antioxidant activities of carotenoids measured by ferric reducing antioxidant power(FRAP),ABTS bleaching assay(alpha TEAC),DPPH assay and peroxyl radical scavenging assay[J].Food Chemistry,2011,129(1):139-148.
[17]WANG Xiaoyu,DU Guorong,LI Hua.Progress of analytical methods for antioxidant capacity in vitro[J].Journal of Food Science and Biotechnology,2012,31(3):247-252.(in Chinese)
[18]CHEN Chen,CHI Yujie,ZHAO Mingyang,et al.Purification and identification of antioxidant peptides from egg white protein hydrolysate[J].Amino Acids,2012,43(1):457-466.
[19]FAN Jian,HE Jintang,ZHUANG Yongliang,et al.Purification and identification of antioxidant peptides from enzymatic hydrolysates of Tilapia frame protein[J].Molecules,2012,17(11):12836-12850.
[20]师玉淼.猪胎盘功能肽的分离纯化及其活性的初步研究[D].临安:浙江农林大学,2013.
[21]SHEIH I C,WU T K,FANG T J.Antioxidant properties of a new antioxidative peptide from algae protein waste hydrolysate in different oxidation systems[J].Bioresource Technology,2009,100(13):3419-3425.
Preparation of Antioxidant Peptides From Sheep Placenta Byproducts by Enzymatic Hydrolysis
JIANG Huimin1, LI Ming1,2, CAO Guangqun*1,2, YANG Cheng1,2
(1.School of Chemical and Material Engineering,Jiangnan University,Wuxi 214122,China;2.Key Laboratory of Food Colloids and Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
This study aimed to prepare antioxidant peptides from sheep placenta byproducts by enzymatic hydrolysis.Four proteases were used and degree of hydrolysis(DH)and DPPH radical scavenging activity were evaluated.Results showed that the hydrolysate by papain possessed the strongest DPPH radical scavenging activity in spite of a moderate DH.Through single factor tests and the response surface regression analysis,the optimal hydrolysis conditions by papain were thus obtained to be substrate concentration 33 mg/mL,pH 6.4,temperature 55℃,enzyme dosage 4 900 U/g and hydrolysis time 120 min.With these parameters,the hydrolysis resulted in a DH of 7.92% and the hydrolysate had strong scavenging activities for radicals DPPH·,O2-·and·OH with scavenging rates of 92.15%,93.45%and 48.88%,respectively(10 mg/mL).
sheep placenta,enzymatic hydrolysis,antioxidant peptide,response surface methodology
TQ 936.1
A
1673—1689(2017)01—0098—07
2015-03-16
*通信作者:曹光群(1959—),男,江苏宜兴人,高级工程师,主要从事天然产物香妆品研究。E-mail:gqcao59@126.com
姜惠敏,李 明,曹光群,等.酶解制备羊胎盘抗氧化肽工艺条件的优化[J].食品与生物技术学报,2017,36(01):98-104.

