泰拉霉素完全抗原的合成和鉴定
朱欣凤, 张亦凡, 张银志, 孙秀兰, 王轶凡, 李 影
泰拉霉素完全抗原的合成和鉴定
朱欣凤1,2, 张亦凡3, 张银志*2, 孙秀兰1,2, 王轶凡1, 李 影1
(1.江南大学 食品学院,江苏 无锡214122;2.食品科学与技术国家重点实验室,江南大学,江苏 无锡214122;3.陕西省汉中市产品质量监督检验所,陕西 汉中723000)
利用丁二酸酐法对泰拉霉素的羟基衍生化,引入游离羧基,合成泰拉霉素半抗原。采用活泼酯法将泰拉霉素半抗原分别与牛血清白蛋白(BSA)和鸡卵清白蛋白(OVA)偶联,合成人工完全抗原泰拉霉素-BSA和泰拉霉素-OVA。利用LC-MS鉴定衍生化后半抗原的合成,利用荧光光谱、考马斯亮法鉴定完全抗原的合成。用泰拉霉素-BSA免疫小鼠,采用间接ELISA法测定小鼠抗血清效价。泰拉霉素半抗原和 BSA的偶联比为 17∶1。三免后小鼠抗血清效价可达1∶8 000。
泰拉霉素;完全抗原;ELISA;鉴定
泰拉霉素(Tulathromycin,C41H79N3O12),是中国2008年批准使用的一种动物专用的半合成大环内酯类抗生素[1]。泰拉霉素药效强、用量少,将会逐渐替代已经产生抗药性的泰乐菌素和替米考星等现有的大环内酯类抗生素,应用潜力巨大。但抗生素残留一直是公众关注的一个焦点问题,抗生素残留会危害人体健康,并对生态环境产生恶劣影响,为此有必要研究泰拉霉素的残留快速检测的分析方法。目前主要利用放射性标记测定法和HPLC-MSMS测定泰拉霉素残留[2-5]。后者较为常用,但是样本前处理复杂、测定过程繁琐、仪器使用成本高,不能满足现场快检的要求。而免疫分析方法的优势十分明显:样本前处理简单,仪器设备费用低,灵敏度高[6]。因此适合抗生素残留的现场筛选和大量样品快速检测。但是目前国内外还没有泰拉霉素酶联免疫吸附检测法(ELISA)的相关报道。作者首次成功合成了泰拉霉素完全抗原。首先将泰拉霉素改造为具有活性羧基的半抗原,采用活泼酯法合成免疫原泰拉霉素-BSA和包被原泰拉霉素-OVA,为泰拉霉素检测试剂盒的研制开辟了道路。
1 材料与方法
1.1 材料与试剂
泰拉霉素、丁二酸酐、牛血清白蛋白(BSA)、卵清蛋白(OVA)、碳二亚胺盐酸盐(EDC.HCL)、N-羟基丁二酰亚胺(NHS)、弗氏完全佐剂、明胶、弗氏不完全佐剂:购自sigma公司;羊抗鼠二抗(Jackson);吡啶、甲醇、乙酸乙酯、N,N-二甲基甲酰胺(DMF):AR,购自国药集团。
1.2 仪器与设备
BioTeK型酶标仪:柏腾公司产品;F-7000型荧光光度计:日立公司产品;磁力搅拌器:Ika公司产品;分光光度计UV-1800:津岛公司产品;LC-MS:Waters公司产品;八道可调移液器:Eppendorf公司产品。
1.3 实验动物
SPF级雌性Balb/c小鼠:购自苏州苏普思生物科技有限公司。
1.4 泰拉霉素抗原合成
1.4.1 泰拉霉素半抗原合成 泰拉霉素结构中有自由的羧基,因此通过琥珀酸酐法衍生而引入羧基[7]。取4 mg泰拉霉素标准品溶于500 μL无水吡啶中,加入1 mg丁二酸酐,114℃回流搅拌反应6 h。氮气吹干反应液得泰拉霉素衍生物。
1.4.2 泰拉霉素抗原的合成 完全抗原的合成采用活泼酯法[8]。将泰拉霉素衍生得到的上述产物、0.6 mg EDC、0.4 mg NHS溶于300 μL DMF,室温搅拌反应30 min。将6 mg BSA溶于2 mL PBS,把活化好的泰拉霉素衍生物边搅拌边逐滴加入BSA溶液中,4℃反应过夜。反应结束后,用PBS透析3 d,每6 h换一次液。
包被原用OVA作为载体蛋白,合成方法一样。
1.5 泰拉霉素半抗原的鉴定
利用液质联用仪对半抗原进行鉴定。
液相色谱检测条件如下:液相色谱柱ZORBAX SB-C18,(150 mm×4.6 mm,5 μm);流动相:V(水)∶V(甲醇)=65∶35;进样量:10 μL;流动相流量:1.0 mL/ min;柱温为30℃。
质谱条件:电离模式为 (ESI+),检测模式:V模式;毛细管电压:3.5 kV,锥孔电压:20 V,检测器电压:1 600 V,离子源温度:100℃,脱溶剂气温度:250℃。
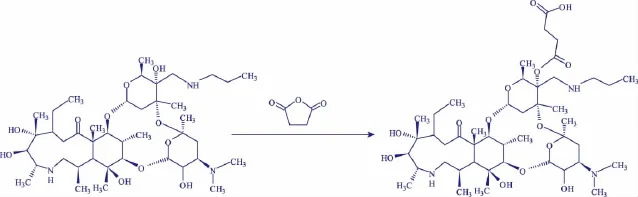
图1 泰拉霉素半抗原合成路线Fig.1 Illustration of synthesize reactions of Tulathromycin hapten
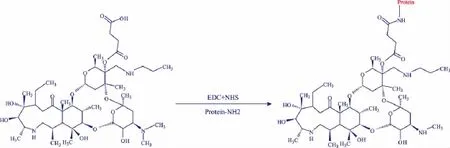
图2 泰拉霉素完全抗原合成路线Fig.2 Illustration of synthesize reactions of the complete antigen of Tulathromycin
1.6 泰拉霉素完全抗原的鉴定
1.6.1 荧光光谱 用体积分数50%甲醇PBS溶液做稀释液,分别取0.1 mg/mL BSA、0.01 mg/mL泰拉霉素和0.1 mg/mL BSA的混合物,0.1 mg/m LBSA-泰拉霉素偶联物,0.01 mg/mL泰拉霉素于1 cm石英比色皿中。体积分数50%甲醇PBS溶液为空白对照。设置激发波长为278 nm,激发和发射单色仪的狭缝宽度均为5 nm,扫面速度为300 nm/min,扫描范围300~500 nm,进行荧光发射光谱扫描测定[9]。
1.6.2 考马斯亮蓝法测偶联率 采用考马斯亮蓝法测定蛋白中游离氨基[10]。分别取1 mg/mL BSA蛋白溶液0、0.02、0.04、0.06、0.08、0.10 mL,加蒸馏水定容至1 mL,加入考马斯亮蓝G-250染液5 mL,静置10 min,595 nm波长下测定其吸光度。相同方法测定一系列浓度梯度的偶联物吸光度。
1.7 动物免疫
按照100 μg/只的剂量,通过皮下注射的途径免疫5只雌性Balb/c小鼠。首次免疫时将免疫原与完全弗氏佐剂按照1∶1的比例混合乳化。以后将免疫原与不完全弗氏佐剂按照1∶1的比例混合乳化,每间隔两周进行一次加强免疫。
1.8 效价测定
3次注射免疫后尾部取血利用间接法测效价[11]。利用棋盘法确定包被原泰拉霉素-OVA、抗体、酶标二抗的浓度。ELISA的操作流程如下:用碳酸盐缓冲液CBS(pH 9.6,)将包被原稀释到一定浓度,每孔加入100 μL,4℃包被过夜。孔板用PBST洗涤后,用质量分数0.4%的明胶封闭,洗涤液洗3次,拍干。加入一定浓度的标准品和稀释血清各50 μL,作为37℃下孵育1 h,洗涤4次,拍干。加入一定浓度的酶标二抗,每孔100 μL,37℃孵育30 min后,洗涤拍干,加入底物液和显色液,作用15 min后,加入终止液。用酶标仪测各孔A450nm值。以未免疫的小鼠的血清作为阴性对照,P/N2.1判定为阳性反应,阳性反应血清的最大稀释度为待测样品的效价。
2 结果与分析
2.1 液质联用鉴定
液质连用仪采用EI离子源,泰拉霉素的相对分子质量为 806.08,丁二酸酐相对分子质量为100.07。根据推测,泰拉霉素结构中的羟基与丁二酸酐反应后得到的衍生物相对分子质量理论值为906.08。由图3中的质谱图可以看出衍生物质荷比为906.6的峰,与理论值一致,证明成功引入了羧基,可以进行下一步完全抗原的制备。
2.2 荧光光谱鉴定
利用荧光光谱鉴定完全抗原,结果见图3。牛血清白蛋白上的色氨酸、酪氨酸残基会产生荧光。当BSA的酪氨酸、色氨酸残基上的伯氨基与小分子抗原的羧基以酰胺键偶联后,BSA的荧光光谱会改变。由图4可见,BSA-泰拉霉素偶联物荧光发射强度明显低于同浓度的牛血清白蛋白的荧光发射强度,对照泰拉霉素及泰拉霉素和BSA混合物的荧光光谱可以初步鉴定泰拉霉素和BSA偶联成功。
2.3 考马斯亮蓝比色法测偶联率
由于泰拉霉素在紫外可见光区没有特征吸收,所以考虑考马斯亮蓝比色法测偶联率。考马斯亮蓝G-250染液与蛋白质分子中的自由氨基结合,因此可根据BSA本身固有的自由氨基酸数目和BSA偶联小分子后结构中剩余的自由氨基酸数目来测定偶联率[12]。

图3 泰拉霉素半抗原合成的质谱分析结果Fig.3 LC-MS/MS result of Tulathromycin hapten

图4 BSA及泰拉霉素-BSA偶联物的荧光光谱Fig.4 Fluorescence spectrometry of BSA and BSATulathromycin
A=(εbN/M)C,其中A为吸光度值,εb为摩尔吸光系数,N为每个BSA自由氨基酸数目,C为蛋白浓度,M为BSA或BSA-泰拉霉素的相对分子质量。
得 ABSA=(εbNBSA/MBSA)CBSA
ABSA-AT=(εbNBSA-T/MBSA-T)CBSA-T
KBSA=ABSA/CBSA=εbNBSA/MBSA
KBSA-T=ABSA-T/CBSA-T=εbNBSA-T/MBSA-T
其中,K为直线斜率
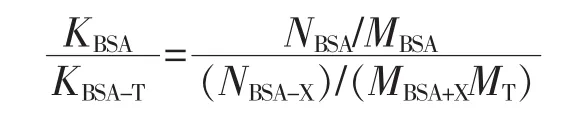
根据文献报道 NBSA=60,MBSA=66 430,MT= 806.08,经实验测得KBSA=0.007 3,KBSA-T=0.005 6,由此得出泰拉霉素与BSA的偶联比约为17∶1。
2.4 抗体效价的测定
采用间接ELISA测定小鼠血清效价。三免后以1 μg/mL包被抗原包板,3号小鼠血清效价最高,达到1∶8 000,测定结果见表1,1号和5号小鼠血清效价为1∶4 000,2号小鼠血清效价为1∶2 000。其中3号小鼠抗血清的IC50为98.5 μg/L。实验结果充分说明了人工抗原泰拉霉素-BSA和泰拉霉素-OVA的合成是成功的。

表1 3号小鼠抗血清效价测定结果Table 1 Titration of the third mouse’s antiserum
3 结语
相对分子质量低于1 000的小分子物质通常不具有免疫原性,进入生物体内后并不能诱导抗体的产生,这样的小分子必须与载体蛋白偶联形成完全抗原后才具有免疫原性[13-14]。考察泰拉霉素结构后决定通过泰拉霉素的羟基与丁二酸酐反应,从而引入羧基,然后偶联载体蛋白,形成完全抗原。通过质谱鉴定可以确认半抗原衍生后产物的相对分子质量为906.6,与理论值基本一致。证明了半抗原衍生化成功。通过荧光光谱确认载体蛋白与泰拉霉素成功偶联。鉴于泰拉霉素没有紫外吸收,故利用考马斯亮蓝法测得偶联率为17∶1。有报道,偶联比在1∶8~1∶20的完全抗原的免疫效果较好,但根据笔者经验,偶联比的多少与抗体效价和特异性没有特定的直接关系。蛋白和半抗原经验证确实偶联成功后可以免疫小鼠,作者通过动物实验验证完全抗原的合成确实是成功的。实验证明其免疫效果良好,合成工艺简单,为泰拉霉素免疫分析方法的建立和检测 试剂盒的研制奠定了基础。
[1]KANG Jijun,WANG Lixia,ZENG Zhengling.A new macrolide antibiotic tulathromycin for animals[J].Guangdong Journal of Animal and Veterinary Science,2010,35(2):7-10.(in Chinese)
[2]HUANG X H,ZHAO Y D,HE L M,et al.Development of high performance liquid chromatography-tandem mass spectrometry method for the detection of tulathromycin in swine plasma[J].Journal of Integrative Agriculture,2012,11(3):465-473.
[3]GAJDA A,A POSYNIAK,ZMUDZKI J,et al.The development of analytical procedure for the determination of tulathromycin in swine plasma[C]//Egmond aan Zee.Residues of veterinary drugs in food.Proceedings of the EuroResidue VII Conference.The Netherlands:Board of the EuroResidue Conferences Foundation,2012:14-16
[4]NI H J,HUANG X H,FANG B H,et al.Determination of tulathromycin in pork tissues by liquid chromatography-tandem mass spectrometry[J].Journal of Instrumental Analysis,2011(3):19.
[5]BONER P L,GOTTSCHALL D W,KIM-KANG H.Determination and confirmation of tulathromycin residues in bovine liver and porcine kidney via their common hydrolytic fragment using high-performance liquid chromatography/tandem mass spectrometry [J].Journal of AOAC International,2011,94(2):436-445.
[6]LIN Ying,YE Mao,HAN Shuangyan,et al.The progress on the research of immunoassay[J].Joural of Food Sciene and Biotechnoloy,2007,26(4):117-120.(in Chinese)
[7]孝庄,曼霁.蛋白质连接技术[M].北京:中国医药科技出版社,1993.
[8]杨利国,魏平华,郭爱珍,等.酶免疫测定技术[M].南京:南京大学出版社,1998.
[9]ZHANG Lifang,LI Weiling,JIANG Zhaoleng,et al.Identification of hapten-carrier protein conjugate by fluorescence spectrometry[J].Chinese Journal of Veterinary Medicine,2014(7):81-83.(in Chinese)
[10]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[11]LIU F,LOU Y,SHI X,et al.Preparation and characterization of monoclonal antibody specific for copper-chelate complex[J]. Journal of Immunological Methods,2013,387(1):228-236.
[12]WU Ding,LIU Changquan.Determination of ampicillin content in milk by ELISA[J].Chinese Journal of Health Laboratory Technology,2000,10(1):10-20.(in Chinese)
[13]廷彬,学念.实用免疫学[M].长春:长春出版社,1994.
[14]XU Liguang,KUANG Hua,SONG Shanshan,et al.Synthesis and characterization of antigen of furazolidone[J].Joural of Food Sciene and Biotechnoloy,2013(11):1136-1140.(in Chinese)
Synthesis and Identification of Complete Antigen of Tulathromycin
ZHU Xinfeng1,2, ZHANG Yifan3, ZHANG Yinzhi*2, SUN XiuLan1,2, WANG Yifan1, LI Ying1
(1.School of Food Science and Technology,Jiangnan University,WuXi 214122,China;2.State Key Laboratory of Food Science and Techology,Jiangnan Uniersity,WuXi 214122,China;3.Hanzhong Productus Quality Supervision and Inspection Institute,Hanzhong 723000,China)
The complete antigen of Tulathromycin was synthesized in this study.The Tulathromycin haptens were obtained by deriving the mycotoxins with succinic anhydride,introducing the free carboxyl group.The EDC method was applied to conjugate the Tulathromycin haptens to bovine serum albumin (BSA)as an artificial immunogen.The coating antigen Tulathromycin-OVA was achieved in the same way.The synthetic hapten was identified by LC-MS.Tulathromycin-BSA was characterized by fluorescence spectrometry and Bradford method.The antiserum titer was detected by indirect ELISA for BALB/c mice immunized with Tulathromycin-BSA.The conjugated-ratio of BSA was determined as 17∶1.The antiserum titer of the BALB/C mice reached to 1∶8 000 after the third Booster immunization.The complete antigens were successfully synthesized,which laid a foundation for the development of the Tulathromycin ELISA kit.
Tulathromycin,complete antigens,ELISA,identification
O 657
A
1673—1689(2017)01—0062—05
2015-03-02
2010年度公益性行业(农业)科研专项(201003008-08)。
*通信作者:张银志(1975—),男,高级工程师,主要从事食品安全检测研究。E-mail:yinzhizhang@jiangnan.edu.cn
朱欣凤,张亦凡,张银志,等.泰拉霉素完全抗原的合成和鉴定[J].食品与生物技术学报,2017,36(01):62-66.

