应用多重PCR技术快速筛查食品中的转基因成分
董立明, 邢珍娟, 李葱葱, 夏 蔚, 闫 伟, 李飞武
应用多重PCR技术快速筛查食品中的转基因成分
董立明, 邢珍娟, 李葱葱, 夏 蔚, 闫 伟, 李飞武*
(吉林省农业科学院,吉林 长春130033)
以转基因植物中常见的3种筛选调控元件、2种标记基因和1种目的基因为检测靶标,建立了能在一次PCR扩增中同时检测6种转基因成分的多重PCR检测方法。结果表明,当多重PCR体系中CaMV35S启动子、FaMV35S启动子、NOS终止子、bar基因、NPTII基因、CP4-EPSPS基因的检测引物浓度分别为0.2、0.2、0.3、0.3、0.2、0.2 μmol/L,退火温度为60℃时扩增效果最佳,利用优化后的六重PCR方法可从转基因玉米、大豆、棉花、油菜等各类样品中精准检测出相应的转基因成分,方法的检测灵敏度可达到0.1%。该方法为食品中常见转基因成分的筛查提供了一种高效的手段,在转基因产品的检测工作中具有较高的应用价值。
转基因生物;调控元件;标记基因;目的基因;多重PCR;筛查
随着转基因技术在农业领域的推广应用速度不断加快,转基因植物的品种日益丰富,1994~2014年间,全球65个国家和地区共批准了27种转基因作物的357个转化体的商业化应用,仅2014年全球就种植了1.81亿公顷转基因玉米、大豆、棉花、油菜等作物,越来越多的转基因产品进入人们的生活
[1]。转基因技术作为一项新兴技术,在农业、医药、能源、环保、材料等多个领域发挥了非常重要的作用,但其打破物种基因隔离的优势也令公众对其产品的安全性产生了质疑[2],为此世界许多国家和地区相继建立了转基因产品标识制度,农产品中的转基因成分已纳入国内外检疫检验部门的检验项目[3]。
日益增加的转基因产品种类给转基因产品检测技术提出了更高的要求,精准、快速、高通量成为转基因检测技术发展的趋势[4-5]。在经典的检测技术中,PCR因其高特异性和高灵敏度一直是转基因产品检测方法研究的首选,以PCR技术为核心研制更快速、更高效的检测方法是本领域近年来的研究热点,将多对引物加入一个PCR反应体系中实现在单个反应管中一次性检测多种转基因成分的多重PCR方法已有诸多报道,Guo Jin-chao等利用简并引物结合多重PCR建立了8种抗虫和耐除草剂基因的四重PCR方法[6],李飞武等建立了能同时检测转基因作物中的8种常见Bt基因的多重PCR方法[7],魏霜等建立了检测转基因水稻中Cry1Ab基因、Gus基因、CaMV35S启动子、NOS终止子等转基因成分的七重PCR方法[8]。
在未知产品的转基因成分检测中,一般是先选择最具代表性的少数几个转基因筛选元件进行筛查,若确认含有某种转基因成分后,再进行进一步的身份鉴定[9]。因此,作者选择转基因植物中常见的6种转基因成分 (CaMV35S启动子、FMV35S启动子、NOS终止子、bar基因、CP4-EPSPS基因、NPTII基因)为检测靶标,通过多重PCR扩增体系优化、反应程序优化、特异性检测、灵敏度测试等试验,建立了能同时检测上述6种转基因成分的六重PCR方法。
1 材料与方法
1.1 试验材料
转基因玉米Bt11(ERM-BF412f)、Bt176(ERMBF411f)、MON810(ERM-BF413gk)、MON863(ERMBF416d)、转基因大豆GTS40-3-2(ERM-BF410gk)等5种标准物质:购自欧洲标准物质与测量研究所;转基因玉米MON89034(AOCS 0906-E)、转基因大豆MON89788(AOCS 0906-B)、A2704-12(AOCS 0707-B6)、转基因棉花LLCOTTON25(AOCS 0306-E2)、MON531 (AOCS 0804-C)、MON1445(AOCS 0804-B)、MON15985(AOCS 0804-D)、转基因油菜GT73(AOCS 0304-B)等8种标准物质:购自美国油脂化学家协会;非转基因玉米、大豆、棉花、油菜样品:作者所在实验室保存样品。每种样品中含有的转基因检测靶标信息详见表1。
除了表1所列的试验材料,作者还制备了一份含有全部6种检测靶标的阳性对照样品,包含转基因玉米MON863、转基因大豆MON89788和转基因棉花LLCOTTON25等3个转化体,每个转化体的质量分数为5%,以非转基因玉米、大豆、棉花、油菜的等量混合物作为填充物。

表1 试验材料及含有的靶标转基因成分信息Table 1 Description of the genetically modified components in the test materials
1.2 主要试剂和仪器
植物基因组DNA提取试剂盒:购自北京天根生物技术有限公司;多重PCR试剂盒(2×Multiplex PCR Assay Kit)、HS-Taq DNA聚合酶、DNA分子量标准:购自宝生物工程(大连)有限公司;GeneFinder核酸染料、琼脂糖等购自北京鼎国昌盛生物技术有限公司;检测引物委托上海生工生物公司进行合成和纯化。
紫外/可见光分光光度计 (ND1000):美国Thermo Fisher公司产品;梯度PCR仪(C1000)、凝胶成像系统 (GelDOC XR+):美国Bio-Rad公司产品;高速离心机(5424):德国Eppendorf公司产品。
1.3 实验方法
1.3.1 样品基因组DNA提取 按照DNA提取试剂盒的说明书提取全部试验材料的基因组DNA,用紫外/可见光分光光度计检测DNA样品的质量和浓度,用灭菌超纯水将样品DNA稀释至25 ng/uL,4℃备用。
1.3.2 引物设计与筛选 通过查阅国内外数据库、论文、标准等文献,并结合多重PCR检测引物设计与筛选的一般原则,使用Primer Premier 5.0软件设计和分析确定6个检测靶标的特异性PCR引物,引物信息详见表2。所有引物用灭菌超纯水稀释至10 μmol/L备用。

表2 检测引物信息Table 2 Information of the primers in this study
1.3.3 PCR扩增体系及程序 单一PCR检测,总反应体系为25μL,包括:2.5 μL 10×PCR buffer,2 μL dNTPs混合物 (10 mmol/L),0.5 μL正向引物(10 μmol/L),0.5 μL反向引物 (10 μmol/L),0.125 μL HS-Taq DNA聚合酶(5 U/μL),2 μL DNA样品(25 ng/uL),17.375 μL灭菌超纯水。
六重PCR检测,总反应体系为50 μL,包括:25 μL 2×Multiplex PCR Assay Kit(含缓冲液、dNTPs、Mg2+等),14 μL引物预混液 (CaMV35S启动子、FMV35S启动子、NPTII基因、CP4-EPSPS基因的正反向引物各1 μL,NOS终止子、bar基因的正反引物各1.5 μL),4 μL DNA样品,7 μL灭菌超纯水。
单一和六重PCR扩增程序:95℃预变性 5 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,共进行35个循环;72℃延伸5 min。
PCR结束后,取7.5 μL的PCR扩增产物用3%的琼脂糖凝胶进行电泳检测,利用凝胶成像系统照相观察。
2 结果与讨论
2.1 检测引物适用性测试
作者选择的6种检测靶标的单一PCR方法均已建立了相应的国家标准,但由于扩增产物大小集中于180~333 bp,将这些方法的引物直接应用到多重PCR体系中难以区分每一种靶标转基因成分。为此,在系统分析各个检测靶标的序列信息及现有方法基础上,针对FMV35S启动子和NPTII基因重新设计了PCR检测引物,并对新设计的这2对PCR引物的特异性进行了验证。验证样品包括阳性对照样品和转基因玉米 Bt176、MON810、MON863、MON89034、转基因大豆GTS40-3-2、MON89788、A2704-12、 转 基 因 棉 花 MON531、MON1445、MON15985、LLCOTTON25、转基因油菜GT73、非转基因植物混合物等13种植物样品。结果显示,利用设计的FMV35S启动子引物能够从阳性对照样品、MON89034玉米、MON89788大豆、MON1445棉花和GT73油菜样品中扩增出401 bp的特异性片段,利用 NPTII基因引物则能从阳性对照样品、MON863玉米、MON531棉花、MON1445棉花和MON15985棉花样品中获得499 bp的特异性扩增产物,均与预期结果一致(见图1和表1)。由此确定了6个检测靶标的扩增引物,不同扩增产物之间至少相差60 bp,从理论上确保多重PCR产物可通过3%的琼脂糖凝胶电泳进行区分。

图1 FMV35S启动子和NPTII基因检测引物的特异性测试Fig.1 Specificity of the primers for FMV35S promoter and NPTII gene
为进一步验证筛选出的6对检测引物(表2)在单一PCR和多重PCR中的适用性,以非转基因植物混合物的DNA样品为稀释剂,将阳性对照样品DNA溶液稀释至每个转化体组分质量分数均为1%,进行单一PCR和多重PCR测试。结果如图2所示,以6对引物分别进行单一PCR扩增时,均能从阳性对照样品中特异性地扩增出对应的转基因成分,而将6对引物放在同一PCR管中进行六重PCR扩增时,可从阳性对照样品中扩增到6种预期的转基因成分,且在电泳图谱中能够清晰识别出每一种检测靶标的特异性条带,表明这6对引物适用于构建多重PCR检测体系。

图2 引物适用性测试Fig.2 Applicability of the primers forsingletand multiplex PCR assays
2.2 六重PCR的扩增体系和反应程序优化
由于每种转基因成分检测引物的扩增效率和退火温度不尽相同,为保证每对引物在多重PCR体系中均能正常工作,尽可能降低引物间的交互抑制,并确保建立的多重PCR方法满足一定的检测灵敏度,需对每种检测靶标的引物用量和退火温度进行梯度测试[12]。为此,将阳性对照样品DNA用非转基因植物混合物的DNA稀释成每个转化体组分分别为质量分数 1%和 0.1%的测试样品,设置CaMV35S启动子、FMV35S启动子、NOS终止子、bar基因、NPTII基因、CP4-EPSPS基因的引物终浓度比为0.2∶0.2∶0.2∶0.2∶0.2∶0.2、0.2∶0.2∶0.25∶0.25∶0.2∶0.2、0.2∶0.2∶0.3∶0.3∶0.2∶0.2等3种组合,退火温度为58、60、62℃等3个梯度。结果显示,当引物浓度比为0.2∶0.2∶0.3∶0.3∶0.2∶0.2,退火温度为60℃时,6个基因都能得到很好的扩增,且电泳条带清晰可辨,优于其他组合(图3),由此确定了如1.3.3所述的六重PCR的最适反应体系和程序,用于进一步的测试。
2.3 六重PCR方法的特异性测试
用非转基因植物混合物的DNA样品作为稀释剂,分别将13种转基因植物的DNA样品稀释至转化体质量分数均为1%。以稀释后的DNA样品作为模板,用优化后的六重PCR扩增体系和反应程序进行扩增。结果表明,应用六重PCR方法能够从13种测试样品中获得1~5条特异性扩增产物片段(见图4),且与表1所列的预期结果完全一致,未出现假阳性或假阴性情况,表明建立的六重PCR方法对转基因玉米、大豆、棉花、油菜等不同类型的样品均具有很好的特异性,具有广泛的适用性。

图3 多重PCR扩增体系和反应程序优化Fig.3 Optimization of reaction system and program for the multiplex PCR assay
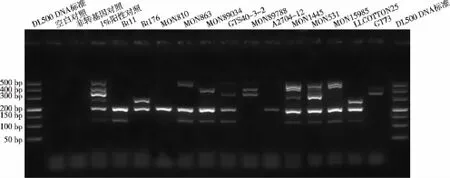
图4 多重PCR方法的特异性测试Fig.4 Specificity of the multiplex PCR assay
2.4 六重PCR方法的灵敏度测试
用缓冲液对阳性对照样品的DNA进行梯度稀释,获得每个转化体组分的质量分数分别为5%、1%、0.5%、0.2%、0.1%、0.05%的6个梯度的DNA样品,用优化后的六重PCR扩增体系和反应程序对上述DNA测试样品进行PCR扩增检测。测试结果如图5所示,应用本研究建立的六重PCR方法能够从质量分数≥0.1%的阳性对照样品中清晰检测到全部6种转基因成分,表明本方法的检出限为0.1%,能够满足现阶段转基因成分筛选检测的需求。

图5 多重PCR方法的灵敏度测试Fig.5 Sensitivity of the multiplex PCR assay
3 结语
应用多重PCR技术,以目前商品化应用的转基因作物中最具代表性的CaMV35S启动子、FMV35S启动子、NOS终止子、bar基因、CP4-EPSPS基因和NPTII基因等6种转基因成分为研究对象,通过特异性引物设计与筛选、反应体系和反应程序优化等步骤,建立了能同时检测上述6种转基因成分的六重PCR方法。特异性和灵敏度测试结果表明,本研究建立的六重PCR方法能够准确检测出转基因玉米、大豆、棉花、油菜等不同类型样品中的预期转基因成分,方法检出限为0.1%,非常适用于转基因成分检测中对未知样品的初步筛选。
[1]CLIVE JAMES.Global status of commercialized biotech/GM crops:2014[R].Ithaca,NY:ISAAA,2014.
[2]MATIN Qaim,SHAHZAD Kouser.Genetically modified crops and food security[J].PLoS One,20138(6):e64879.
[3]LING Xingyuan,ZHANG Guiming,PAN Guang,et al.Event-specific detection of imported GM corn[J].Plant Quarantine,2011,25(5):40-44.
[4]SHAO Ning,JIANG Shimeng,ZHANG Miao,et al.MACRO:A combined microchip-PCR and microarray system for high-throughput monitoring of genetically modified organisms[J].Analytical Chemistry,2014,86(2):1269-1276.
[5]CHEN Zhaobo.Molecular detection of the quality and safety of agricultural produces:advances and trends[J].Journal of Food Science and Biotechnology,2009,28(4):444-450.
[6]GUO Jinchao,CHEN Lili,LIU Xin,et al.A multiplex degenerate PCR analytical approach targeting to eight genes for screening GMOs[J].Food Chemistry,2012,132(3):1566-1573.
[7]LI Feiwu,YAN Wei,LONG Likun,et al.Screening detection of Bt genes in genetically modified crops using a multiplex PCR assay[J].Modern Food Science&Technology,2014,30(5):262-266.
[8]WEI Shuang,CHEN Zhen,LU Chunbin,et al.Multiplex PCR detection of transgenic components of genetically modified rice[J]. Food Science,2012,33(12):159-162.
[9]ZHANG Dabing,GUO Jinchao.The development and standardization of testing approaches for genetically modified organisms and their derived products[J].Chinese Bulletin of Life Sciences,2011,23(2):195-204.
[10]GUO Longhua,YANG Huanghao,QIU Bin,et al.Capillary eletrophoresis with electrochemiluminescent detection for highly sensitive assay of genetically modified organisms[J].Analytical Chemistry,2009,81(23):9578-9584.
[11]XU Wentao,ZHAI Zhifang,HUANG Kunlun,et al.A novel universal primer-multiplex-PCR method with sequencing gel electrophoresis analysis[J].PLoS One,2012,7(1):e22900.q
科技信息
A Multiplex PCR Assay for the Rapid Screening of Genetically Modified Components in Food
DONG Liming, XING Zhenjuan, LI Congcong, XIA Wei, YAN Wei, LI Feiwu*
(Jilin Academy of Agricultural Sciences,Changchun 130033,China)
Based on the DNA sequences of CaMV35S promoter,FaMV35S promoter,NOS terminator,bar gene,NPTII gene and CP4-EPSPS gene,a multiplex PCR assay for simultaneously screening the above six exogenous elements widely introduced into genetically modified organisms was established.The result showed that the highly efficient multiplex PCR system was obtained when the final primer concentrations were 0.2,0.2,0.3,0.3,0.2 and 0.2 μmol/L separately for them. The method could allow an accurate detection of six target elements from genetically modified maize,soybean,cotton and rapeseed,with the limit of detection of 0.1%.In conclusion,this multiplex PCR assay provides a highly effective approach to the screening of common transgenic components in foods and has high application value in the GMO detection.
genetically modified organisms,regulatory element,marker gene,target gene,multiplex PCR,screening
TS 207.3
A
1673—1689(2017)01—0056—06
2015-03-17
国家转基因生物新品种培育重大专项课题(2014ZX08012-001);吉林省农业科技创新工程项目(2013-2016)。
董立明(1980—),男,吉林九台人,农学硕士,助理研究员,主要从事农业转基因生物安全研究。E-mail:dlm_510@sina.com
*通信作者:李飞武(1982—),男,湖北江陵人,农学硕士,副研究员,主要从事农业转基因生物安全研究。E-mail:lifeiwu3394@sina.com
董立明,邢珍娟,李葱葱,等.应用多重PCR技术快速筛查食品中的转基因成分[J].食品与生物技术学报,2017,36(01):56-61.

