牛场肥水灌溉冬小麦对不同土层中氨氧化细菌群落多样性的影响
崔丹瑶,孙 溪,高文萱
(1.农业部环境保护科研监测所,天津 300191;2.天津农学院 食品科学与生物工程学院,天津 300384;3. 天津市农副产品深加工技术工程中心,天津 300384)
施肥是对作物管理最具有影响力的方式之一[1],土壤中不同群类微生物,如氨氧化细菌(Ammonia-oxidizing bacteria,AOB ),均受到不同施肥制度的影响[2]。氨氧化细菌作为土壤硝化作用的主要驱动者[3,4],通过控制氨单加氧酶(amoA)的活性来影响硝化作用的亚硝化过程[5],该过程是硝化作用的限速步骤[6]。硝化作用是土壤氮素循环的主要方式,也是氮素流失的潜在途径之一[7],所以研究施肥对氨氧化细菌的影响是土壤微生物生态学的重要组成部分,氨氧化细菌也被称为土壤生态学的模式生物[8]。研究不同施肥条件下,土壤中氨氧化细菌群落结构多样性对于检测土地质量及作物的生产水平是极为重要的。
由于土壤中99%的微生物无法在实验室中培养[9],所以学者们越来越热衷于通过分子生物学的方法来研究土壤中微生物的群落多样性。1997年Rotthauwe等[10]用PCR法扩增amoA基因,对氨氧化细菌的群落结构进行了研究。2012年,王亚男等[11]通过对amoA基因TRFLP-PCR与qPCR技术相结合的方法,研究了不同处理下AOB的群落组成和丰度的变化,得出了施肥类型和土壤层次均是影响AOB群落丰度和结构组成的重要因素的结论。2015年,周志成等[12]通过建立amoA克隆文库,研究在红壤蔬菜田上施加无机肥与有机肥等AOB和AOA的多样性,结论为有机肥比无机肥提高了AOB与AOA的多样性。
牛场肥水中含有大量的氮素资源[13],而这些氮素资源常常得不到再循环利用,而是被排放到地下水中,造成水资源污染。而近些年,中国农业用水已占全国总用水量的60%[14],那么将牛场肥水作为灌溉水,循环利用于作物土壤中,既不造成污染,又解决了用水问题,这是人们一直所期待的[15]。目前研究施肥制度对土壤中微生物群落多样性的影响主要是针对施肥种类(包括无机肥,有机肥,无机肥与有机肥配施等)[16-18],而针对作物不同生长期,进行次数控制的施肥对于让微生物的影响则研究较少。而且,大部分对于AOB群落多样性的研究多为表层土(0~5 cm或0~20 cm)[19-20],研究20~40 cm土层的则比较少。本文研究了牛场肥水灌溉对于0~20 cm土层与20~40 cm土层的AOB群落多样性,为肥水灌溉的科学管理提供理论指导。
1 材料与方法
1.1 试验区概况
本试验中采集土壤样品的地点位于河北省徐水县梁家营施肥田(38°09-39°09N,115°19-115°46E),该地处于太行山东麓,河北省中部,属大陆性季风气候。
1.2 试验材料处理
试验共设置8个处理,每个处理设置3组平行,分别为各生长期均用清水灌溉的CK组;播种后、拔节期为无机肥处理的CF组;其余6组编为T1~T6,为不同时期,不同浓度的牛场肥水灌溉处理,各个处理施肥量详情见表1。
试验小区长9 m宽6 m,中间有1 m保护行。作物的种植方式为冬小麦与夏玉米交替种植,试验中的小麦品种为济麦22,玉米品种为农大221,牛场肥水的沼液原液成分见表2。

表1 各处理中的施肥量Tab.1 Fertilizer amount in different treatment
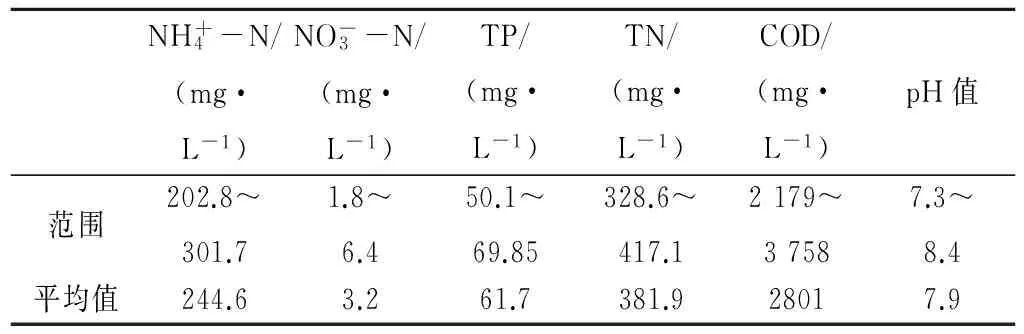
表2 肥水沼液原液成分Tab.2 The composition of cattle biogas slurry
1.3 样品采集
样品采集的时间为小麦收割后的6月中旬,采用“五点法”进行样品采集,每个小区随机采集0~20 cm与20~40 cm两个土层的土样,去除杂草、秸秆、碎石等,将同一土层的5个土样混合,装入密闭塑封袋中,暂时在冰盒中保存,后存放于-20 ℃冰箱中。
1.4 土壤总DNA提取
采用FastDNA® SPIN Kit For Soil试剂盒提取土壤中DNA基因组,具体实验步骤参照说明书进行。使用Nano Drop核酸蛋白仪对DNA的浓度进行测定,根据测定结果对DNA进行稀释,存放于-20 ℃冰箱,供后续试验使用。
1.5 PCR扩增及酶切分析
PCR扩增的引物与反应条件如表3所示。PCR产物经纯化回收后,使用MSP I(TAKARA)进行酶切反应[21],体系参考说明书。将酶切产物送往生物公司进行检测。
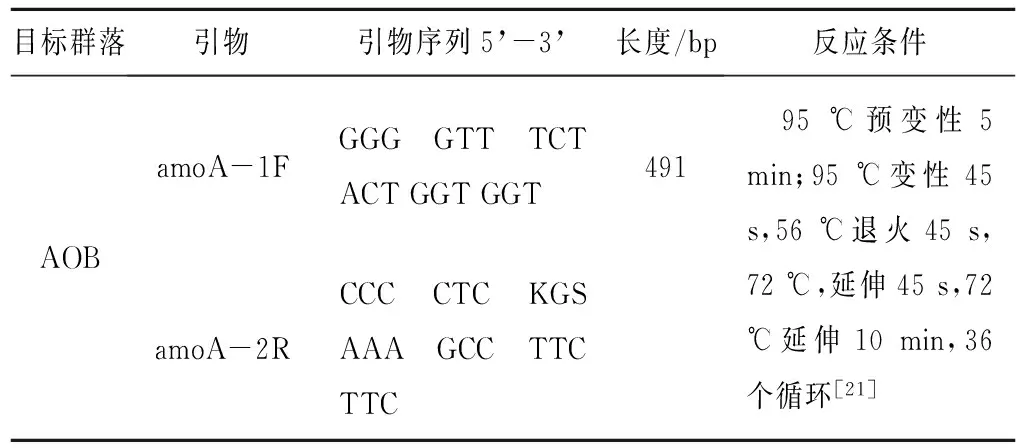
表3 PCR反应条件Tab.3 PCR reaction condition
注:①上下游引物分别标注为F和R; ②S=Cor G; W=Aor T; ③用6-FAM对上游引物进行荧光标记。
1.6 克隆及测序分析
将1.5中的纯化产物与T载体连接,并将其转化到大肠杆菌感受态细胞(DH5α)中,进行蓝白斑筛选,将筛选得到的100个经菌落PCR验证的阳性克隆子送往生物公司测序。
1.7 数据处理
结合T-RFLP数据,计算0~20 cm与20~40 cm两个土层中氨氧化细菌的多样性指数,并用CANOCO for Windows 4.5 软件进行主成分(PCA)分析。用MEGA 6.0构建两个土层的amoA基因系统发育树,统计学分析采用SPSS 17.0进行数据分析。
2 结果与分析
2.1 施肥对0~20 cm土层氨氧化细菌的影响
2.1.1 不同施肥处理下氨氧化细菌群落结构的变化
将MSP I酶切amoA基因的T-RFLP结果进行总结,如图1可见,共有16种片段,但56 bp、66 bp、156 bp、235 bp、256 bp在所有片段中所占百分比比例较高,占主导地位,为优势菌群。
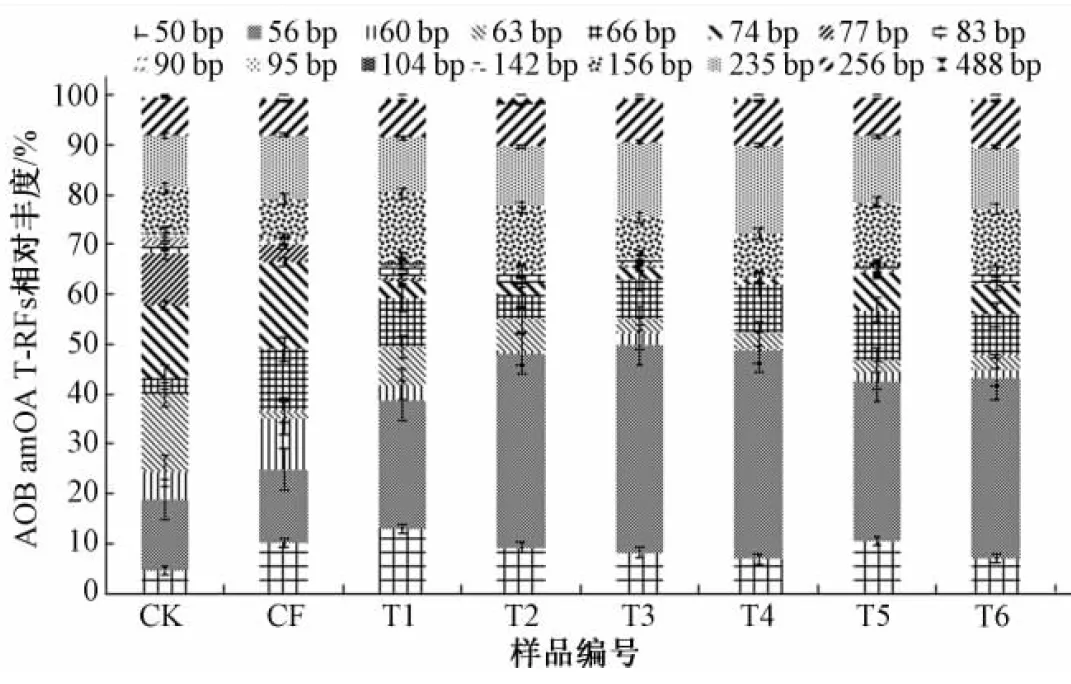
图1 0~20cm土层不同处理氨氧化细菌(AOB)T-RFs 相对丰度百分比
Fig.1 0~20 cm layer relative abundance of AOB amoA T-RFs in different fertilization treatments
对0~20 cm土层的T-RFs进行主成分分析(PCA),结果如图2所示,主成分1(PC1)解释了77.2%的物种变量,主成分2(PC2)解释了13.2%的物种变量。除T1之外的牛场肥水灌溉处理(T2、T3、T4、T5、T6)均在PC1的负轴,而清水处理(CK)和无机肥处理(CF)均在PC1的正轴,且明显分开。除T1处理之外,牛场肥水灌溉降低了主要成分所占的比例,无机肥处理提高了主要成分比例,不同牛场肥水处理之间对群落结构的影响并不明显。
对0~20 cm土层氨氧化细菌的主成分2(PC2)进行分析,与无机肥处理(CF)相比,清水灌溉处理(CK)对次要成分的影响最大;T1、T6、T3、T4这四个处理在PC2上相差不大,说明CF处理增加了氨氧化细菌的次要种类,而不同牛场肥水灌溉对其无明显影响。
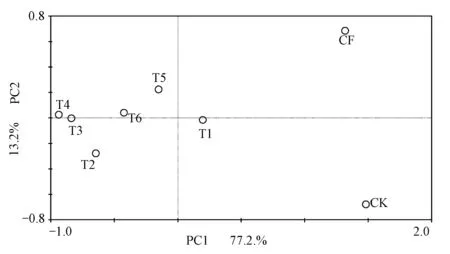
图2 0~20 cm土层氨氧化细菌主成分(PCA)分析Fig.2 0~20 cm layer AOB principal component analysis(PCA)
2.1.2 不同施肥处理对氨氧化细菌群落多样性的影响
根据表4所示,Shannon-Weiner(H)、Simpson(D)、Pielou(E)指数中,T1处理均为最大值,说明T1处理在一定程度上增加了0~20 cm土层中氨氧化细菌的多样性和丰富度,且效果显著;T4处理均为最小值,说明T4处理在一定程度上降低了0~20 cm土层中氨氧化细菌的多样性,T5与CK相比,能增加土壤中AOB的种群多样性但效果不明显。
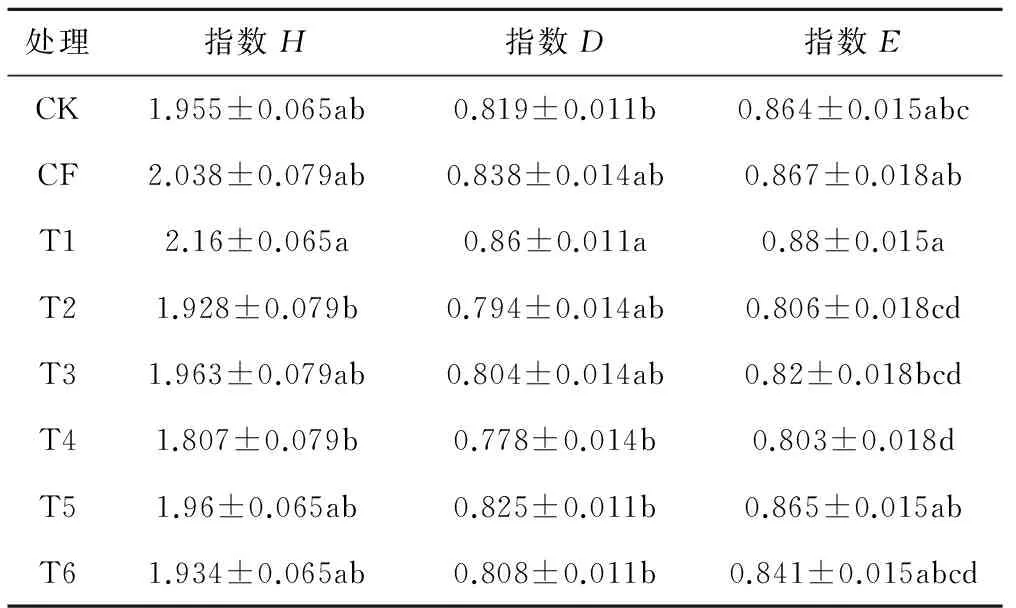
表4 0~20 cm土层各处理的多样性指数统计表Tab.4 0~20 cm layer diversity index in different treatment
注:不同英文字母表示P<0.05 水平差异显著性。
2.1.3 氨氧化细菌系统发育树的构建
对于0~20 cm土层的氨氧化细菌克隆文库,共挑取了107个经PCR验证后的阳性克隆子。经BLAST比对后,按酶切片段进行分型,得到18个典型的操作分类单元(OTU),构建系统发育树。
参考先前文献中被广泛认可的命名方式,对氨氧化细菌的系统发育树进行命名[22]。从图3可知,多数序列属于β-变形菌门,主要包括亚硝化螺菌属(Nitrosospira) cluster 3a、3b、cluster 2及亚硝化单胞菌属(Nitrosomonas) cluster 6。结合表5可以看出属于Nitrosospira cluster3a的片段包括156和256bp,属于Nitrosospira cluster 3b的片段包括60 bp,235 bp,Nitrosospira cluster 2的片段包括50 bp与60 bp,Nitrosomonas cluster 6的片段包括56 bp与235 bp。根据表5显示,60 bp与235 bp所占的比例较多。Nitrosospira属的氨氧化细菌所占比例约为95%,为主要菌群。Nitrosomonas类群所占比例约为5%。
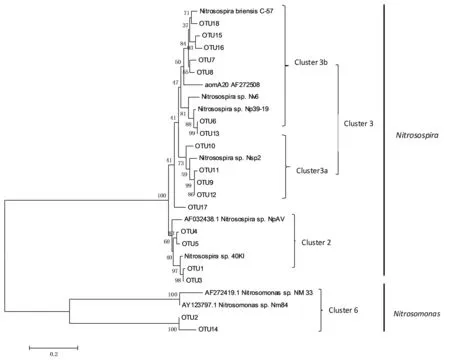
图3 0~20 cm土层amoA序列的氨氧化细菌系统发育树Fig.3 Tree of ammonia oxidizing bacteria based on analysis of 0~20 cm amoA sequences
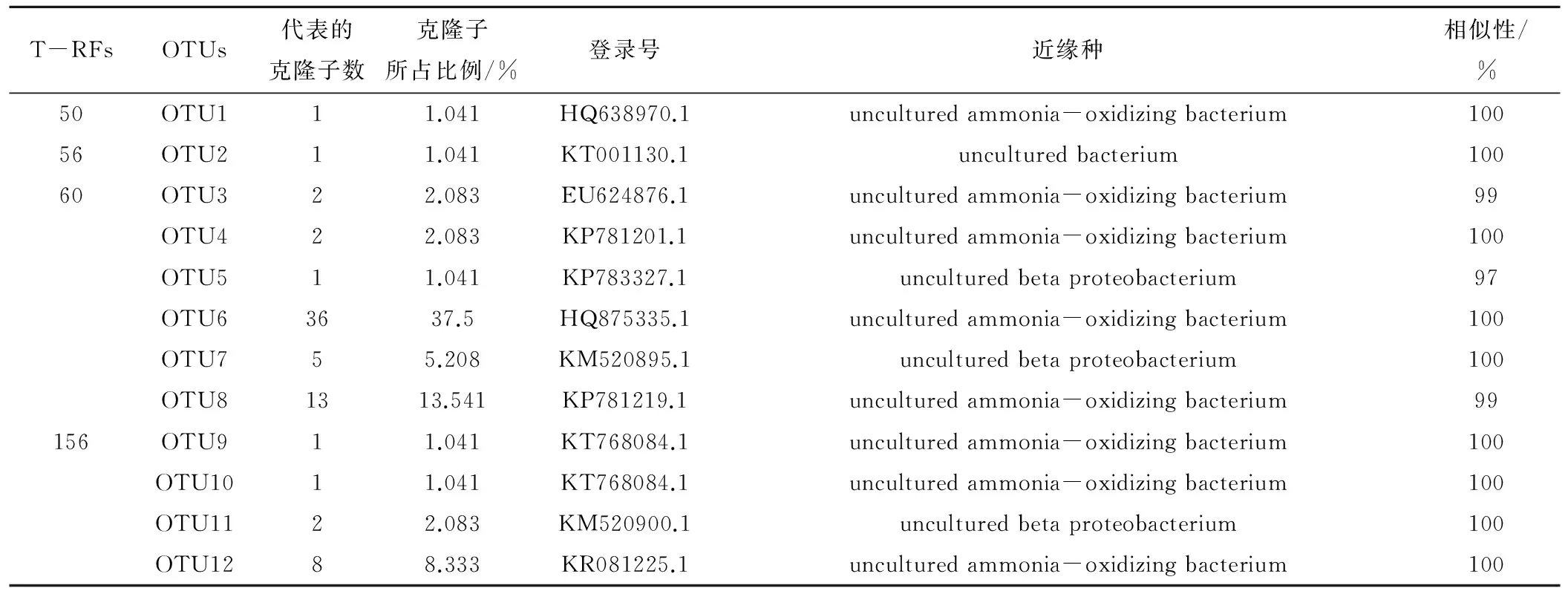
T-RFsOTUs代表的克隆子数克隆子所占比例/%登录号近缘种相似性/%50OTU111.041HQ638970.1unculturedammonia-oxidizingbacterium10056OTU211.041KT001130.1unculturedbacterium10060OTU322.083EU624876.1unculturedammonia-oxidizingbacterium99OTU422.083KP781201.1unculturedammonia-oxidizingbacterium100OTU511.041KP783327.1unculturedbetaproteobacterium97OTU63637.5HQ875335.1unculturedammonia-oxidizingbacterium100OTU755.208KM520895.1unculturedbetaproteobacterium100OTU81313.541KP781219.1unculturedammonia-oxidizingbacterium99156OTU911.041KT768084.1unculturedammonia-oxidizingbacterium100OTU1011.041KT768084.1unculturedammonia-oxidizingbacterium100OTU1122.083KM520900.1unculturedbetaproteobacterium100OTU1288.333KR081225.1unculturedammonia-oxidizingbacterium100
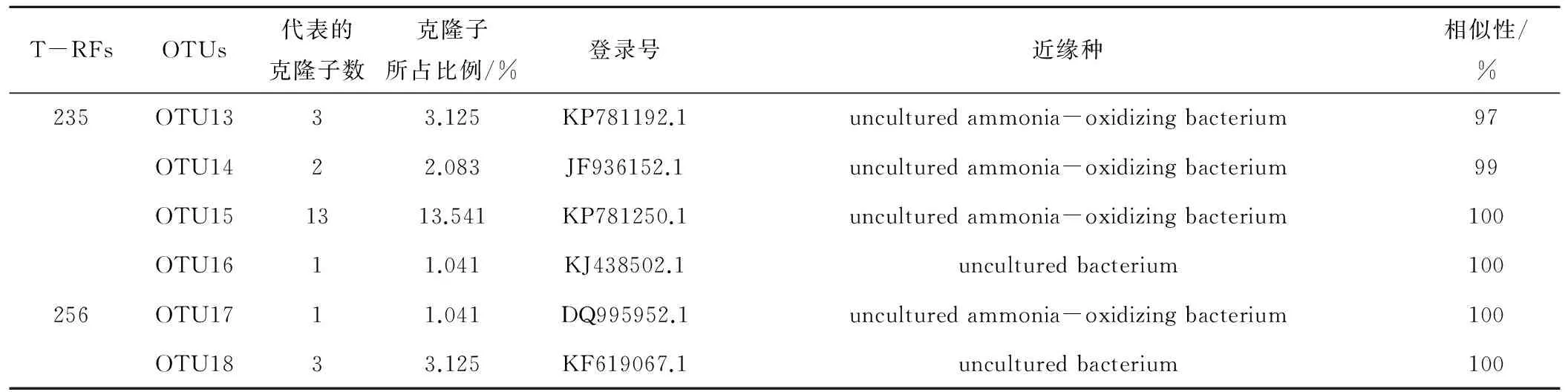
续表5 0~20cm土层氨氧化细菌的T-RFLP 与 OTUs 序列的模拟酶切比对结果
2.2 施肥对20~40 cm 氨氧化细菌的影响
2.2.1 不同施肥处理下氨氧化细菌群落结构的变化
同样使用限制性内切酶MSP I进行酶切,将T-RFLP结果总结,如图4所示,共有14种片段。其中有4个主要片段:56、66、156、235 bp,为20~40 cm土层中AOB的优势菌群。不同施肥处理间,氨氧化细菌优势菌群的差异不明显,与0~20 cm土层中的情况相同,56 bp代表的氨氧化细菌是最具有优势的种群。
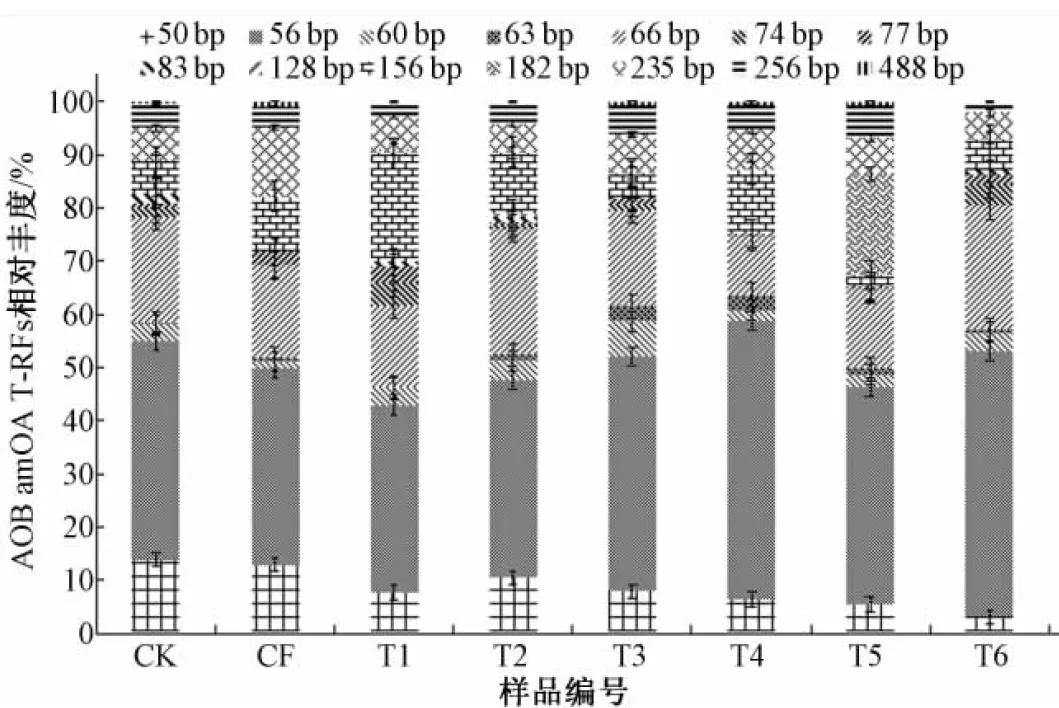
图4 20~40 cm土层不同处理氨氧化细菌(AOB)T-RFs 相对丰度百分比
Fig.4 20~40 cm relative abundance of AOB ’ s T-RFs in different treatments
对20~40 cm土层的T-RFLP结果中的T-RFs进行主成分分析(PCA),如图5。主成分1(PC1)解释了38.8%的物种变量,主成分2(PC2)解释了28.5%的物种变量。T3、T4、T5、T6均在PC1的正轴,CK、CF、T1、T2均在PC1的负轴,说明不同浓度的牛场肥水处理对氨氧化细菌的主要种类的影响是不同的。T5处理在PC2正轴的最远处,说明高浓度的牛场肥水灌溉会对20~40 cm的次要成分造成明显影响。CK、CF、T1、T2这4种处理均在PC2的正轴,但距离很近,说明清水处理,无机肥处理,牛场肥水处理都会对氨氧化细菌的次要种类有所增加,但相互之间的差别不明显。
2.2.2 不同施肥处理对氨氧化细菌群落多样性的影响
根据T-RFLP数据分析结果,计算出3个关于生物多样性的指数,如表6。Shannon -Weiner (H)、Simpson (D)、Pielou(E)指数T1处理均为最大,T4、T6均小于CK组,说明T1组的处理明显增加了20~40 cm土层中AOB的群落多样性和丰富度,T4和T6在一定程度上降低了AOB的群落多样性和丰富度,这与0~20 cm土层的情况相一致。
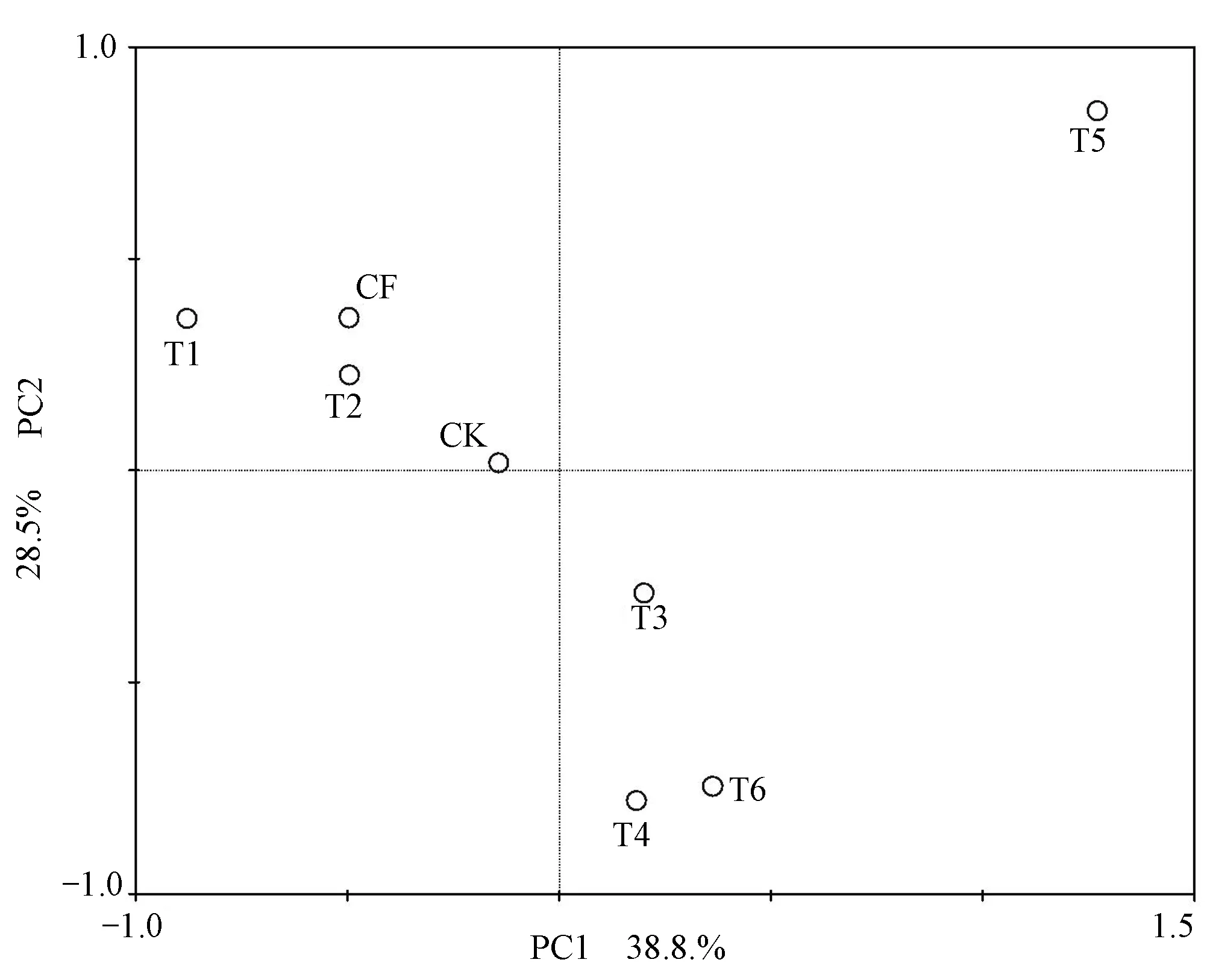
图5 20~40 cm土层氨氧化细菌主成分(PCA)分析Fig.5 20~40 cm layer AOB principal component analysis(PCA)
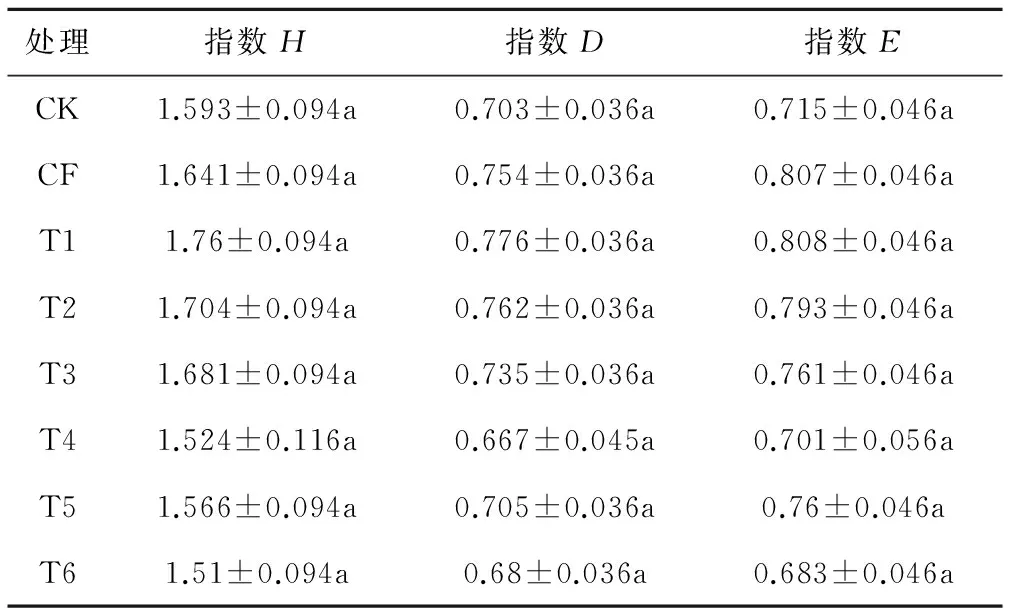
处理指数H指数D指数ECK1.593±0.094a0.703±0.036a0.715±0.046aCF1.641±0.094a0.754±0.036a0.807±0.046aT11.76±0.094a0.776±0.036a0.808±0.046aT21.704±0.094a0.762±0.036a0.793±0.046aT31.681±0.094a0.735±0.036a0.761±0.046aT41.524±0.116a0.667±0.045a0.701±0.056aT51.566±0.094a0.705±0.036a0.76±0.046aT61.51±0.094a0.68±0.036a0.683±0.046a
注:不同英文字母表示P<0.05 水平差异显著性。
为探究0~20 cm土层与20~40 cm土层之间是否具有显著性差异,选取T1、T4、CK、CF这四个处理,对它们的Shannon-wiener (H) 指数、Simpson (D) 指数Pielou (E) 指数进行横向比较。根据表7、表8显示,T1处理与CF处理对于两个不同土层中AOB的群落多样性和均匀度具有显著的影响。说明在T1与CF处理时,不同的土壤深度,其AOB群落多样性和均匀度也是不同的。
2.2.3 氨氧化细菌系统发育树的构建
从系统发育树图6可知,多数序列属于β-变形菌门,这与0~20 cm土层情况相同。但在20~40 cm土层,氨氧化细菌主要包括Nitrosospira cluster 3a、3b、4,共3个属。结合表9进行分析,Nitrosospira cluster 3a中只有156 bp;属于Nitrosospira cluster 3b的片段有56 bp,66 bp,156 bp,235 bp和256 bp;Ni-trosospira cluster 4的片段为60 bp。与0~20 cm土层情况不同的是,20~40 cm土层中,不存在Nitrosospira cluster 2与Nitrosomonas cluster 6这两个属,这说明0~20 cm与20~40 cm土层中的微生物群落是不相同的。
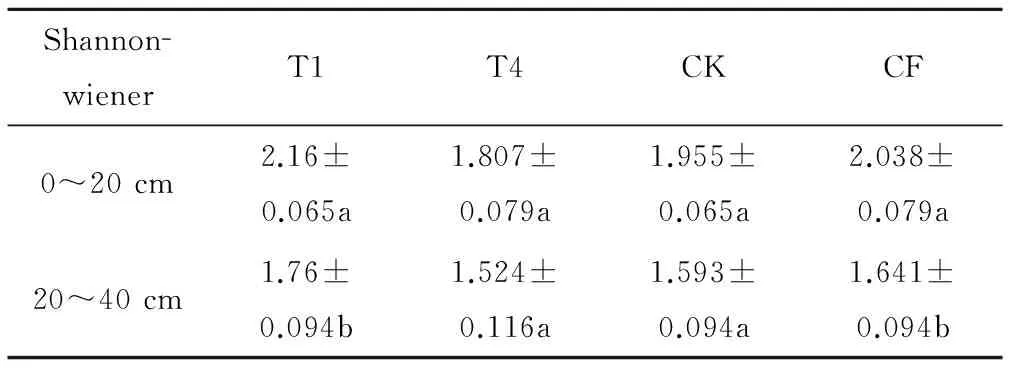
表7 T1、T4、CK、CF Shannon-wiener 指数横向比较Tab.7 T1、T4、CK、CFtransverse comparisonofShannon-wienerindex
注:不同英文字母表示P<0.05 水平差异显著性。
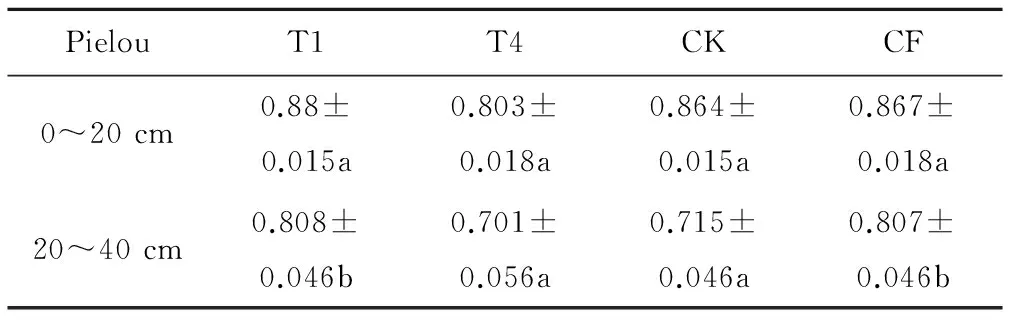
表8 T1、T4、CK、CF Pielou 指数横向比较Tab.8 T1、T4、CK、CF transverse comparison of Pielou index
注:不同英文字母表示P<0.05 水平差异显著性。
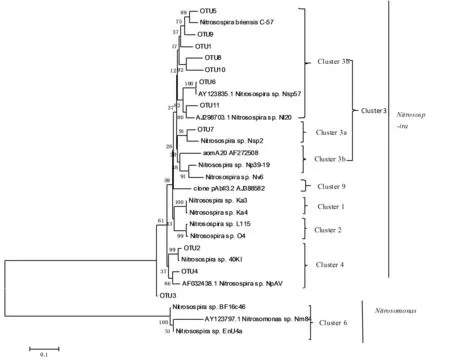
图6 20~40 cm土层amoA序列的氨氧化细菌系统发育树Fig.6 Tree of ammonia oxidizing bacteria based on analysis of 20~40 cm amoA sequences
3 讨论与结论
本文采用T-RFLP技术,研究了不同施肥制度下,牛场肥水灌溉对0~20 cm土层与20~40 cm土层中AOB的群落结构变化。根据表4显示:CF的Shannon-wiener(H) 指数大于CK,这说明无机肥处理(CF)比清水灌溉(CK)更能促进土壤中氨氧化细菌的多样性;T1的H指数大于CF,说明中等浓度的肥水灌溉(T1)处理比无机肥灌溉(CF)能够更好地促进土壤中氨氧化细菌的群落多样性;CK、T5、T6这3种处理的H指数差别较小,说明相同时期,相同灌溉次数,高浓度的牛场肥水(T5)或低浓度的牛场肥水(T6)对AOB的多样性影响与清水灌溉(CK)效果相似。王亚男等[11]发现1/2MNPK(有机肥与无机肥混合)处理的amoA基因拷贝数要大于MNPK,MNPK处理并没有因为高浓度的氮素而增加土壤中AOB的多样性,这与本文的发现相一致。
20~40 cm土层中AOB多样性指数如表6,T1、T2、T3、T4的多样性指数(H)之间的关系与表层土不同,为T1>T2>T3>T4,这说明在相同的牛场肥水浓度下,施肥次数与AOB群落多样性之间呈反比例关系,T1处理(105 kg N/hm2,39 kg P2O5/hm2,清水∶沼液=2∶1,1次灌溉)促进了AOB的群落多样性,T4处理(420 kg N/hm2,156 kg P2O5/hm2,清水∶沼液=2∶1,4次灌溉)抑制了AOB的群落多样性。这是因为在0~20 cm土层中,土壤中的可用资源较多,群落之间的竞争关系弱,为微生物提供了良好的生存环境,多样性指数较高。但随着土层的加深,资源的有限性和环境的同质性使得生态条件不能够充分满足土壤微生物的生长需求[23],于是不同群落之间的竞争关系变强,出现了明显且稳定的优势群落。施肥次数的增加会使氮素等成分增加,优势种群生长旺盛,进而抑制了其他的种群,使AOB的群落多样性和丰富度降低。这与前人研究发现的不同类型氨氧化细菌对土壤基质与铵离子的敏感度不同,不同的氮素浓度会改变氨氧化细菌的主要种类的结论一致[24-25]。 在施肥方式一定的情况下,0~20 cm土层的多样性指数(Shannon-wiener指数,Simpson指数,Pielou指数)均比20~40 cm的多样性指数高。这与前人分析的结果相一致。Griffiths等[26]利用16S rDNA PCR扩增和DGGE的方法检测了测了0~5,5~10,10~15,15~20 cm,4个土层中细菌群落及多样性。发现0~5 cm多样性高,养分被利用得充分,越深的土层多样性越低。
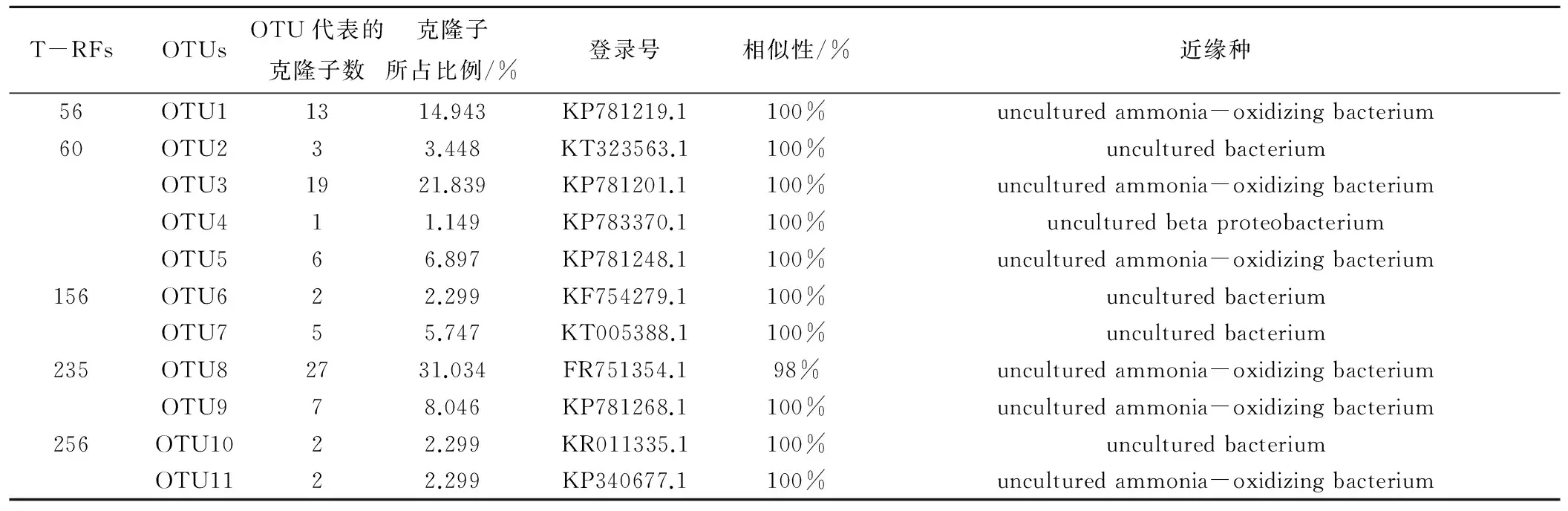
表9 20~40 cm土层氨氧化细菌的T-RFLP与OTUs序列的模拟酶切比对结果Tab.9 20~40 cm layer ammonia-oxidizing bacteria comparison between T-RFLP patterns and OTUs sequences
根据图1和图4显示,56 bp代表的氨氧化细菌在0~20 cm土层中,各处理的丰度与CK组相比,差异很大;而20~40 cm土层中各组处理的丰度变化则较小。说明56 bp代表的氨氧化细菌能够更好地适应深层土的环境,充分利用施肥后土壤中的养分,与其他种群竞争,从而成为优势种群。施肥次数越多,此类氨氧化细菌生长越旺盛,群落总体的多样性降低,均匀度也降低。
235 bp代表的氨氧化细菌,在0~20 cm土层中,所占丰度变化浮动较小;在20~40 cm土层中,235bp所占百分比依旧稳定,各处理之间变化浮动较小。而且发现两个土层中清水灌溉(CK),无机肥(CF),中等含氮量的肥水(T1),高含氮量的肥水(T5)之间的丰度差别不大,说明235 bp片段代表的在群落中所占比例相对稳定,推测235 bp代表的氨氧化细菌对铵浓度不敏感。结合0~20 cm系统发育树,235 bp代表的氨氧化细菌属于亚硝化螺菌属(Nitrosospira )cluster 3b和亚硝化单胞菌属(Nitrosomonas)cluster 6,而根据前人的研究显示,王亚男等[27]证实,Nitrosospira cluster 3 在不同浓度的氮肥处理中均处于优势种群,推测Nitrosospira cluster 3 属对铵离子浓度不敏感,与本文研究相符。
根据图3与图6的系统发育树显示,两个土层中的AOB均包括Nitrosospira cluster 3a,Nitrosospira cluster 3b这两个属,并称为Nitrosospira cluster 3属,这说明在长期施肥的条件下,不同土层中,优势种属没有发生改变,且Nitrosospira属占的比例分别为95%与100%,这与前人研究得出的土壤中氨氧化细菌以亚硝化螺菌属(Nitrosospira)为主,而非亚硝化单胞菌属(Nitrosomonas)的结论相一致[28-31].但在20~40 cm土层中,没有Nitrosospira cluster 2与Nitrosomonas cluster 6这两个属,说明不同的土层在不同程度上改变了氨氧化细菌的群落结构。
[1] Li J,Zhao B Q, Li X Y, et al. Effects of long-term combined application of organic and mineral fertilizer on microbial biomass, soil enzyme activities and soil fertility. Agriculture Sciences in China, 2008,7(3):336-343.
[2] 毕明丽,宇万太,江子绍,等.施肥和土壤管理对土壤微生物生物量碳氮和群落结构的影响[J].生态学报,2010,30(1):0 032-0 042.
[3] 武传东,辛 亮,李秀颖,等.长期施肥对黄土旱塬黑垆土AOA群落多样性和丰度的影响[J].中国农业科学,2011,44(20):4 230-4 239.
[4] 武志杰,史云峰,陈利军.硝化抑制作用机理研究进展[J].土壤通报,2008,39(4):962-970.
[5] 张 伟.硝化细菌的富集培养及氨单加氧酶基因片段的PCR扩增[D].浙江:浙江大学,2002.
[6] 汪 峰,曲浩丽,丁玉芳,等.三种农田土壤中氨氧化细菌amoA 基因多样性比较分析[J].土壤学报,2012,49(2):347-353.
[7] 鲍俊丹,石 美,张妹婷等.中国典型土壤硝化作用与土壤性质的关系[J].中国农业科学,2011,44(7):1 390-1 398.
[8] Horz H P, Barbrook A, Field C B, et al. Ammonia-oxidizing bacteria respond to multifactorial global change[J]. PNAS, 2004,101(42):15 136-15 141.
[9] 邱 权,陈雯莉.三峡库区小江流域消落区土壤微生物多样性[J].华中农业大学学报,2013,32(3):15-20.
[10] Rotthauwe J H, Witze K P, Liesack W. The ammonia monooxygenases-tructural gene amoA as a functional marker:Molecular fine scaleanalysis of natural ammonia-oxidizing populations[J].Applied and Environ-mental Microbiology, 1997, 63(2):4 704-4 712.
[11] 王亚男,曾希柏,俄胜哲等. 施肥对设施菜地氨氧化细菌群落和丰度的影响[J],.农业环境科学学报, 2012,31(12):2 425-2 432.
[12] 周志成,罗葵,唐前君等.不同施肥方式对红壤蔬菜田氨氧化细菌和氨氧化古菌群落的影响[J].中国蔬菜,2015,(7):33-39.
[13] 杜会英,冯洁,郭海刚等.麦季牛场肥水灌溉对冬小麦-夏玉米轮作土壤氮素平衡的影响[J].农业工程学报,2015,31(3):159-165.
[14] 中华人民共和国国家统计局.中国统计年鉴2013[M].北京:中国统计出版社,2013.
[15] 袁耀武,张 伟,李英军,等.污水灌溉对土壤中不同微生物类群数量的影响[J].节水灌溉,2003,(6):15-17.
[16] 裴雪霞,周 卫.长期施肥对黄棕壤性水稻土氨氧化细菌多样性的影响[J].植物营养与肥料学报,2011,17(3): 724- 730.
[17] 王亚男,曾希柏,王玉忠,等.设施蔬菜种植年限对氮素循环微生物群落结构和丰度的影响[J].应用生态学报,2014,25(4):1 115 -1 124.
[18] 刘振香,刘 鹏,贾绪存,等.不同水肥处理对夏玉米田土壤微生物特性的影响[J].应用生态学报, 2015,26(1):113-121.
[19] 辜运富,云 翔,张小平,等.不同施肥处理对石灰性紫色土微生物数量及氨氧化细菌群落结构的影响[J].中国农业科学, 2008,41(12):4 119-4 126.
[20] 袁 飞.不同农田土壤中的硝化作用及硝化细菌种群[D]. 南京:南京农业大学,2004.
[21] 王 婷,刘丽丽,张克强,等.牛场肥水灌溉对土壤氨氧化微生物的影响[J].农业环境科学学报,2015,34(9):1 737-1 746.
[22] HAO Yong-Jun,WU Song-Wei,WUWei-Xiang,et al.Research progress on them icrobial ecology of aerobic ammonia-oxidizing bacteria.Acta Ecologica Sinica,2007,27(4):1 573- 1 582.
[23] 夏北成.植被对土壤微生物群落结构的影响[J].应用生态学报, 1998,9(3):296-300.
[24] Webster G, Embley T M, Freitag T E, et al. Links between ammonia oxidizer species composition, functional diversity and nitrification kinetics in grassland soils[J]. Environmental Microbiology, 2005,(7):676-684.
[25] Suwa Y, Imamura Y, Suzuki T, et al. Ammonia-oxidizing bacteria with different sensitivities to( NH4)2SO4in activated sludges[J]. Water Resources, 1994,28:1 523-1 532.
[26] Griffiths R I, Whiteley A S, O Donnell A G, et al. Influence of depth and sampling time on bacterial community structure in an upland grassland soil[J]. FEMS Microbio Eco, 2003,43:35-43.
[27] 王亚男,曾希柏,俄胜哲,等.施肥对设施菜地氨氧化细菌群落和丰度的影响[J].农业环境科学学报.2012,31(12):2 425-2 432.
[28] Yuan F,Ran W,Hu J,et al.Ammonia-oxidizing bacteria communities and their influence on the nitrification potential of chinese soils measured by denaturing gradient gel electrophoresis ( DGGE)[J].Acta Ecologica Sinica,2005,25(6):1 318-1 324(in Chinese).
[29] Kowalchuk GA,Stephen JR.Ammonia-oxidizing bacteria: A model for molecular microbiaEcology[J].Annual Review of Microbiology.2001,55:485-529.
[30] Fierer N,Carney KM,Horner Devine MC,et al.The biogeography of ammonia-oxidizing bacterial communities in soil[J].Soil Microbiology,2009,58:435-445.
[31] Yin J,Xu WF.Ammonia biofiltration and community analysis of ammonia-oxidizing bacteria in Biofilters[J].Bioresource Technology,2009,100:3 869-3 876.

