β—环糊精聚合物与丁醚脲包合作用的研究
束影+钱琛+王杰琼

摘要:通过红外光谱、X-射线粉末衍射对β-环糊精聚合物(β-CDP)与丁醚脲(DFT)形成的包合物进行表征。用紫外光谱法求得β-环糊精聚合物与丁醚脲在水溶液的包合常数为3.42×104 (mol/L)-2。以乙二醇为溶剂,二者的包含常数下降为3.22×104 (mol/L)-2。此外,β-环糊精与丁醚脲在乙二醇溶液中的包合常数为1.21×103 (mol/L)-2,表明β-环糊精聚合物的包合能力明显高于单体β-环糊精(β-CD)。β-环糊精聚合物可以有效地改善丁醚脲的溶解性。
关键词:β-环糊精聚合物;丁醚脲;包含常数;增溶作用
中图分类号: S482.3;TQ450.1+1 文献标志码: A
文章编号:1002-1302(2016)11-0169-04
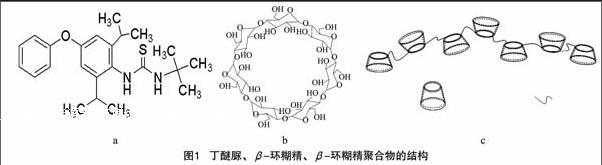
丁醚脲(diafenthiuron)属硫脲类高效低毒杀虫、杀螨剂(结构如图1-a所示)[1-3],主要用于高抗性鳞翅目害虫如小菜蛾、菜粉蝶、棉铃虫、斜纹夜蛾等以及螨类的防治,对有机磷、氨基甲酸酯及菊酯类的抗性害虫有特效[4-6],但因在水中的溶解度很小(0.06 mg/L,25 ℃),实际应用受到很大程度的限制。
β-环糊精(β-cyclodextrin)是一类环状低聚葡萄糖化合物,由7个葡萄糖单元通过α-1,4糖苷键连接而成,结构如图1-b所示,对客体分子具有包结、催化、缓释等功能[7-10]。[LL]
但是受本身溶解度限制,β-环糊精对客体分子的包合效果并不理想。β-环糊精聚合物(β-cyclodextrin polymer),结构如图1-c所示[11],因其呈立体网络结构,具有较好的机械强度、良好的稳定性以及化学可调性等优点[12-14]。本研究在合成β-环糊精聚合物的基础上,研究丁醚脲与β-环糊精聚合物在水中和乙二醇中的包合作用,比较β-环糊精和β-环糊精聚合物对丁醚脲的包合能力,为丁醚脲新剂型的研制提供一定的理论依据。
1 材料与方法
1.1 试验材料
主要仪器:TENSOR27型傅立叶变换红外光谱仪(德国 Bruker 公司,仪器分辨率为4 cm);D8 ADVANCE 多晶X-射线衍射仪(德国Bruker公司,电压40 kV,电流40 mA,射线源为Cu Kα,λ=0.154 056 nm);UV-2550型紫外-可见光谱仪(日本Shimazu公司)。
主要试剂:β-环糊精、丁醚脲(97%,国药集团化学有限公司)、环氧氯丙烷,均为分析纯;试验用水均为二次蒸馏水。
1.2 试验方法
1.2.1 水溶性β-环糊精聚合物的制备 称取19.7 g的氢氧化钠于100 mL的三口烧瓶中,加40 mL二次水使之完全溶解后,加入25 g β-环糊精,于30 ℃水浴恒温下搅拌1 d,使β-环糊精完全溶解,得到澄清溶液。在相同的条件下加入环氧氯丙烷12 mL,继续反应1 d,反应结束得到透明澄清溶液,将此溶液进行透析(1~2 h换水1次,透析2 d),透析后的溶液旋转蒸发,剩余溶液倒入盛有无水乙醇的小烧杯中,析出固体后过滤,真空烘箱内50 ℃下干燥,得到白色粉末状产品。
1.2.2 丁醚脲-β-环糊精包合物的制备 首先称取 5 mmoL 的 β-环糊精聚合物和 50 mmoL丁醚脲溶解于二甲基甲酰胺(DMF)中,磁力搅拌24 h,然后加入乙醇,产生沉淀,抽滤,多次用乙醇洗涤滤渣,最后在60 ℃真空干燥,得到黄色粉末状包合物。
1.2.3 β-环糊精聚合物对丁醚脲的增溶试验 准确称取0.02 g丁醚脲于50 mL锥形瓶中,加入25 mL二次蒸馏水,形成丁醚脲的过饱和溶液,分别加入不同质量的β-环糊精聚合物。将锥形瓶放在恒温振荡箱中25 ℃下反应48 h。待反应完全后,离心并取上清液,测定其紫外吸收光谱。绘制丁醚脲的标准曲线,计算丁醚脲的溶解度。
2 结果与分析
2.1 丁醚脲-β-环糊精包合物的表征
图2-a、图2-b、图2-c分别是β-环糊精聚合物、丁醚脲、丁醚脲-β-环糊精包合物的红外光谱。在图2-b中,3 364 cm-1 处是仲胺基的伸缩振动吸收峰,2 962 cm-1处是甲基的伸缩振动吸收峰,1 582 cm-1处是苯环的骨架振动吸收峰,3 164 cm-1 处是苯环骨架振动倍频峰,1 214 cm-1处是CS的伸缩振动。在图2-c中,3 383 cm-1的特征峰是羟基的伸缩振动吸收峰,因受到丁醚脲中仲胺基吸收峰的影响而向低波数移动,且其吸收峰比β-环糊精聚合物中羟基的吸收峰宽;2 925 cm-1 处是亚甲基的不对称伸缩振动吸收峰,因丁醚脲的存在使丁醚脲-β-环糊精包合物中亚甲基处的吸收峰增强,而丁醚脲的特征峰已基本消失,只是在 1 214 cm-1 处存在微弱的CS伸缩振动。综上所述可以证明,已成功制备了丁醚脲-β-环糊精包合物。
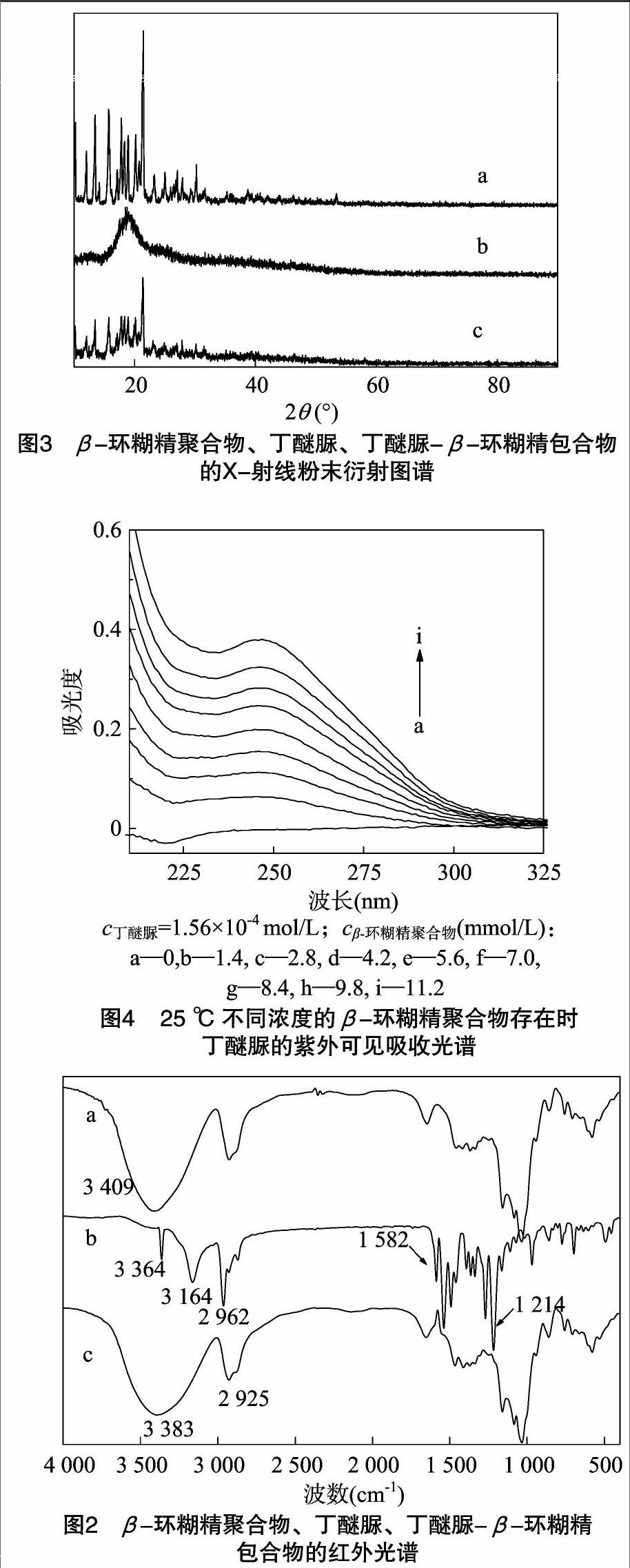
图3-a、图3-b、图3-c分别是丁醚脲、β-环糊精聚合物、丁醚脲-β-环糊精包合物的X-射线粉末衍射图谱。图3-a中的尖锐衍射峰是丁醚脲的晶体衍射峰;图3-b中的衍射峰较弱,因为β-环糊精聚合物以无定形形式存在;图 3-c 中的衍射峰发生变化,表明晶型发生了变化,据此可以判定丁醚脲-β-环糊精包合物为一种新的物相。
2.2 包合常数的测定
包合常数可以通过紫外可见分光光度法进行测定[15-17]。图4为25 ℃时,1.56×10-4 mol/L丁醚脲水溶液中加入不同浓度的β-环糊精聚合物的紫外吸收光谱。由图4可见,丁醚脲的最大紫外吸收波长为244 nm;丁醚脲水溶液中加入β-环糊精聚合物后,丁醚脲溶液的吸光度规律性地递增,说明β-環糊精聚合物对丁醚脲有超分子包合作用。这主要是因为当丁醚脲分子进入β-环糊精聚合物的疏水性空腔后,β-环糊精聚合物空腔内的高电子云密度对丁醚脲的核外电子有微扰作用,导致丁醚脲水溶液的吸光度规律性增大。
采用乙二醇做溶劑,进一步研究了β-环糊精聚合物与丁醚脲分子之间发生的包合作用。图6为25 ℃时,2.0×10-5 mol/L丁醚脲乙二醇溶液中加入不同浓度的β-环糊精聚合物的紫外可见吸收光谱。由图6可见,丁醚脲乙二醇溶液中加入β-环糊精聚合物后,丁醚脲溶液的吸光度规律性地递增,由此证实了两者可以发生超分子包合作用。
图7是依据图6的数据,以[H]02[G]0/ΔA对[H]02 作图得到的一条直线,线性方程为Y=0.603 23+0.019 41X,r=0.99。由此证明β-环糊精聚合物中单体β-环糊精与丁醚脲物质的量之比为2 ∶1的包合物,并可求得包合常数Kf=3.22×104 (mol/L)-2。
为了比较β-环糊精与β-环糊精聚合物对丁醚脲包合能力的差异,进一步研究了在乙二醇溶液中β-环糊精与丁醚脲的包合作用。在2.0×10-5 mol/L丁醚脲的乙二醇溶液中加入不同浓度的β-环糊精,测定各溶液的紫外可见光谱(图8),从图8可见,丁醚脲溶液中加入不同质量的β-环糊精时,吸光度仅略有增大,远远低于加入β-环糊精聚合物的增大幅度。图9是以[H]02[G]0/ΔA 对[H]02作图得到的直线,线性方程为Y=9.301+0.112 3X,r=0.98。据此亦证明β-环糊精与丁醚脲分子形成摩尔比为2 ∶1的包合物,且可求得包合常数Kf=1.21×103 (mol/L)-2。
比较上述3个包合常数,在水溶液中β-环糊精聚合物与丁醚脲的包合常数最大,数值为3.42×104 (mol/L)-2;当溶剂为乙二醇时,溶液黏度增加导致β-环糊精聚合物的包合能力略有下降,数值为3.22×104 (mol/L)-2;当主体化合物为β-环糊精时,包合常数减小为1.21×103 (mol/L)-2,表明β-环糊精聚合物的包合能力远大于β-环糊精,这主要是由于β-环糊精含有羟基,羟基会形成分子内氢键,整个分子的刚性较强,与丁醚脲形成的包合物稳定性较差。而改性后的β-环糊精聚合物,改变了原有β-环糊精的刚性结构,大大提高了自身的包合能力,可广泛应用于有机分子的识别与包合反应。
2.3 β-环糊精聚合物对丁醚脲的增溶效果
在丁醚脲的过饱和溶液中,分别加入0、0.05、0.10、0.20、0.25、0.30、0.35、0.40、0.45 g的β-环糊精聚合物。在一定条件下反应完全后,离心取上清液,并在25 ℃时测定紫外吸收光谱(图10)。因为丁醚脲在水中的溶解度相当低(0.06 mg/L,25 ℃),不加β-环糊精聚合物时丁醚脲的最大紫外吸收非常弱;而向其过饱和溶液(800 mg/L)中加入不同质量的β-环糊精聚合物后,丁醚脲的最大紫外吸收随着β-环糊精聚合物增多而逐渐增大,丁醚脲水溶液的最大吸光度可以增大到0.564(曲线h),说明β-环糊精聚合物对丁醚脲具有一定的增溶能力,丁醚脲在水中的溶解度可提高约96倍;但是当β-环糊精聚合物质量增加到一定程度后,丁醚脲在水中的吸光度不再增加,此时β-环糊精聚合物对丁醚脲的增溶能力已经达到饱和状态(曲线h),过多的β-环糊精聚合物反而对丁醚脲的紫外吸收起阻碍作用,造成最大吸光度降低(曲线i)。
3 结论
本研究成功制备了β-环糊精聚合物与丁醚脲的包合物丁醚脲-β-环糊精聚合物,并对其进行了红外和X-射线粉末衍射表征。通过紫外可见分光光度法求得β-环糊精聚合物与丁醚脲在水溶液中的包合常数为3.42×104 (mol/L)-2,在乙二醇中的包合常数为3.22×104 (mol/L)-2,而β-环糊精与丁醚脲在乙二醇中的包合常数为1.21×103 (mol/L)-2。β-环糊精聚合物对丁醚脲的包合作用优于β-环糊精。由于超分子包合物的形成,β-环糊精聚合物可有效增加丁醚脲在水中的溶解度,使丁醚脲在水中的溶解度增加约96倍。
参考文献:
[1]Ishaaya I,Mendelson Z R,Horowitz A. Toxicity and growth-suppression exerted by diafenthiuron in the sweetpotato whitefly,Bemisia tabaci[J]. Phytoparasitica,1993,21(3):199-204.
[2]Ruder F J,Kayser H. The carbodiimide product of diafenthiuron inhibits mitochondria in vivo[J]. Pesticide Biochemistry and Physiology,1993,46(2):96-106.
[3]Schareina T,Zap A,Cotté A L,et al. A practical and improved copper-catalyzed cynthesis of the central intermediate of diafenthiuron and related products[J]. Organic Process Research and Development,2008,12(3):537-539.
[4]Brito N M,Navickiene S,Polese L,et al. Determination of pesticide residues in coconut water by liquid-liquid extraction and gas chromatography with electron-capture plus thermionic specific detection and solid-phase extraction and high-performance liquid chromatography with ultraviolet detection[J]. Journal of Chromatography A,2002,957(2):201-209.
[5]Du P,Li K X,Chen L,et al. Dynamic study on the residue and degradation of the diafen-thiuron microemulsion in cabbage and soil[J]. Journal of Safety and Environment,2009,9(3):1-4.
[6]Keum Y S,Liu K H,Seo J S,et al. Dissipation of foliar residues of diafenthiuron and its metabolites[J]. Bulletin of Environmental Contamination and Toxicology,2002,68(6):845-851.
[7]張 瑜,刁国旺,郭 荣. β-环糊精-四氯苯醌包合物的合成及其表征[J]. 扬州大学学报:自然科学版,2002,5(3):32-35.
[8]Chen M,Diao G W,Zhang E R. Study of inclusion complex of β-cyclodextrin and nitrobenzene[J]. Chemosphere,2006,63(3):522-529.
[9]车 音,顾 颖,朱霞石. β-环糊精交联包结吸附树脂富集镉[J]. 扬州大学学报:自然科学版,2009,12(3):26-29.
[10]Jug M,Kosalec I,Maestrelli F,et al. Analysis of triclosan inclusion complexes with β-cyclodextrin and its water-soluble polymeric derivative[J]. Journal of Pharmaceutical and Biomedical Analysis,2011,54(5):1030-1039.
[11]Chen M,Wang J Q,Zhang W,et al. Preparation and characterization water-soluble inclusion complexes of imidacloprid-β-cyclodextrin polymer and their electrochemical behavior[J]. Journal of Electroanalytical Chemistry,2013,696:1-8.
[12]Jazkewitsch O,Mondrzyk A,Staffel R,et al. Cyclodextrin-modified polyesters from lactones and from bacteria:an approach to new drug carrier systems[J]. Macromolecules,2011,44(6):1365-1371.
[13]Liu Y Y,Fan X D,Hu H,et al. Release of chlorambucil from poly(N-isopropylacrylamide) hydrogels with β-cyclodextrin moieties[J]. Macromolecular Bioscience,2004,4(8):729-736.
[14]Ortiz M,Torréns M,Alakulppi N,et al. Amperometric supramolecular genosensor self-assembled on cyclodextrin-modified surfaces[J]. Electrochemistry Communications,2011,13(6):578-581.
[15]Berbicz F,Nogueira A C,Neto A M,et al. Use of photoacoustic spectroscopy in the characterization of inclusion complexes of benzophenone-3-hydroxypropyl-β-cyclodextrin and ex vivo evaluation of the percutaneous penetration of sunscreen[J]. European Journal of Pharmaceutics and Biopharmaceutics,2011,79(2):449-457.
[16]Chen M,Shang T,Liu J,et al. Complexation thermodynamics between butyl rhodamine B and calix[n]arenesulfonate(n=4,6,8)[J]. The Journal of Chemical Thermodynamic,2011,43(1):88-93.
[17]Chen M,Diao G W. Intermolecular complexation between p-sulfonated calix[4,6,8]arene sodium and neutral red[J]. Journal of Solution Chemistry,2011,40(3):481-491.

