大樱桃溃疡病病原菌的分离纯化和鉴定
张鹏鹏+李园园+刘露

摘要:为研究大樱桃溃疡病的发病机制,明确其病原菌种类及其生物学特性,从山东省青岛市黄岛区张家楼镇采集了几株发病的大樱桃树枝条,从其腐烂交接口取样筛选出1株导致大樱桃树溃疡病的病原菌YT-2。根据柯赫氏法则验证了YT-2的致病性,通过观察形态学特征,并提取ITS序列进行分析,将YT-2的ITS序列在NCBI(National Center for Biotechnology Information)数据库中进行BLAST比对,并利用MEGA 5.0软件构建系统发育树,对YT-2菌株进行鉴定。结果发现,病原菌YT-2的形态特征与葡萄座腔菌相符,ITS序列与已发布的葡萄座腔菌的ITS序列相似度达到100%,系统发育树分析结果也与之相同。说明引起山东省青岛市大樱桃溃疡病的病原为葡萄座腔菌,尤其是对长势旺盛的布鲁克斯大樱桃品种危害最为严重。
关键词:葡萄座腔菌;布鲁克斯大樱桃;rDNA-ITS;有性型;溃疡病
中图分类号: S436.629 文献标志码: A
文章编号:1002-1302(2016)11-0145-03
樱桃是原产于欧洲的古老树种[1],大樱桃因具有较高的营养价值,口味鲜美而成为人们最喜爱的水果之一。随着大樱桃产量的增加,现在的供求关系已由原来供不应求变为供大于求,因此消费者对樱桃的内在品质要求也越来越高。布鲁克斯大樱桃因具有早熟、大果脆甜的特点,日益引起消费者的关注和青睐,成为目前销量最好的樱桃新品种之一[2],因此研究布鲁克斯大樱桃的病虫害对今后樱桃种植业的发展具有重大意义。然而在山东省青岛市黄岛区张家楼镇的大樱桃园里,布鲁克斯大樱桃植株出现根腐、枝干干腐、流胶、叶片发黄等一系列溃疡病病症,并且发病集中于1~2年的幼苗。发病迅速,树干干枯,营养物质得不到运输,造成整株死亡,大樱桃植株成片死亡,给樱桃园造成严重的经济损失。因为溃疡病的病原菌种类较多、症状表现多样、危害巨大、发生期蔓延面广且迅速,并且采用市面上的杀虫剂、杀菌剂均无明显的改善作用,较难控制等,使其成为林业种植和病害防治的重难点[3]。因此,找出病害的根源并鉴定出该病原菌,为大樱桃的综合防治提供理论基础尤为重要。
目前已有的报道表明,树木溃疡类病害危害的生态、经济林木主要有杨树、苹果、梨树、石榴、松树等[4]。我国的树木溃疡病主要是由真菌引发的,目前研究表明,引起树木溃疡病的病原真菌类群主要有葡萄座腔菌属(Botryosphaeria Cas.)、疡壳孢属(Dothichiza Lib.)、壳囊孢属(Cytospora Ehrenb.)、盾壳霉属(Coniothyrium Sacc.)等4属真菌,这些真菌也成为阻碍我国现阶段林业发展的有害生物。其中,分布范围最广泛的葡萄座腔菌属(Botryosphaeria sp.)因对树木的影响最大、危害最严重,而成为导致树木溃疡病最主要的病原真菌,也成为目前在我国受到最广泛关注的重大生物灾害之一。但迄今为止,葡萄座腔菌属在大樱桃树上发病的情况并不多见,目前还未见相关报道。
1 材料与方法
1.1 标样采集与分离
2014年6—7月于山东省青岛市黄岛区张家楼镇大樱桃园溃疡病发病区域采集标样,采集时沿病斑周围将整个发病枝条取下,完整保存整个病斑,记录发病症状、采集时间、地点、树龄、胸径、危害程度,于4 ℃冰箱保存。
在无菌超净工作台内将采集的病斑枝条切成5 mm×5 mm 的小块,用75%乙醇消毒2 min,0.1%的氯化汞消毒 5 min,然后在无菌水中清洗几次,以防止氯化汞残留。将消毒处理好的病斑块放入含有抗生素的马铃薯葡萄糖琼脂培养基的培养皿中,每皿2块,28 ℃下培养,待菌落直径长至2 cm时,挑取菌落边缘未被污染的少许菌丝转接于新的马铃薯葡萄糖琼脂培养基的培养皿中进行纯化,将纯化后菌株转入试管,置于4 ℃冰箱中保存,以便下一步研究。
1.2 菌株的致病性测定
根据柯赫氏法则,以健康品种为易感病的品种布鲁克斯大樱桃枝条作为接种对象,检测分离病原菌的致病性。取直径约2 cm的2年生枝条,截成25 cm段,用75%乙醇进行表面消毒、晾干,用灼烧灭菌处理后的直径6 mm的打孔器刺入枝条,形成1个烫伤伤口,将同样大小的病原菌菌饼放入伤口处,然后用保鲜膜密封,对照组则用无菌PDA饼处理。将枝条上端用保鲜膜密封后插入盛有水的烧杯,放入培养箱中 28 ℃ 下培养,每天进行观察,记录是否发病以及发病特征。
1.3 病原菌菌落與菌丝特征
1.3.1 菌落特征观察
将分离纯化后的菌株接种于马铃薯葡萄糖琼脂培养基和改良马丁培养基上,28 ℃黑暗条件下培养,观察并记录菌落生长快慢、菌落形状、质地、气生菌丝特征、正背面颜色、有无色素沉积、有无特殊气味等。
1.3.2 菌丝形态观察
采用斜面插片法,使菌丝生长至斜插在马铃薯葡萄糖琼脂培养基的盖玻片上,取出盖玻片在显微镜下观察菌丝形态。
1.3.3 孢子观察
将培养基上产生的子实体置于载玻片上,先用解剖刀切开子实体,加上1滴蒸馏水,再用解剖针将其拨开,使孢子散落在载玻片上,简单染色后,在显微镜下观察孢子形态。
2 结果与分析
2.1 病原物的分离培养
病斑组织在马铃薯葡萄糖琼脂平板上培养3 d,在边缘切口处长出菌丝,经马铃薯葡萄糖琼脂培养基多次纯化后得到3个纯培养物YT-1、YT-2、YT-3。
2.2 致病性测定
利用上述3株菌株进行致病性测定(回接试验),结果发现只有菌株YT-2能引起枝条溃疡病的症状。枝条感染后出现暗褐色至黑褐色不规则形病斑,在28 ℃条件下培养5 d后,病斑部位再分离,所获分离菌株与菌株YT-2完全一致,符合柯赫氏法则。
2.3 病原物的培养性状及产孢结构观察
病原菌在马铃薯葡萄糖琼脂培养基上长势最好,而在改良马丁培养基上生长相对迟缓。气生菌丝十分发达,会呈现“峰”状耸起,菌丝最高可以触到培养皿盖;生长初期菌落呈白色,后期呈灰色。在野外病株中可以观察到该病原菌的有性或无性繁殖结构(图1)。经近紫外线照射培养后,病原菌可在改良马丁培养基上产生繁殖体。培养30 d后,菌落表面局部有直径约1~2 mm的颗粒状角质化凸起物(分生孢子器)生成,分生孢子纺锤形,单细胞,无色,大小15~20 μm×3~5 μm(图2-F)。根据上述病原菌的培养性状和形态学特征,初步鉴定该病原菌为葡萄座腔菌(Botryosphaeria dothidea)。为了进一步确认,利用ITS基因分析方法对病原菌进行分子鉴定。
2.4 病原菌的分子鉴定及系统发育树分析
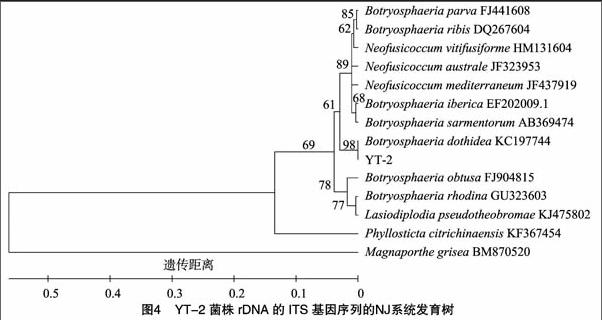
PCR产物琼脂糖电泳结果显示,ITS基因片段的大小在540 bp左右(图3)。序列经BLAST比对后发现,基因序列与GenBank数据库中多个葡萄座腔菌菌株的相似性均达到100%。系统发育分析(图4)也表明病原菌株YT-2与已报道葡萄座腔菌种在一个分支内(自展支持率达98%),与葡萄座腔菌属其他种类遗传关系相对较远,结合形态学鉴定结果,确定YT-2菌株为葡萄座腔菌(B. dothidea)。
3 结论与讨论
葡萄座腔菌(B. dothidea)是一种分布十分广泛的真菌,在世界范围内均有报道,它不仅可以侵染植物,成为植物的病原菌,也可以寄生在植物组织内成为内生真菌,甚至存活在某些坏死的植物组织上作为腐生菌[1]。作为病原菌,该菌的寄生性比较弱,目前已经有研究报道它能侵染的主要林业树木有苹果、葡萄、松树、杨树、黑莓、桃树、橄榄、芒果等[5-10],由于不同林木的生理生化性质不同,因此该菌的致病性、林木的抗病性和在二者共生过程中,不同种类的林木产生的防御反应差异也比较大,这很容易造成相同症状的不同寄主拥有不同的反应机制;而同种林木因为个体间的生长差异以及不同环境地域的差异,对同一真菌的反应也不尽相同[11]。因此,葡萄座腔菌引起的病症也因树种和树体自身差异而表现不同,主要的病症表现为叶斑、枝干溃疡、枝条枯萎、果实腐烂等。目前研究表明病害多发生在长势衰弱的植株上,尤其当植物受到干旱、霜冻或其他病虫害侵染时发病率更会极大地提高[12-14],但是,在本研究中,长势健壮的大樱桃植株会迅速感染该病原菌,并且造成植株死亡的严重后果,尤其以布鲁克斯大樱桃表现最为明显,这也是首次发现葡萄座腔菌可以感染大樱桃,因此,在大樱桃上首次发现葡萄座腔菌,为研究大樱桃的栽培管理技术奠定了基础。虽然布鲁克斯大樱桃适应环境的能力强,但却是对葡萄座腔菌抗性最弱的品种,在嫁接时应注意消毒杀菌,施用腐熟好的农家肥,并注意做好防寒措施。
葡萄座腔菌科(Botryosphaeriaceae)真菌的无性型在自然界和实验室人工条件下培养比较常见,但是有性型在这2种条件下都较少见,尤其是在实验室条件下,很少能观察到它的有性型形态。因此,目前对于该属真菌主要基于无性型的形态特征进行分类学鉴定的[15]。但是,葡萄座腔菌种间的形态十分相似,不易产生有性繁殖结构,葡萄座腔菌的寄主广泛、容易交叉污染等特点使无性态区别十分模糊,并且这些特征也使该类群有性型和无性型种的建立比较混乱,所以单纯依靠传统的鉴定方法有一定的局限性。目前该属真菌种类的分类学和亲缘关系仍不是很清楚,需要进一步深入研究。随着分子技术的发展,基因组DNA中的保守序列(LSU、ITS等)已越来越多地应用到该类病原菌的鉴定中。本试验通过形态学观察并对rDNA-ITS序列进行分析,对引起大樱桃溃疡病的病原菌进行鉴定,最终确认其为葡萄座腔菌(B. dothidea),为山东省青岛地区大樱桃溃疡病的防治奠定了理论基础。
在进行病原菌鉴定的过程中,本研究主要通过紫外线照射的方法进行人工诱导产孢,最终观察到该菌株的孢子结构特征,但耗时1个月,时间过长,由于种间的形态比较相似,鉴定需要有丰富的经验,难度相对较大。而利用 rDNA-ITS序列分析方法对病原菌进行鉴定,操作不仅简单,而且快速。但是,因为ITS序列在遗传变异性上属于中等保守区,难以充分显示葡萄座腔菌种间复杂的相关性和多样性。所以,在进行病原鉴定时结合形态学方法作为验证仍是十分必要的。而且,由于葡萄座腔菌属真菌侵染寄主的广泛性,以及不同菌株对于不同寄主致病性的显著差异,找到能够快速区别不同致病力菌株的分子标记或相关方法也是亟待开展的工作。
参考文献:
[1]董 薇,宋雅坤,吳明勤,等. 大樱桃病毒病研究进展[J]. 中国农学通报,2005,21(5):332-336.
[2]王家喜,王少敏,王江勇. 甜樱桃品种布鲁克斯引种试验[J]. 中国果树,2008(2):30-32.
[3]刘秋霞. 林木溃疡病的综合防治[J]. 国土绿化,2008(6):55.
[4]吴小芹,何月秋,刘中华. 葡萄座腔菌属所致树木溃疡病发生与研究进展[J]. 南京林业大学学报:自然科学版,2001,25(1):61-66.
[5]Smith H,Wingfield M J,Crous P W,et al. Sphaeropsis sapinea and Botryosphaeria dothidea endophytic in Pinus spp. and Eucalyptus spp. in South Africa[J]. South Africa Journal of Botany,1996,62(2):86-88.
[6]Maas J L,Uecker F A. Botryosphaeria dothidea cane canker of thornless blackberry[J]. Plant Disease,1984,68(8):720-726.
[7]Xie L,Huang S L,Cen Z L,et al. First report of Botryosphaeria dothidea causing sweet osmanthus leaf dieback in China [J]. Agriculture Science in China,2010,9(6):847-853.
[8]Wunderlich N,Costa S S,Tpoi R P,et al. First report of Botryosphaeria dothidea causing shoot blight and cankers of pistachio in Australia[J]. Australasian Plant Disease Notes,2012,7(1):47-49.
[9]Zhang Z X,Deng D F,Qi W J,et al. Botryosphaeria dothidea,the causal agent of a new stem canker disease of Tatarian dogwood(Cornus alba)in China[J]. Australasian Plant Pathology,2013,42(2):113-119.
[10]Tang W,Ding Z,Zhou Z Q,et al. Phylogenetic and pathogenic analyses show that the causal agent of apple ring rot in China is Botryosphaeria dothidea[J]. Plant Disease,2012,96(4):486-489.
[11]Latinovi[KG-*5]c[DD(-1*2/3][HT6]'[DD)] J,Mazzaglia A,Latinovi[KG-*5]c[DD(-1*2/3][HT6]'[DD)] N,et al. Resistance of olive cultivars to Botryosphaeria dothidea,causal agent of oliver fruit rot in Montenegro[J]. Crop Protection,2013,48:35-40.
[12]薛云飛,穆希凤,袁秀英,等. 葡萄座腔菌属真菌毒素研究进展[J]. 中国森林病虫,2010,29(2):31-34.
[13]Slippers B,Wingfield M J. Botryosphaeriaceae as endophtes and latent pathogens of woody plants:diversity,ecology and impact[J]. Fungal Biology Reviews,2007,21(2):90-106.
[14]Alves A,Phillips A J L,Henriques I,et al. Evaluation of amplified ribosomal DNA restriction analysis as a method for the identification of Botryosphaeria species[J]. FEMS Microbiology Letters,2005,245(2):221-229.
[15]Denman S,Crous P W,Taylop J E,et al. An overview of the taxonomic history of Botryosphaeria and a re-evaluation of its anamorphs based on morphology and ITS rDNA phylogeny[J]. Studies in Mycology,2000,45:129-140.

