大米α—球蛋白的原核表达、抗体制备及检测
郎刚华+顾立众+李西腾

摘要:大米α-球蛋白是大米胚乳中主要的盐溶蛋白,也是大米的主要致敏原之一。为了建立起大米α-球蛋白的检测分析方法,将大米α-球蛋白的编码基因亚克隆到表达载体pQE30中,并在大肠杆菌中进行了重组大米α-球蛋白的表达。通过金属亲和层析法对重组大米α-球蛋白进行纯化,以纯化的重组大米α-球蛋白为抗原免疫白兔,制备出了抗大米α-球蛋白多克隆抗体。Western Blotting 检测结果显示,该抗体能够特异性地与大米α-球蛋白进行免疫结合反应,抗大米α-球蛋白抗体与目标蛋白的结合呈现出一定的定量关系。并且,利用该抗体构建起了大米α-球蛋白的 ELISA检测分析方法,并对3种大米样品中α-球蛋白的含量进行了检测分析。
关键词:大米;α-球蛋白;原核表达;抗体;检测分析;Western Blotting;ELISA
中图分类号: TS201.2+1 文献标志码: A
文章编号:1002-1302(2016)11-0034-04
水稻是世界三大重要的粮食作物之一,世界上一半以上的人口以大米为主食。大米为人们提供了必需的淀粉、蛋白质、脂类、维生素和微量元素等。大米的蛋白质成分影响着大米的营养价值、口感及深加工过程。大米蛋白质可以分为水溶性的清蛋白、盐溶性球蛋白、醇溶蛋白和碱溶性谷蛋白[1]。大米中的贮存蛋白质聚集成2种蛋白体,即蛋白体Ⅰ和蛋白体Ⅱ。蛋白体Ⅰ包含有醇溶蛋白,蛋白体Ⅱ是由谷蛋白和球蛋白组成的[2]。大米α-球蛋白是大米球蛋白的一种,它主要存在于大米蛋白体Ⅱ中[3-4]。
虽然大米被认为是一种低致敏原食物,但是,基于对摄食大米产生过敏反应患者血清IgE抗体的免疫分析,鉴定出几种分子量为60、33、26、14~16、9 ku的大米蛋白质为致敏原[3-7]。其中分子量为26 ku的蛋白质被鉴定为大米 α-球蛋白,而且,大米α-球蛋白是大米盐溶蛋白的主要组分[3]。转基因水稻是继转基因玉米、大豆、棉花和油菜之后最具开发潜力的转基因作物。被赋予抗病、抗虫、高产优质等性状的转基因水稻的研究开发已经在我国和其他国家展开[8-13]。致敏原表达水平的评价是转基因作物安全性评价的重要指标之一,包括α-球蛋白在内的大米主要致敏原检测也是转基因大米安全性分析的重要内容之一[13-15]。
为了开发出对大米α-球蛋白进行定性检测和定量分析的方法,本研究以大米α-球蛋白基因的cDNA为模板进行了 PCR扩增,并把扩增的目的片段亚克隆到表达质粒pQE30中,进而在大肠杆菌中进行大米α-球蛋白的表达。以重组大米α-球蛋白为抗原制作抗体,既可避免繁琐的蛋白质提取过程,也可以防止由于共存大米蛋白而引起的交叉免疫反应。随后,以重组α-球蛋白为抗原免疫白兔制备了多克隆抗体。本研究分析了该抗体的特异性,并利用此抗体建立了对大米α-球蛋白进行定性和定量分析的检测方法。
1 材料与方法
1.1 材料
编码大米α-球蛋白的cDNA购自日本生物资源研究所;pQ30、Ni-NTA Superflow Cartridge、QIAGEN 质粒纯化试剂盒、QIAGEN PCR 产物纯化回收试剂盒和QIAquick 凝胶提取试剂盒购自QIAGEN公司;蛋白酶抑制剂混合片Complete Mini和PCR 试剂盒Expand High Fidelity PCR System购自德国罗氏公司;限制性内切酶BamHⅠ和HindⅢ、去磷酸化试剂盒和Mighty DNA克隆试剂盒购自TaKaRa公司;CEQ Dye Terminator Cycle Sequencing Kit购自美国贝克曼库尔特有限公司;Bezonase核酸酶购自默克公司;Can Get Signal Solution 1 和 Can Get Signal Solution 2 购自东洋纺公司;Lysing Matrix D购自日本船越公司;HRP标记的羊抗兔IgG,Quick Start Bradford蛋白质分析试剂盒、TMB显色液(A、B 2种),PVDF膜和Precision Plus Protein Dual Color Standards购自美国伯乐公司;ECL Prime Western Blotting System,HiTrap Protein A HP 购自 GE Healthcare公司;Perioxidase Labeling Kit-NH2购自日本同仁化学研究所;IMMUNO-TEK Construction System购自 ZeptoMetrix公司;大米样品是从农户处购买的3种东北产糙米。
1.2 编码大米α-球蛋白基因的亚克隆以及表达载体的构建
1.2.1 PCR擴增目的片段
以编码大米α-球蛋白基因的cDNA为模板,用Expand High Fidelity PCR System对编码大米α-球蛋白的基因进行PCR扩增。用于扩增大米α-球蛋白基因的正向引物是 5′-AAA[ZZ(Z]GGATCC[ZZ)]CTGAGCGAGTCGGAGATGAGG-3′,其中用下划线标出的序列是BamHⅠ酶切位点;反向引物是 5′-TTT[ZZ(Z]AAGCTT[ZZ)]CTACTACTAGTACTGGCCGGC-3′;其中用下划线标出的序列是HindⅢ酶切位点。
50 μL PCR反应体系:5×反应液5 μL、 正向和反向引物(10 μmol/L) 各2 μL、 模板DNA 300 ng、 dNTP混合物(每种dNTP各10 mmol/L) 1 μL、 Expand HiFi Enzyme Blend(5 U/μL)0.5 μL,补充MilliQ水至50 μL。 PCR扩增条件: 94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸60 s,30个循环;72 ℃延伸5 min。
1.2.2 目的片段的回收和连接
PCR产物先用QIAGEN PCR产物纯化回收试剂盒纯化,再用限制性内切酶BamHⅠ和HindⅢ进行双酶切,最后用QIAGEN PCR产物纯化回收试剂盒纯化酶切产物。质粒pQE30用限制性内切酶BamHⅠ和HindⅢ双酶切后,进行琼脂糖凝胶电泳,切下含酶切载体片段的凝胶,用QIAquick 凝胶提取试剂盒纯化载体片段,并用去磷酸化试剂盒进行去磷酸化。
1.2.3 重组质粒转化
用Mighty DNA 克隆试剂盒将酶切后的PCR产物与酶切并去磷酸化的质粒载体片断进行连接,然后将连接产物转化大肠杆菌E. coli JM109。挑选青霉素抗性克隆进行液体培养过夜,并用QIAGEN 质粒纯化试剂盒纯化质粒。用限制性内切酶BamHⅠ酶切质粒后,通过琼脂糖凝胶电泳比较酶切片段长度,鉴定是否有插入子。
1.2.4 重组质粒测序
用CEQ Dye Terminator Cycle Sequencing Kit对重组质粒的插入序列进行测序反应。采用PQE30的启动子区引物和反向测序引物分别进行正向和反向测序反应,并用 Beckman-Coulter CEQ 2000 DNA 分析系统(贝克曼库尔特有限公司)进行测序分析。
1.3 重组大米α-球蛋白的表达及重组蛋白的金属亲和层析纯化
将经过测序确定的含有正确基因编码序列质粒的重组大肠杆菌进行小规模液体培养和诱导,确认重组蛋白的诱导表达情况。将已经确认表达重组蛋白的克隆接种于含青霉素50 μg/mL的LB培养基中,在37 ℃恒温培养箱内振荡培养过夜。次日,用含青霉素50 μg/mL的LB培养基把过夜培养液稀释50倍,在37 ℃恒温培养箱内振荡培养。当D600 nm达到0.6时,添加IPTG至1 mmol/L,继续培养4 h。4 ℃、6 000 g 离心20 min。将离心得到的大肠杆菌沉淀保存在 -80 ℃ 低温冰箱中。
按照QIAGEN公司的试剂盒使用说明,用Ni-NTA Superflow Cartridge在变性条件下从大肠杆菌中对重组大米α-球蛋白进行分离和纯化。随后,向纯化得到的重组蛋白质溶液中缓缓添加等体积的TBS(20 mmol/L Tris-HCl,150 mmol/L NaCl,0.5 mmol/L EDTA,pH值8.0)并混匀,于 4 ℃ 放置2 h后,用Amicon Ultra超滤离心管(10 ku,Millipore)离心浓缩,并将溶液浓缩到TBS添加前的体积;然后再向蛋白质溶液中添加等体积的TBS,于4 ℃放置2 h后再进行离心浓缩;如此重复进行溶液置换8次,降低纯化的重组蛋白中的尿素浓度,最后,通过进一步离心浓缩,使溶液中重组蛋白质的浓度达到1 mg/mL左右。
1.4 抗大米α-球蛋白抗体的制备
准备2只新西兰白兔,将重组α-球蛋白溶液与弗氏完全佐剂充分混匀,进行皮下多点注射,初次免疫时每只白兔注射约1 mg的重组蛋白。初次免疫后每隔2周进行1次加强免疫,共加强免疫3次。加强免疫时,给每只白兔注射与弗氏不完全佐剂充分混匀的0.5 mg重组大米α-球蛋白。最后一次加强免疫4周后,取兔全血,并分离血清。
1.5 抗血清效价的ELISA 测定
以含有重组大米α-球蛋白(10 μg/m L)的包被液 100 μL,包被酶标板于4 ℃过夜。次日,用PBST溶液(0.01 mol/L PBS,pH值=7.4,0.1% Tween 20)洗板3次,每孔加入3%牛血清白蛋白-PBS溶液200 μL,于37 ℃保温 1 h,用PBST溶液洗板3次后,加入100 μL不同稀释度的抗血清,对照组用稀释相应倍数的阴性血清,于37 ℃保温1 h,再用PBST溶液洗板3次,加入100 μL HRP标记的羊抗兔IgG (1 ∶[KG-*3]6 000)溶液,于37 ℃保温1 h,用PBST溶液洗板3次后,加入100 μL新鲜配制的TMB显色液,37 ℃避光反应 10 min,加入100 μL 1 mol/L磷酸溶液,并在450 nm下测定吸光度。
1.6 大米蛋白质的提取
将大米样品分别用实验室碾磨机IFM-800DG(日本岩谷株式会社)碾磨成粉末,称取100 mg 米粉分别加入装有Lysing Matrix D的裂解管中,加入含有30 mmol/L Tris-HCl (pH值8.0)、1 mol/L NaCl和 Complete Mini的溶液 1 mL,充分混匀后,在冰水浴中放置1 h。随后,将裂解管放置在 FastPrep System FP100A(MP Biomedicals)中,在设置速度为 6.0 m/s 的条件下振荡提取40 s。4 ℃、15 000 g离心10 min,收集上清液,分装后,于-80 ℃冷冻保存。
1.7 蛋白质浓度的测定
以牛血清白蛋白为标准蛋白,用Quick Start Bradford Protein Assay Kit 对大米蛋白提取液中的蛋白质浓度进行测定。
1.8 用抗血清对大米α-球蛋白进行Western Blotting 检测
将提取的大米蛋白质用SDS-PAGE (4%浓缩胶,15%分离胶)电泳分离后,在1×转膜缓冲溶液(25 mmol/L Tris-HCl,pH值8.0,200 mmol/L 甘氨酸,20% 甲醇)中用TransBlot Semi-Dry Transfer Cell(伯乐公司)将蛋白质条带从凝胶中转到PVDF膜上,并用5%的脱脂奶粉-TTBS(20 mmol/L Tris-HCl,pH值7.5,140 mmol/L NaCl,体积分数0.1% Tween 20)溶液在4 ℃封闭PVDF膜过夜。次日,将封闭的PVDF膜用TBS(20 mmol/L Tris-HCl,pH值7.5,140 mmol/L NaCl)漂洗3次后,室温下与用Can Get Signal Solution 1稀释 12 000倍的抗血清结合1 h。再用TTBS振荡洗涤3次,每次5 min。随后,室温下与用Can Get Signal Solution 2稀释6 000倍的HRP 标记羊抗兔IgG(H+L)結合1 h,再用TTBS振荡洗涤3次,每次5 min。室温下与ECL Prime化学发光试剂反应5 min,用ATTO发光摄影装置AE-6981检测化学发光信号。
1.9 大米α-球蛋白的 Sandwich ELISA检测
用 HiTrap Protein A HP从抗大米α-球蛋白抗血清中纯化抗体。将用于检测的抗体用Perioxidase Labeling Kit-NH2进行辣根过氧化物酶标记。采用IMMUNO-TEK Construction System,用抗大米α-球蛋白抗体(10 μg/mL)对酶标板进行包被,并对酶标板进行封闭。Sandwich ELISA检测前,向每孔加200 μL PBS,用封板膜封板后,放置在4 ℃过夜。次日,吸除PBS,加入用PBS稀释成一定濃度梯度的重组大米α-球蛋白溶液或者待测大米蛋白质提取液,并使每孔溶液体积为100 μL,室温反应1h后,弃蛋白质溶液,用PBST洗板3次,加入100 μL 1 ∶[KG-*3]2000稀释的辣根过氧化物酶标记抗大米α-球蛋白抗体,室温反应1 h。用 PBST洗板3次后,加入 TMB (A ∶[KG-*3]B=9 ∶[KG-*3]1)显色液100 μL,室温避光反应20 min后,加入100 μL 1 mol/L 磷酸溶液,并在450 nm 测定吸光度。
2 结果与讨论
2.1 大米α-球蛋白表达载体的构建
用PCR扩增的编码大米α-球蛋白的DNA片段经BamHⅠ和HindⅢ 双酶切后,与双酶切并且脱磷酸化的质粒pQE30载体片段连接并转化大肠杆菌。从过夜培养的青霉素平板上挑取6个菌落,接种于含50 μg/mL 青霉素的LB培养基中,过夜培养后,纯化质粒,通过用BamHⅠ酶切质粒后进行琼脂糖凝胶电泳,初步确定质粒中有无插入子。从图1可以看出,在挑选的6个克隆中有5个克隆所含质粒的长度比载体质粒大,表明有插入序列,然后通过测序分析,发现在这5个质粒中的插入子都具有与编码大米α-球蛋白基因相一致的序列并且以正确的方向插入到载体中。
在BamHⅠ酶切后的重组质粒中,有5个(泳道1、2、4、5、6)质粒片段的长度大于酶切的载体质粒(泳道7),表明这5个重组质粒中含有插入子。
2.2 重组蛋白质的诱导表达及纯化
在用IPTG诱导2 h 后,重组大米α-球蛋白在来自2个重组大肠杆菌菌落的菌体中均已有了显著的表达(图2),为了获得更多的重组蛋白,在用IPTG诱导4 h 后进行菌体收集。在变性的条件下,用Ni-NTA Superflow Cartridge对重组蛋白进行了纯化,因为重组大米α-球蛋白的表达水平较高,而且与金属亲和层析凝胶有较强的结合力,所以,在pH值=4.5的洗脱液中,重组大米α-球蛋白被纯化为主要的蛋白质组分(图3)。随后,通过溶液置换和离心浓缩,使重组蛋白质溶液中尿素的浓度降低至0.03 mol/L。虽然在溶液置换过程中,有部分的重组蛋白沉淀出来,但是,仍然回收到了可溶性的重组蛋白组分。
在IPTG诱导后,重组大米α-球蛋白在挑选的2个克隆(Colony 1 和Colony 2)中进行了显著表达。在IPTG 诱导前,重组大米α-球蛋白无明显表达;当IPTG 诱导2 h和4 h时,重组大米α-球蛋白均有显著表达。
2.3 抗血清效价的ELISA检测
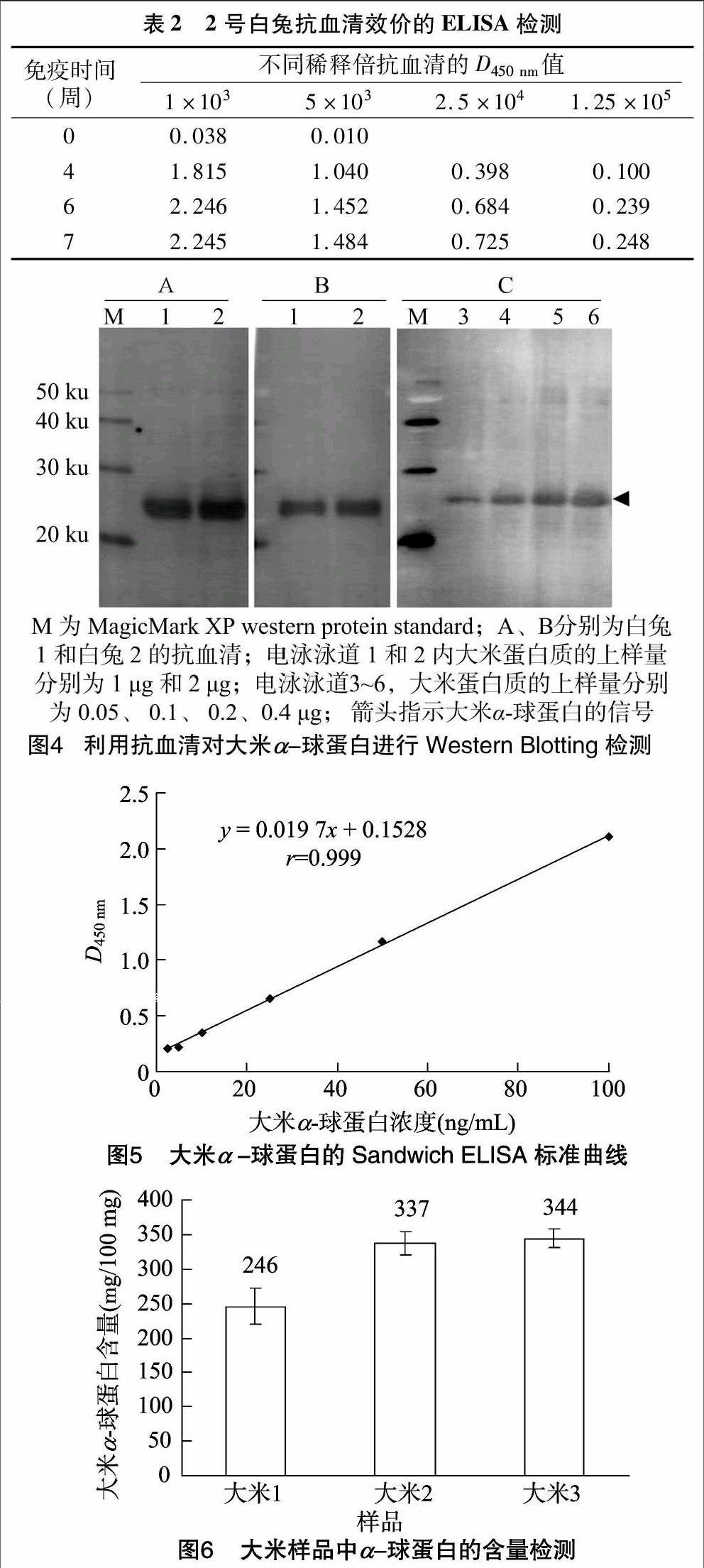
抗血清效价的ELISA检测结果见表1和表2。免疫前 (0周),2只白兔血清的免疫反应都非常低,而且1号白兔血清的免疫反应较2号白兔血清更低。免疫进行到4周和6周时,2只白兔抗血清的抗体滴度均较前次采血样品有显著的提高。免疫进行到7周时,2号白兔血清抗体滴度较6周时无明显变化;而1号白兔血清抗体滴度较6周时又略有升高,最后,2只白兔血清的抗体滴度均高于1 ∶(1.25×105)。ELISA检测结果显示,2只白兔抗血清中的抗体对抗原都具有较强的免疫结合活性。因为1号白兔血清的抗体滴度略高于2号白兔血清的抗体滴度,所以,在后续的研究中,主要利用1号白兔血清的抗体进行了检测方法的建立和检测分析。
2.4 大米α-球蛋白的Western Blotting 检测
Western Blotting 结果(图4-A、图4-B)显示,2只白兔的抗血清均与大米蛋白质中分子量为26 ku的蛋白质发生了特异性的免疫结合反应,分子量26 ku正是所报道的大米α-球蛋白的分子量[16-17],所以,以重组大米α-球蛋白免疫白兔制备的抗血清可以特异性地识别并结合大米α-球蛋白。而且,随着大米蛋白质上样量的提高,检测信号逐渐增强[JP3](图4-C)。因此,抗大米α-球蛋白抗体与目标蛋白的结合呈现一定的定量关系,表明此抗大米α-球蛋白抗体不仅可用于大米α-球蛋白的定性检测,而且可用于目标蛋白质的定量分析。
2.5 大米α-球蛋白的Sandwich ELISA检测
利用从抗血清中纯化的抗大米α-球蛋白抗体,采用 IMMUNO-TEK Construction System 构建了大米α-球蛋白的Sandwich ELISA检测体系。以重组蛋白质的浓度为横坐标,以在波长450 nm 处的吸光度为纵坐标,所得标准曲线如图5所示。标准曲线的回归方程为y=0.019 7x+0.152 8,检出限为0.526 ng/mL,在线性范围为2.5~100 ng/mL的范围内,大米α-球蛋白标准曲线的相关系数为0.999,因此,具有较好的线性关系,从而保证了定量的准确性。
利用此Sandwich ELISA检测体系,对3种大米样品中的α-球蛋白含量进行了测定,3种大米的α-球蛋白含量见图6。结果表明,3种大米样品中,3号米中α-球蛋白的含量最高,2号米中α-球蛋白的含量次之,1号米中α-球蛋白的含量最低。所以,此Sandwich ELISA检测体系可应用于比较大米样品之间α-球蛋白的含量,以及用于比较转基因大米与其宿主大米品种之间α-球蛋白的表达水平。
3 結论
以pQE30为表达载体,在大肠杆菌E. coli JM109中实现了大米α-球蛋白的高效诱导表达。以重组大米α-球蛋白为抗原免疫白兔制备出了抗大米α-球蛋白的多克隆抗体。利用此抗体对大米中的α-球蛋白进行了Western Blotting检测,该抗体能够特异性地与大米α-球蛋白进行结合反应,而且,抗大米α-球蛋白抗体与大米α-球蛋白的结合呈现一定的定量关系。另外,利用此抗体构建了大米α-球蛋白的Sandwich ELISA检测体系,并利用此检测体系测定出了3种大米样品中α-球蛋白的含量。因此,利用抗大米α-球蛋白抗体建立起的Western Blotting和Sandwich ELISA检测方法可以应用于大米α-球蛋白的定性检测和大米样品间α-球蛋白含量的比较分析。
参考文献:
[1]Tanaka K,Sugimoto T,Ogawa,et al. Isolation and characterization of two types of protein bodies in the rice endosperm[J]. Agricultural and Biological Chemistry,1980,44:1633-1639.
[2]Kubota M,Saito Y,Masumura T,et al. In vivo digestibility of rice prolamin/protein body-Ⅰ particals decreased by cooking[J]. Journal of Nutritional Science and Vitaminology,2014,60(4):300-304.
[3]Lee H J,Jo Y M,Lee J Y,et al. Lack of globulin synthesis during [JP3]seed development alters accumulation of seed storage proteins in rice[J]. International Journal of Molecular Science,2015,16(7):14717-14736.
[4]Nakase M,Izaki K,Hidaka I. Reduction of rice ptroeins based on their solubility and evaluation of the low-protein rice products[J]. Bulletin Minamikyushu University,2012,42A:15-20.
[5]Usui Y,Nakase M,Hotta H,et al. A 33-kDa allergen from rice (Oryza sativa L. japonica). cDNA cloning,expression,and identification as a novel glyoxalase Ⅰ[J]. Journal of Biological Chemistry,2001,276:11376-11381.
[6]Urisu A,Yamada K,Masuda S,et al. 16-kilodalton rice protein is one of the major allergens in rice grain extract and responsible for cross-allergenicity between cereal grains in the Poaceae family[J]. [JP3]International archives of allergy and immunology,1991,96:244-252.
[7]Enrique E,Ahrazem O,Bartra J,et al. Lipid transfer protein is involved in rhinoconjunctivitis and asthma produced by rice inhalation[J]. Journal of Allergy and Clinical Immunology,2005,116:926-928.
[8]邓力华,邓晓湘,魏岁军,等. 抗虫抗除草剂转基因水稻B1C893的获得与鉴定[J]. 杂交水稻,2014,29(1):67-71.
[9]熊 燕,陈大明,王 斌,等. 转基因农作物商业化种植情况与挑战[J]. 生物产业技术,2009,2:10-16.
[10]谭远军,高 瞻,陈丽丽. 转基因作物与安全性[J]. 黑龙江农业科学,2013(1):101-103.
[11]Satoh R,Nakamura R,Komatsu A,et al. Proteomic analsis of known and candidate rice allergens between non-transgenic and transgenic plants[J]. Regulatory Toxicology and Pharmacology,2011,50(3):437-444.
[12]王 宁. 基于文献的我国转基因水稻研究发展态势分析[J]. 北方水稻,2014,44(6):5-6,11.
[13]Satoh R,Nakamura R,Komatsu A,et al. Proteomic analysis of known and candidate rice allergens between non-transgenic and transgenic plants[J]. Regulatory Toxicology and Pharmacology,2011,59:437-444.
[14]Takagi H,Saito S,Yang L,et al. Oral immunotherapy against a pollen allergy using a seed-based peptide vaccine[J]. Plant Biotechnology Journal,2005,3:521-533.
[15]Wakasa Y,Takagi H,Watanabe N,et al. Concentrated protein body product derived from rice endosperm as an oral tolerogen for allergen-specific immunotherapy-a new mucosal vaccine formulation against Japanese cedar pollen allergy[J]. PLoS One,2015,10(3):e0120209.
[16]Komatsu S,Hirano H. Rice seedglobulin:a protein similar to wheat seed glutelin[J]. Phycytochemistry,1992,31:3455-3459.
[17]Pan S J,Reeck G R.Islation and characterization of rice α-globulin[J]. Cereal chemistry,1988,65:316-319.

