溃疡性结肠炎中Gal-3与BCL-2表达的意义
钟文洲,林松挺,陈正义,黄晓曦
溃疡性结肠炎(ulcerative colitis, UC)为肠道慢性非特异性炎症疾病,其病变大多局限于结直肠黏膜及黏膜下层,病变部位多发生在直肠和乙状结肠,甚至包括整个结肠,然而临床对其病因尚不明确,国外相关研究认为细胞凋亡对UC的免疫功能影响极大[1]。B淋巴细胞瘤-2基因(B cell leukemia/lymphoma-2, BCL-2)作为细胞凋亡抑制基因,其功能为抑制细胞正常凋亡。半乳糖凝集素3(Galectin-3, Gal-3)为糖粘合蛋白,其不仅与调节细胞的增殖、凋亡、黏附和迁移等细胞活动有关,还参与免疫调节、肿瘤发生和转移等生理和病理活动[2]。BCL-2和Gal-3在结构上相似,本实验探讨两者在UC患者结直肠黏膜组织中表达及与UC发病的关系。
1 材料与方法
1.1一般资料选取海南省海口市人民医院消化内科2014年8月~2015年12月消化科住院部及门诊确诊为UC的患者64例,其中男性41例,女性23例,年龄23~78岁,平均(42.3±12.1)岁,设为观察组。另选取健康志愿者50例作为对照组,其中男性31例,女性19例,年龄21~75岁,平均(41.1±11.7)岁。两组患者年龄、性别分布差异无统计学意义。根据Riley分级[3]:Ⅰ级为黏膜充血,黏膜下血管网模糊并有淤血,Ⅱ级在Ⅰ级的基础上充血更加明显,并复加小溃疡及黏膜颗粒,Ⅲ级在Ⅱ级的基础上颗粒更为明显,并添加自发性出血,小溃疡融合及出血脓性渗出物。观察组中Ⅰ级28例,Ⅱ级21例,Ⅲ级15例。本实验经院伦理协会批准,所有实验患者均自愿签署知情同意书。
1.2试剂与器械兔抗人Gal-3、BCL-2多克隆抗体(ABGENT公司,美国),辣根过氧化物酶HRP标记亲和纯化山羊抗兔IgG(H+L)(Jackson Immunoresearch公司,美国),恒温箱(北京中仪万成科技公司)。
1.3方法
1.3.1免疫组化 采用免疫组化SP法检测BCL-2和Gal-3的表达,一抗为兔抗人Gal-3或BCL-2多克隆抗体,二抗为辣根过氧化物酶HRP标记亲和纯化山羊抗兔IgG(H+L)。将石蜡切片进行常规脱水及水化,第1次PBS冲洗后,灭活内源性过氧化物酶,通过高温高压修复抗原,第2次进行PBS冲洗。将兔抗人Gal-3 2 000倍稀释或BCL-2多克隆抗体100倍稀释,将一抗加入冲洗好的石蜡液内,放进恒温箱内孵育2 h,第3次进行PBS冲洗,加入二抗,放进恒温箱内孵育30 min,第4次进行PBS冲洗,DAB显色,第5次进行PBS冲洗,使用苏木精进行复染,待返蓝、脱水、烤干后封片。将PBS设置为一抗代替物作为阴性对照,设置空白对照组[4]。
1.3.2判断标准 使用光镜进行观察,通过观察染色程度进行阳性判断,无阳性着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分[5]。以细胞质或细胞核出现明显黄色颗粒为阳性。同时可通过显微细胞计数检测着色细胞比例:无阳性细胞为0分,1%~10%为1分,10%~50%为2分,50%~75%为3分,75%~100%为4分。将两项得分结果相乘:≥3分为阳性,<3分为阴性[6]。
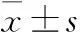
2 结果
2.1UC和正常结直肠黏膜上皮细胞中BCL-2和Gal-3的表达Gal-3表达于结直肠黏膜上皮细胞的细胞质,呈棕黄色,其在正常结直肠黏膜上皮细胞的细胞质表达水平较高,分布均匀,在UC结直肠黏膜上皮细胞的细胞质中表达水平较低,且分布不均,呈斑点状(图1、2)。BCL-2表达于结直肠黏膜上皮细胞的细胞质,呈棕黄色颗粒,其在正常结直肠黏膜上皮细胞的细胞质表达水平较低,表达主要区域为结肠隐窝基底部,在UC结直肠黏膜上皮细胞细胞质中的表达水平较高,表达强烈的细胞主要为淋巴细胞、中性粒细胞和浆细胞(图3、4)。对照组的Gal-3阳性率为100%,高于观察组的37.5%(χ2=48.142,P<0.001);对照组的BCL-2阳性率为20%,低于观察组的90.62%(χ2=58.171,P<0.001,表1)。

表1 溃疡性结肠炎和正常结直肠黏膜上皮细胞中BCL-2和Gal-3表达[n(%)]

①②③④
图1Gal-3在正常结直肠黏膜上皮细胞中的表达,SP法
图2Gal-3在溃疡性结肠炎结直肠黏膜上皮细胞中的表达,SP法
图3BCL-2在正常结直肠黏膜上皮细胞中的表达,SP法
图4BCL-2在溃疡性结肠炎结直肠黏膜上皮细胞中的表达,SP法
2.2不同内镜分级UC患者BCL-2和Gal-3的表达水平UC Ⅰ级与Ⅱ级Gal-3阳性率的比较,差异无统计学意义(χ2=3.600,P=0.058);UC Ⅰ级Gal-3阳性率高于UC Ⅲ级(χ2=4.532,P=0.033);UC Ⅲ级与Ⅱ级Gal-3阳性率差异无统计学意义(χ2=0.183,P=0.669);UC Ⅰ级BCL-2阳性率低于UC Ⅱ级(χ2=5.539,P=0.019);UC Ⅰ级BCL-2阳性率低于UC Ⅲ级(χ2=6.098,P=0.014);UC Ⅲ级与Ⅱ级BCL-2阳性率差异无统计学意义(χ2=0.511,P=0.475,表2)。
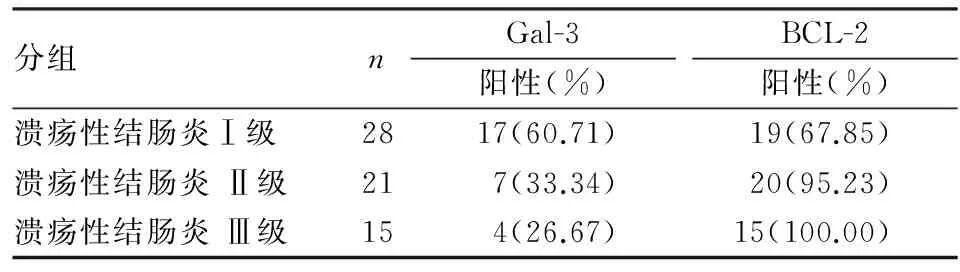
表2 不同内镜分级溃疡性结肠炎的BCL-2和Gal-3阳性率比较[n(%)]
2.3BCL-2和Gal-3表达与UC患者临床特征的关系BCL-2和Gal-3表达与UC患者性别、年龄及病程均无关(P>0.05,表3)。
表3 BCL-2和Gal-3表达与溃疡性结肠炎患者临床特征的关系[n(%)]
2.4UC结直肠黏膜组织中BCL-2和Gal-3表达的相关性UC结直肠黏膜组织中BCL-2和Gal-3表达阳性者23例,占组内35.94%,Person相关分析显示,两者表达无相关性(r=0.03,P>0.05)。
3 讨论
UC临床表现为腹部瘀结形成包块,结直肠长期受到挤压,本质上为一种占位性病变[7]。结节的长期占位严重影响结直肠正常蠕动和血液供给,因此失去免疫能力,极易引发感染。结直肠被感染后出现肠黏膜充血,纹理模糊,形成结肠炎。由于长期不愈,肠绒毛糜烂溃疡,形成板结性结节硬块,从而引发全结肠溃疡[8]。但目前对其发病因素尚未明确,BCL-2和Gal-3的结构相似,且两者均在结直肠黏膜上皮细胞的细胞质中表达,所以本实验通过探讨两者在UC结直肠黏膜组织中的表达水平,并探讨两者与UC发病的关联性。
本组实验发现,UC结直肠黏膜组织中Gal-3阳性率高于正常黏膜组织;UC结直肠黏膜组织中BCL-2阳性率为低于正常黏膜组织。表明BCL-2和Gal-3在UC结直肠黏膜组织中的表达显著异于正常结直肠黏膜组织。同时得出Gal-3在正常结直肠黏膜组织表达较为强烈,而在UC结直肠黏膜中的表达则显著减弱。UC Ⅰ级Gal-3、BCL-2阳性率与UC Ⅱ级的差异无统计学意义,与UC Ⅲ级的差异有统计学意义,而UC Ⅱ级的Gal-3、BCL-2阳性率与UC Ⅲ级的差异无统计学意义。表明Gal-3和BCL-2在UC结直肠黏膜组织中的表达受病变程度影响,且UCⅠ级Gal-3表达水平高,而在Ⅱ级和Ⅲ级表达水平较低。并且,BCL-2表达水平与Gal-3相反,随着病变程度的加深而增高。既往文献表明,BCL-2在UC结直肠黏膜组织中的表达增高为炎症反应的反应性增生,推断与隐窝上皮细胞再生修复有关[9]。此外,本组实验发现,BCL-2和Gal-3的表达与患者性别、年龄及病程均无关,同时两者在UC结直肠黏膜组织中的表达并无关联性。结果进一步证明BCL-2和Gal-3表达只与病程相关,同时两者间并无相互影响。然而国内研究发现,BCL-2和Gal-3在UC结直肠黏膜中的表达呈协同作用,两者具备相关性[10],与本文实验结果不一致,日后应进行更多实验进行验证。
Gal-3是一类糖粘合蛋白家族,具有多种生物学行为。Gal-3常以同二聚体的形式存在,主要存在于细胞质中,细胞核和细胞表面也有表达[11]。外源性Gal-3可刺激成纤维细胞、肾小球细胞和平滑肌细胞生长;内源性Gal-3在细胞生长中起作用。通过转染Gal-3反义寡核苷酸或者反义cDNA而使细胞系Gal-3表达受抑制[12]。既往研究表明,Gal-3存在抗凋亡作用,其表达水平增高有利于细胞抵抗由各种因素介导的细胞凋亡,并在凋亡刺激物的作用下,其能转移到核周膜,且浓缩于线粒体内,抑制细胞色素C释放和防止线粒体遭受破坏[13]。此外Gal-3具备抗炎作用及介导细胞黏附作用[14]。BCL-2位于人体内18号染色体,易位于14号染色体。BCL-2是目前发现的与凋亡关系密切的原癌基因之一,能够编码BCL-2α和BCL-2β两种蛋白质,主要存在于线粒体外膜、核膜及部分内质网中[15]。BCL-2可抑制细胞凋亡,从而延长细胞生存时间,正常结肠上皮组织发生凋亡的主要场所在隐窝和绒毛顶部,可通过清除衰老细胞,控制总体细胞数量,从而保持上皮组织的完整性。在炎性状态下,细胞较正常情况下处于高激活状态,更容易凋亡,故BCL-2在炎性组织中表达水平较高[16]。
溃疡性结肠炎病因尚未明确,但临床目前存在以下4个看法[17]:(1)感染学说:因本病的病理变化和临床表现与细菌痢疾非常相似,相关研究从患者粪便中提取出细菌并发现可用抗生素治疗;(2)免疫学说:认为自身免疫介导的组织损伤是溃疡性结肠炎发病的重要因素,相关研究发现肠壁病原体与人体结直肠上皮细胞存在交叉感染,从而引发机体免疫作用杀伤自身上皮细胞;(3)遗传学说:国外数据表明白种人的UC发病率较黑种人显著提高;(4)精神因素,认为精神障碍引起自主神经功能失调,导致肠壁炎症及溃疡形成。
综上所述,BCL-2在UC结直肠黏膜组织中的表达水平高于正常结直肠黏膜组织,Gal-3表达水平低于正常结直肠黏膜组织,表达受UC内镜分级影响,但与患者性别、年龄及病程均无关。Gal-3和BCL-2在UC发病中可起到独立作用。
[1] Singh S, Gupta M, Singh G,etal. Gelatinous transformation of bone marrow: a prospective tertiary center study, indicating varying trends in epidemiology and pathogenesis[J]. Indian J Hematol Blood Transfus, 2016,32(Suppl 1):358-360.
[2] Spalinger M R, Scharl M. The role for protein tyrosine phosphatase non-receptor type 22 in regulating intestinal homeostasis[J]. United European Gastroenterol J, 2016,4(3):325-332.

[4] 王银君, 郑学宝, 朱宇珍, 等. 溃疡性结肠炎基因单核苷酸多态性的研究进展[J]. 广东医学, 2013,34(18):2886-2888.
[5] Abogresha N M, Greish S M, Abdelaziz E Z,etal. Remote effect of kidney ischemia-reperfusion injury on pancreas: role of oxidative stress and mitochondrial apoptosis[J]. Arch Med Sci, 2016,12(2):252-262.
[6] 李 莉, 韩俊岭. BCL-2/Bax在溃疡性结肠炎肠黏膜中的表达及与细胞凋亡的关系[J]. 河北医药, 2012,34(5):655-657.
[7] Spalinger M R, Scharl M. The role for protein tyrosine phosphatase non-receptor type 22 in regulating intestinal homeostasis[J]. United European Gastroenterol J, 2016,4(3):325-332.
[8] 李英健, 赵恩宏, 苏 锐, 等. 大肠癌组织中MMP-2与Galectin-3的表达及临床意义[J]. 中国老年学杂志, 2014,34(14):3910-3912.
[9] 李英健, 赵恩宏, 苏 锐, 等. 大肠癌组织中 Galectin-3的表达及临床意义[J]. 河北医学,2014,20(9):1421-1425.
[10] Nidhi, Rashid M, Kaur V,etal. Microparticles as controlled drug delivery carrier for the treatment of ulcerative colitis: a brief review[J]. Saudi Pharm J, 2016,24(4):458-472.
[11] 王 倩, 吕永慧, 周丽梅, 等. BCL-2与Caspase-3在溃疡性结肠炎中的表达与意义[J]. 天津医药, 2013,41(9):849-851.
[12] Somal A, Aggarwal A, Upadhyay R C. Effect of thermal stress on expression profile of apoptosis related genes in peripheral blood mononuclear cells of transition Sahiwal cow[J]. Iran J Vet Res, 2015,16(2):137-143.
[13] 眭怡群, 冯一中. 自噬相关基因LC3、Beclin-1与凋亡相关基因p53、BCL-2在大肠癌中的表达及意义[J]. 临床与实验病理学杂志, 2012,28(3):282-286.
[14] Szymańska E, Szymańska S, Szczepański M,etal. Demographic characteristics of children with early clinical manifestation of inflammatory bowel disease[J]. Prz Gastroenterol, 2016,11(1):14-17.
[15] Kitade H, Matsuura T, Yanagida H,etal. Superior mesenteric artery syndrome after ileal pouch-anal anastomosis for colon cancer associated with ulcerative colitis: report of a case[J]. Surg Case Rep, 2015,1(1):27.
[16] Kuno T, Kojima Y, Mochizuki H,etal. Factors predicting subsequent hospitalization in patients with ulcerative colitis: total colonoscopic findings are the strongest predictor[J]. Hepatogastroenterology, 2015,62(140):821-824.
[17] Sezgin G, Dabak R, Kaya F O,etal. The association of endoplasmic reticulum aminopeptidase-1 (ERAP-1) with familial mediterranean fever (FMF)[J]. United European Gastroenterol J, 2016,4(1):92-96.

