非小细胞肺癌患者进行手术前后其循环肿瘤细胞测量值的变化与其肿瘤复发转移的相关性
林 赟,石 毅,薛 洋
(四川省医学科学院,四川省人民医院,四川 成都 610072)
肺癌是世界范围内致死率最高的癌症。按照病理组织学分类标准,肺癌分为非小细胞肺癌(NSCLC)和小细胞肺癌。NSCLC患者的人数约占全部肺癌患者人数的85%。NSCLC具有预后差、死亡率高等特点。相关的研究表明,肿瘤复发转移是导致NSCLC患者高死亡率的重要原因[1-2]。有研究表明,通过对NSCLC患者病情进展的情况进行实时监测,并及时对其进行相应的治疗,可降低其肿瘤复发转移的几率,延长其生存期。以往,临床上主要使用传统的组织病理学检查和影像学检查等方法监测NSCLC患者病情进展的情况及评估其预后。组织病理学检查虽然是临床上诊断NSCLC的金标准。但此检查方法无法多次对NSCLC患者进行组织活检,不能对其病情的进展情况进行监测。而对NSCLC患者进行影像学检查时,其微小的转移病灶不易被发现。燕翔等[3]的研究表明,检测血液肿瘤标志物虽然在对NSCLC患者的病情进行诊断时具有一定的价值,但对其病情进展的情况进行监测的效果并不理想。循环肿瘤细胞(CTC)是一种在肿瘤组织上脱落后进入到外周血循环中的肿瘤细胞,是肿瘤发生远处转移的关键因素。1869年澳大利亚的一名医生在对晚期肿瘤患者进行解剖时发现其血样中含有CTC,自此就启动了临床医生对CTC与肿瘤的生长、恶化和扩散的相关研究[4]。国内外大量的研究结果均证实,与进行影像学检查和进行组织病理学检查相比,进行CTC检测对评估恶性肿瘤患者的预后更具优势。CTC的测量值可为多种转移癌(如乳腺转移癌、前列腺转移癌、结肠转移癌、直肠转移癌、肺转移癌)患者的预后评估提供参考[5-6]。目前,在国内的临床研究中对NSCLC患者进行手术前后,其CTC测量值的变化与其肿瘤复发转移相关性的研究刚刚开始。为此,笔者对在四川省人民医院进行外科手术治疗的100例NSCLC患者的临床资料进行回顾性研究。现报告如下。
1 资料与方法
1.1 一般资料
本次研究的对象为2015年1月至2016年1月期间在四川省人民医院进行外科手术的100例NSCLC患者。本次研究对象的纳入标准是:1)患者的病情经细胞学检查和组织病理学检查后,被确诊为NSCLC。2)患者的临床资料完整。3)患者的心肝肾等重要脏器的功能正常或基本正常。4)患者的术后生存期>3个月。5)患者的年龄为25~80岁。6)患者及其家属对本研究的内容和目的均知情,并自愿签署了参加本次研究的知情同意书。其排除标准是:1)合并有其他恶性肿瘤的患者。2)在参加本次研究前的5年内被确诊患有其他恶性疾病的患者。3)在参加本次研究前的半年内接受过相关治疗的NSCLC患者。4)有症状性脑转移的NSCLC患者。5)存在大量浆膜腔积液的患者。6)采血时间不在预定时间点内的NSCLC患者。7)采集的血液样本中有凝结血块的NSCLC患者。在这100例患者中,有男性68例,女性32例;其年龄为25~80岁,平均年龄为(59.75±6.52)岁;其中肺鳞癌患者有70例,肺腺癌患者有25例,大细胞肺癌患者有4例,肺腺鳞癌患者有1例;其中TNM分期为Ⅰ期的患者有45例,为Ⅱ期的患者有28例,为Ⅲ期的患者有22例,为Ⅳ期的患者有5例;其中肿瘤分化程度为高分化的患者有58例,为中分化的患者有25例,为低分化的患者有17例。
1.2 研究方法
在进行手术前和进行手术后的48 h,对这100例患者均进行CTC检测。进行CTC检测的方法是:1)在术前和术后的48 h,采集患者4 mL的全血作为血液标本。将血液标本置于EDTA管(血常规采血管)内,上下颠倒7次,以使抗凝剂与血液充分混合。将血液标本在4℃~8℃的温度下暂存。在24 h内对血液标本进行检测。2)使用密度梯度离心法对血液标本进行富集。⑴用商品化分离液将血液标本加入惰性梯度介质中进行离心沉降或沉降平衡。⑵按照血液中各种细胞密度的不同,对经离心处理后的血液标本中的各种细胞成分进行分层,从下向上依次为红细胞、中性粒细胞、分离液、单个核细胞(包括CTCs),最上层为血浆。⑶为防止进行离心处理前血液标本中的血细胞与分离液混合不利于对CTC进行分离处理,可使用OncoQuick带有多孔筛的离心管盛装血液标本。3)使用循环肿瘤细胞检测分析系统对血液标本中CTC的数量进行检测。按照术后48 h患者的CTC测量值,将这100例患者分为CTC测量值高组(其CTC值≥1)和CTC测量值低组(其CTC值=0),其中CTC测量值高组有60患者,CTC测量值低组有40例患者。术后对这100例患者均进行为期2年的随访,观察其肿瘤复发转移的情况。具体的方法是:在术后的2年内,通过电话沟通及门诊复诊的形式对患者进行随访。在进行门诊复诊时,使用CT机对患者进行骨扫描检查。通过影像学资料判断患者是否发生肿瘤骨转移,如其成骨细胞活跃且病变的敏感度高则表明其存在肿瘤复发转移的情况。对这100例患者进行手术前后其CTC的检测结果、其肿瘤复发转移的情况和临床资料进行分析研究,从中找出NSCLC患者进行手术前后其CTC测量值的变化与其肿瘤复发转移的相关性。具体的方法是:1)收集患者的临床资料。2)对患者的临床资料、CTC的检测结果和肿瘤复发转移的情况进行单因素分析。3)对影响患者术后复发转移的单因素分析结果进行赋值,再将其代入到多因素Logistic回归分析式中进行分析,从中找出患者CTC的测量值与其发生肿瘤复发转移的相关性。
1.3 观察指标
1)比较患者进行手术前和进行手术后的48 h 其CTC的测量值。2)比较两组CTC测量值不同的患者其肿瘤复发转移的发生率。3)比较肿瘤复发转移的患者和肿瘤未发生复发转移的患者的临床资料。4)观察患者CTC测量值与其发生肿瘤复发转移的关系。
1.4 统计学处理
将本次研究中的数据录入到SPSS19.0软件中进行处理,计量资料用(±s)表示,采用t检验,计数资料用%表示,采用χ²检验,等级资料比较采用Z检验;独立危险因素采用多因素Logistic回归分析,服从正态分布各变量间的相关性采用Spearman相关分析。P<0.05为差异具有统计学意义。
2 结果
2.1 进行手术前与进行手术后的48h这100例患者CTC测量值的比较
进行手术前这些患者的CTC测量值高于进行手术后48 h其CTC的测量值,差异有统计学意义(P<0.01)。详见表1。
2.2 不同CTC测量值的患者其肿瘤复发转移发生率的比较
对这100例患者进行2年术后随访的结果是:CTC测量值高组患者其肿瘤复发转移的发生率高于CTC测量值低组患者,差异有统计学意义(P<0.05)。详见表2。
表1 进行手术前与进行手术后的48 h这100例患者CTC测量值的比较(±s)Table 1 48 h peripheral blood in patients with preoperative and postoperative CTC measured values change
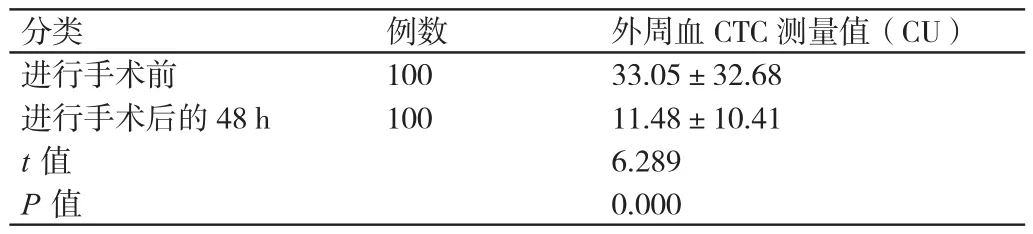
表1 进行手术前与进行手术后的48 h这100例患者CTC测量值的比较(±s)Table 1 48 h peripheral blood in patients with preoperative and postoperative CTC measured values change
分类 例数 外周血CTC测量值(CU)进行手术前 100 33.05±32.68进行手术后的48 h 100 11.48±10.41 t值 6.289 P值 0.000
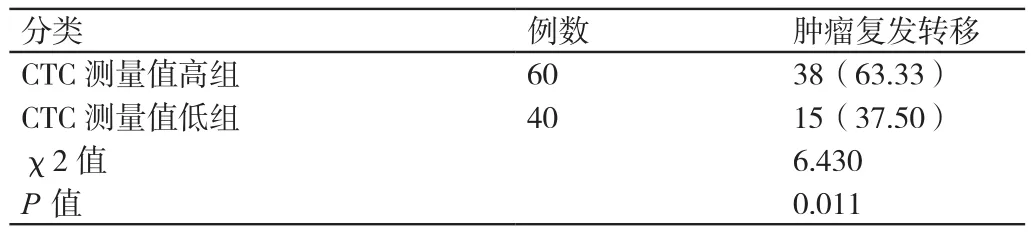
表2 不同CTC测量值的患者其肿瘤复发转移发生率的比较[n(%)]Table 2 The recurrence rate of recurrence was compared in 2 years after the operation of patients with different CTC measurements
2.3 对这100例患者肿瘤复发转移的情况与其临床资料进行分析的结果
在发生肿瘤复发转移的患者中,进行全肺切除术的患者所占的比率、术后CTC测量值高的患者所占的比率、TNM分期为Ⅲ~Ⅳ期的患者所占的比率和低分化肿瘤患者所占的比率均高于未发生肿瘤复发转移的患者,差异有统计学意义(P<0.05)。详见表3。
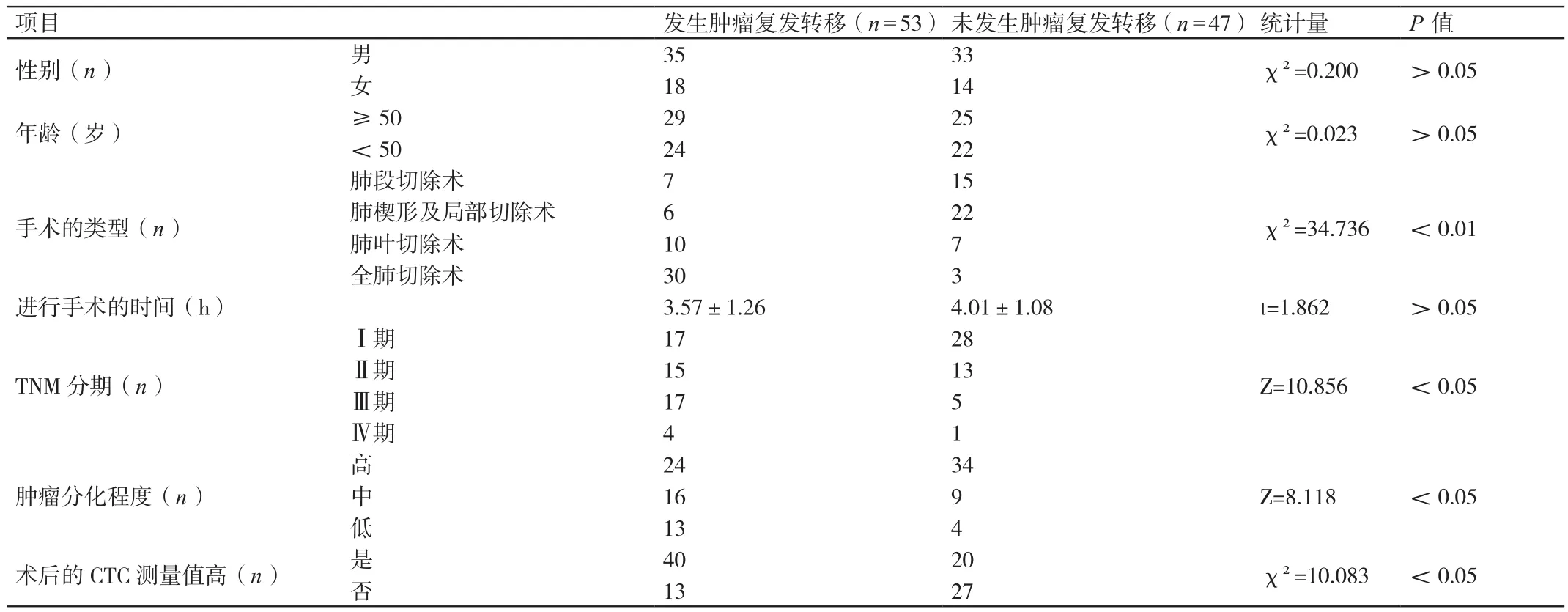
表3 对这100例患者肿瘤复发转移的情况与其临床资料进行分析的结果Table 3 Comparison of the clinical data of recurrence and unrelapsed metastasis
2.4 对影响NSCLC患者术后肿瘤复发转移的相关因素进行多因素Logistic回归分析的结果
进行手术后患者的CTC测量值高、TNM分期为Ⅲ~Ⅳ期和肿瘤低分化均是导致NSCLC患者发生肿瘤复发转移的独立危险因素(P<0.05)。详见表4。
2.5 对NSCLC患者进行手术后其CTC测量值的变化与其肿瘤复发转移的相关因素进行分析的结果
NSCLC患者进行手术后其CTC的测量值、肿瘤的TNM分期与其发生肿瘤复发转移呈正相关(r=4.021、3.589,P<0.05)。NSCLC患者肿瘤的分化程度与其发生肿瘤复发转移呈负相关(r=-3.257,P<0.05)。

表4 对影响NSCLC患者术后肿瘤复发转移的相关因素进行多因素Logistic回归分析的结果Table 4 Analysis of multifactor Logistic regression of postoperative recurrence of NSCLC patients
3 讨论
相关的研究数据显示,健康人血液标本中CTC的平均数量为1.5个/mL,局部肿瘤患者(早期)血液标本中CTC的平均数量为15.9个/mL,癌细胞淋巴结扩散患者(中期)血液标本中CTC的平均数量为47.4个/mL,癌细胞远端扩散患者(晚期)血液标本中CTC的平均数量为122个/mL[7]。Bulter[8]等对1例乳腺癌患者的CTC测量值进行研究发现,进行手术后其逐步萎缩的乳腺肿瘤在24 h内向其血液中释放了1.05×107个CTC,说明CTC数量的增加可引发癌细胞的远处转移和次发肿瘤的生长。因此,可将CTC作为对恶性肿瘤患者肿瘤复发转移情况进行监测的重要指标。近年来,大量的学者在对直肠癌患者、前列腺癌患者、肺癌患者、卵巢癌患者的CTC进行研究中均得出与上述研究相似的结果。与采集淋巴结标本和采集骨髓标本相比,采集外周血标本具有易采集、对患者造成的创伤性小、可反复采集等特点,是对NSCLC患者进行常规检测时较为理想的血液标本[9]。由于NSCLC患者的临床症状缺乏特异性,其在得到确诊时其病情多已处于中晚期,故在对其进行外科手术后,其发生肿瘤复发转移的风险极高[10]。CTC是肿瘤患者原发病灶或转移病灶中具有转移倾向的一类肿瘤细胞,其主要是通过上皮细胞-间充质转化等生物学行为迁移到血液中。有研究表明,进行手术的恶性肿瘤患者,在术后其CTC数量的增加是导致其发生肿瘤复发转移的重要因素,也是导致其死亡的主要原因[11]。相关的研究发现,NSCLC患者发生术后肿瘤复发转移与其肿瘤TNM分期为Ⅲ~Ⅳ期、肿瘤低分化存在紧密的关系[12-13]。韦文娥等[14]的研究表明,TNM分期是肿瘤学中对恶性肿瘤进行分期的一种方法,T为原发灶,N为淋巴结,M是远处转移,在患者的T、N、M确定后即可得出相应总分期(Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期),分期越高表示患者肿瘤进展的速度越快。云芬等[15]的研究表明,患者肿瘤分化的程度越低,其肿瘤细胞的形态结构越差,其肿瘤的恶性程度越高。张文利等[16]的研究表明,NSCLC患者在进行手术后,其发生肿瘤转移复发与其病理分期和肿瘤分化的程度紧密相关。万佳蔚等[17]的研究表明,NSCLC患者在进行手术后,其肿瘤复发转移的发生率与其CTC的测量值具有相关性。尹寒露等[18]的研究表明,CTC测量值的高低直接预示着NSCLC患者发生肿瘤远处扩散的几率。郭巧梅等[19]的研究表明,NSCLC患者在进行手术后,其CTC的数量增加时则预示其发生肿瘤复发转移的风险升高。本次研究的结果显示:1)进行手术前患者的CTC测量值高于进行手术后48 h其CTC的测量值。2)对这100例患者进行随访的结果是:CTC测量值高组患者其肿瘤复发转移的发生率高于CTC测量值低组患者。3)在发生肿瘤复发转移的患者中,进行全肺切除术的患者所占的比率、术后CTC测量值高的患者所占的比率、TNM分期为Ⅲ~Ⅳ期的患者所占的比率和低分化肿瘤患者所占的比率均高于未发生肿瘤复发转移的患者。4)进行手术后患者的CTC测量值高、TNM分期为Ⅲ~Ⅳ期和肿瘤低分化均是导致NSCLC患者发生肿瘤复发转移的独立危险因素。5)NSCLC患者进行手术后CTC的测量值、肿瘤的TNM分期与其发生肿瘤复发转移呈正相关。NSCLC患者肿瘤的分化程度与其发生肿瘤复发转移呈负相关。此研究结果与冯锦城[20]的研究结果相类似。
综上所述,NSCLC患者在进行手术前后其CTC测量值会发生明显变化。CTC测量值与NSCLC患者肿瘤的复发转移呈正相关。因此,可将CTC测量值作为评估NSCLC患者预后的重要参考指标。
[1]王丹.血清HE4及HCgp-39水平变化对非小细胞肺癌患者的临床意义研究[J].实用医院临床杂志,2017,14(4):138-140.
[2]高月霞,黄彬鋆,吴桂云,等.610例Ⅲ、Ⅳ期非小细胞肺癌患者预后生存分析[J].中华疾病控制杂志,2015,19(1):74-77.
[3]燕翔,焦顺昌.肿瘤浸润淋巴细胞与非小细胞肺癌预后关系的Meta分析[J].中国医学科学院学报,2015,37(4):406-414.
[4]谢升龙,薛洋,丛伟.循环肿瘤细胞检测技术在非小细胞肺癌中的研究进展[J].实用医院临床杂志,2017,14(3):135-137.
[5]许扬梅,刘巧珍,刘沁颖,等.流式细胞术检测结直肠癌根治术前后循环肿瘤细胞和循环肿瘤干细胞及其临床预测价值[J].中国肿瘤生物治疗杂志,2017,24(4):355-361.
[6]Andergassen U,Kölbl AC,Mahner S,et al.Real-time RT-PCR systems for CTC detection from blood samples of breast canc er and gynaecological tumour patients (Review)[J].Oncology Re ports,2016,35(4):1905.
[7]Cristofanilli M,Budd GT,Ellis MJ,et al.Presence of circulat ing tumor cells (CTC) in metastatic breast cancer (MBC) predic ts rapid progression and poor prognosis[J].Journal of Clinical Oncology,2005,23(16):524.
[8]Onstenk W,Gratama JW,Foekens JA,et al.Towards a personal ized breast cancer treatment approach guided by circulating tumor cell (CTC) characteristics[J].Cancer Treatment Reviews,2013,39(7):691-694.
[9]马静,刘一雄.RCC组织中MMP-9、CD44表达水平与患者临床病理特征及CTC数量分型的关系[J].山东医药,2017,57(21):87-89.
[10]张霄鹏,胡志娟,孟爱宏,等.血清趋化因子CCL20与非小细胞肺癌胸腔镜根治术后早期复发及转移的关系[J].广东医学,2015,36(23):3679-3682.
[11]白东晓,杨海军.循环肿瘤细胞检测与结直肠癌复发转移的研究进展[J].中国肿瘤临床,2017,44(3):142-145.
[12]王雷,胡志远.循环肿瘤细胞纳米检测技术用于肿瘤早期诊断的探索[J].中国肿瘤生物治疗杂志,2016,23(5):595-600.
[13]万国锦.循环肿瘤细胞对非小细胞肺癌(NSCIC)的临床价值及分析[D].广西医科大学,2015.
[14]韦文娥,利基林,宁淑芳,等.EGFR 19-del和L858R突变型NSCLC患者预后比较[J].山东医药,2016,56(17):22-25.
[15]云芬,贾永峰,韩昭,等.非小细胞肺癌组织HIF-2α表达临床意义研究[J].中华肿瘤防治杂志,2016,23(13):860-865.
[16]张文利,孙开宇,谭强,等.非小细胞肺癌组织硫氧还蛋白还原酶表达及预后分析[J].中华肿瘤防治杂志,2016,23(18):1224-1228.
[17]万佳蔚,韩志君,严子禾,等.非小细胞肺癌患者血浆循环肿瘤细胞对预后评估的意义[J].中华肿瘤防治杂志,2016(s2):37-38.
[18]尹寒露,阴建,陈立文,等.分类检测非小细胞肺癌患者外周血中循环肿瘤细胞的临床价值[J].中华肿瘤杂志,2016,38(9):677-681.
[19]郭巧梅,乔理华,王琳,等.循环肿瘤细胞检测对非小细胞肺癌的诊断价值[J].中华检验医学杂志,2016,39(8):589-594.
[20]冯锦城.循环肿瘤细胞与肝癌肝移植术后肿瘤早期复发的相关性研究[D].华中科技大学,2016.

