微波辅助酶法提取大叶栀子花总黄酮的工艺研究
刘霞+李伟+李传灵+韩加伟+范小娜

摘要:为优化微波辅助酶法提取大叶栀子花(Gardenia jasminoides var. grandiflora)总黄酮工艺。在单因素试验基础上,应用中心组合设计,采用二次多项式逐步回归分析对提取工艺条件进行优化,确定了微波辅助酶法提取大叶栀子花总黄酮工艺的最佳条件,即酶用量为1.8%,pH为5.0,酶解温度为70 ℃,酶解时间为1.0 h;按此工艺条件,大叶栀子花总黄酮提取率可达2.16%。
关键词:大叶栀子(Gardenia jasminoides var. grandiflora);总黄酮;微波辅助提取法;纤维素酶解法
中图分类号:TQ461 文献标识码:A 文章编号:0439-8114(2016)23-6219-05
DOI:10.14088/j.cnki.issn0439-8114.2016.23.055
Abstract:For optimizing the technology of extracting total flavonoids from flowers of Gardenia jasminoides var. grandiflora by microwave-assisted enzymatic method, based on single factor experiment and by application of central composite design, the technological conditions for extracting total flavonoids from flowers of Gardenia jasminoides var. grandiflora were optimized with quadratic polynomial stepwise regression analysis. It was concluded that the optimal conditions for the extraction were the enzyme dosage of 1.8%, pH 5.0, enzymolysis temperature of 70 ℃, and enzymolysis time for 1.0 h. Under these conditions, the extraction yield of total flavonoids from flowers of Gardenia jasminoides var. grandiflora was up to 2.16%.
Key words: Gardenia jasminoides var. grandiflora; total flavonoids; microwave-assisted extraction; cellulase enzymatic method
大葉栀子(Gardenia jasminoides var.grandiflora)属于茜草科栀子属物种[1],又名大花栀子、荷花栀子、牡丹栀子,为常绿灌木,主要分布在江苏、浙江、四川等地[2]。其叶大,花大而富浓香、重瓣,不结果。大叶栀子花通常被修剪成球状植于街道旁或者公园景观中,用于绿化造景[3]。其叶、花中含有大量的黄酮类化合物。药理实验表明,黄酮类化合物有明显的抗溃疡、解痉、抗炎及降血脂等生物活性[4]。目前,对茜草科植物栀子果实中提取黄酮类化合物的文献报道较多[5-8],但对大叶栀子花中黄酮类化合物的提取工艺研究报道很少。以大叶栀子花为原料,对影响其黄酮提取的主要因素用响应面试验,以总黄酮提取率为指标,用方差分析法进行分析,从而优选大叶栀子花总黄酮的提取条件并测定其黄酮提取率,为大叶栀子花资源的合理利用提供科学依据。
1 材料与方法
1.1 材料、试剂与仪器
大叶栀子的花采自赣州生态公园,经赣南医学院药学院中药鉴定教研室程齐来教授鉴定。
芦丁标准品(含量≥98%,天津一方科技有限公司);纤维素酶(3×104 U/g,江苏淮安百麦绿色生物能源有限公司);无水乙醇、石油醚、盐酸、亚硝酸钠、硝酸铝均为分析纯。
UV-6100PCS型紫外可见分光光度计(上海美谱达仪器有限公司);SHA-C水浴恒温振荡器(金坛市白塔新宝仪器厂);HH-2数显恒温水浴锅(金坛市城东新瑞仪器厂);WF-4000微波快速反应系统(上海屹尧分析仪器有限公司);FW135手提中药粉碎机(天津市泰斯特仪器有限公司);FA1104分析天平(上海舜宇恒平科学仪器有限公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司);202A-2电热干燥箱(上海阳光试验仪器有限公司);KQ3200DB型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试验方法
1.2.1 标准曲线的绘制 精密称取13.50 mg芦丁标准品,试验用现配的60%乙醇溶解,定容于100 mL容量瓶中,摇匀,得135.0 mg/L的芦丁标准储备溶液。再精密量取芦丁标准储备液0、1.0、2.0、3.0、4.0、5.0 mL,分别置于10.0 mL容量瓶中。依次分别加60%乙醇稀释至5.0 mL,加入5%亚硝酸钠溶液0.3 mL,摇匀,静置5 min,再加入0.3 mL的10%硝酸铝溶液,迅速摇匀,静置6 min,最后加入4 mL的4%氢氧化钠溶液,混匀,用乙醇稀释至刻度,充分摇匀。放置15 min后,以不加芦丁的试剂作空白对照,检测波长设定为509 nm。得吸光度(Y)与浓度X(mg/L)的标准回归方程Y=0.010 0X-0.000 6,R2=0.999 3。
1.2.2 大叶栀子花总黄酮的提取 大叶栀子花脱脂粉的制备:将烘干的大叶栀子花粉碎后,过60目筛,用一定比例[固液比(g/mL)=1∶30]的石油醚超声提取30 min,弃去石油醚,滤渣挥干石油醚,干燥后冷却备用。称重。
酶处理:准确称取大叶栀子花脱脂粉1.0 g加20 mL去离子水,置于250 mL具塞锥形瓶中,用盐酸溶液调pH,加入一定量纤维素酶在一定温度下恒温反应一定时间后(水浴锅中振荡酶解160 r/min),沸水中灭活2 min,室温下抽滤分离固体残渣和滤液Ⅰ。
微波萃取:取20 mL 70%的乙醇溶液加入到滤渣中,移入微波快速反应系统中,微波辅助处理4 min,趁热过滤,得滤液Ⅱ,合并滤液Ⅰ和滤液Ⅱ,适当减压浓缩,用70%乙醇定容于50 mL的容量瓶中备用。
1.2.3 总黄酮含量测定 吸取2 mL滤液于10 mL容量瓶中,按标准曲线下的测定方法测吸光度,计算总黄酮提取率。
1.2.4 单因素试验 ①酶用量。分析不同比例酶用量(1.0%、1.4%、1.8%、2.2%、2.6%)对大叶栀子花总黄酮提取率的影响;②pH。分析不同pH值(4.0、4.5、5.0、5.5、6.0)对大叶栀子花总黄酮提取率的影响;③酶解温度。考察不同酶解温度(45、50、55、60、65、70 ℃)对大叶栀子花总黄酮提取率的影响;④酶解时间。考察不同酶解时间(0.5、1.0、1.5、2.0、2.5、3.0 h)对大叶栀子花总黄酮提取率的影响。⑤微波萃取时间。考察不同微波萃取时间(2、4、6、8、10 min)对大叶栀子花总黄酮提取率的影响。
1.2.5 响应面试验设计 根据Box-Behnken中心组合实验设计原理,综合单因素试验结果,选取酶用量(A)、pH(B)、酶解温度(C)、酶解时间(D)4个对总黄酮提取率影响较大的因素,对提取工艺条件进行响应面分析。试验因素水平及编码见表1。
1.2.6 验证试验 对Box-Behnken中心组合试验优化后的大叶栀子花总黄酮提取工艺进行验证试验,重复3次。
2 结果与分析
2.1 单因素试验结果
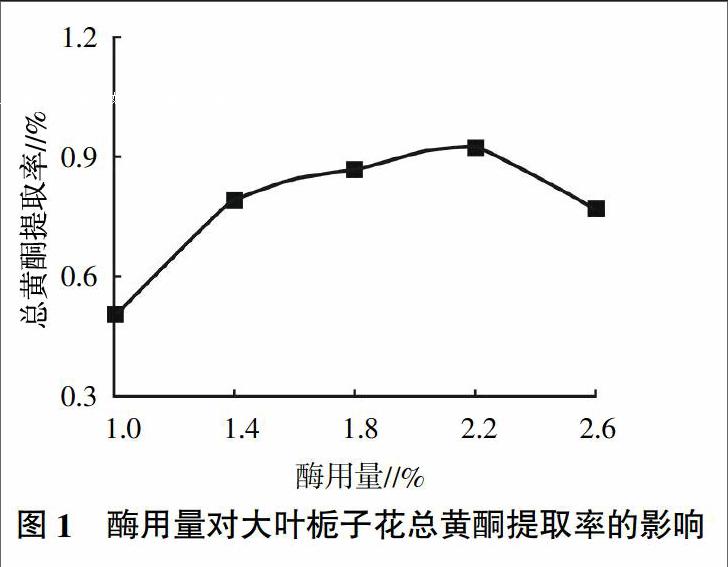
2.1.1 酶用量对大叶栀子花总黄酮提取率的影响 由图1可知,随着酶用量的增大,总黄酮的提取率也随之增大,当酶用量达到2.2%时,单位底物上的酶达到饱和浓度,总黄酮提取率达到最大值。随后增加酶的浓度,此时增加结合位点也无法与更多的底物反应,总黄酮提取率反而下降,这是因为酶用量过于饱和后,包裹住试材颗粒,反而不利于黄酮类物质的溢出[9]。故酶用量最佳为2.2%。
2.1.2 pH对大叶栀子花总黄酮提取率的影响 由图2可知,在pH为5.5时,总黄酮提取率最大。低于此值,总黄酮的提取率随pH增加而增大;高于此值时,总黄酮的提取率随pH增加而减少。这是因为pH过小或过大都能使酶变性而失活,因此选择酶解体系的最适pH为5.5。
2.1.3 酶解温度对大叶栀子花总黄酮提取率的影响 由图3可知,酶解温度在65℃时,总黄酮提取率最大。低于此值,总黄酮的提取率随温度增加而增大;高于此值时,总黄酮的提取率随温度增加反而逐渐减少。这是因为未达到酶活性的最适温度时,活性无法得到充分发挥,但温度过高也会导致酶失活以及变性[10]。因此,65 ℃是大叶栀子花总黄酮提取的适宜酶解温度。
2.1.4 酶解时间对大叶栀子花总黄酮提取率的影响 由图4可知,随着酶解时间的增加,总黄酮提取率先逐渐增大,酶解时间達到1.5 h时,总黄酮提取率达到最大值;随后,继续增加酶解时间,提取率反而逐渐下降,故将最佳酶解时间定为1.5 h。
2.1.5 微波萃取时间对大叶栀子花总黄酮提取率的影响 由图5可知,随着微波萃取时间延长,大叶栀子花总黄酮提取率先增加后下降。当微波萃取时间为4 min时,提取率达到最大值。随后继续增加微波处理时间,总黄酮提取率呈下降趋势,主要是因为反应体系受热时间过长,会导致黄酮类结构破坏,致使提取率下降。因此确定微波萃取最佳时间为4 min。
2.2 回归模型的建立及方差分析
应用Design-Expert 8.0.6.0软件对表2中的数据进行二次多元回归拟合,对试验结果进行响应面分析,得出方差分析结果(表3)和响应曲面图(图6)。
通过多元回归拟合分析得到大叶栀子花总黄酮提取率(Y)与酶用量(A)、pH(B)、酶解温度(C)、酶解时间(D)之间的二次多项回归方程:Y=46.235 0-4.183 3×A-4.981 7×B-0.899 8×C+1.207 5×D+0.85×A×B-0.021 3×A×C+0.787 5×A×D-0.036×B×C-0.11×B×D-0.087×C×D-0.041 7×A2+0.498 3×B2+0.010 1×C2+1.088 3×D2。
由表3可以看出,回归方程P<0.01,表明该回归模型达到极显著水平。模型的确定系数达0.980 5,说明该模型能解释98.05%响应值的变化。失拟项不显著(P=0.125 4>0.05),表明方程对试验拟合良好,试验误差小。pH和酶解温度对总黄酮提取率影响极显著(P<0.01),酶用量对总黄酮提取率的影响显著(P<0.05),酶解时间对试验结果影响不显著(P>0.05)。考察因素间的交互作用,由表3方差分析可知,在试验所建立的数学回归模型中,AB、AD、BC和CD之间存在极显著的交互作用,即酶用量与pH、酶用量与酶解时间、pH与酶解温度和酶解温度与酶解时间的交互作用对总黄酮提取率有极显著的影响(P<0.01)。根据Design-Expert 8.0.6.0软件对试验结果进行最优化分析,确定最佳工艺参数:酶用量为1.8%,pH为5.0,酶解温度为70 ℃,酶解时间为1.0 h,在此条件下预测总黄酮的提取率为2.23%。
2.3 验证试验
为了验证模型的可靠性和稳定性,在最佳工艺条件:酶用量为1.8%,pH为5.0,酶解温度为70℃,酶解时间为1.0 h,进行验证试验(平行3次)。结果表明,总黄酮的提取率为2.16%(n=3)。
3 小结与讨论
微波辅助提取又称微波萃取,是利用微波瞬间穿透物料里外同时加热进行萃取的一种新技术。与传统的回流萃取、索氏萃取和超声波萃取等方法相比,具有设备简单、适用范围广、萃取率高、速度快、省时、省试剂、污染小、安全、节能等特点[11]。纤维素酶法能有效水解植物细胞壁上的纤维素,促进黄酮类物质溶出,从而提高提取率。因此采用纤维素酶解与微波萃取相结合的方法可以获得理想的效果。
本研究采用微波辅助酶法提取大叶栀子花中总黄酮,工艺处理条件较温和,通过试验得出的最佳工艺参数:酶用量为1.8%,pH为5.0,酶解温度为70 ℃,酶解时间为1.0 h,该条件下总黄酮提取率为2.16%(n=3),试验结果略高于响应面设计试验的平均水平,说明最佳工艺条件合理,提取效果较好。该研究结果可为大叶栀子花资源的合理开发利用提供参考价。
参考文献:
[1] 浙江植物志编辑委员会.浙江植物志[M].杭州:浙江科学技术出版社,1993.
[2] 付小梅,赖学文,葛 菲,等.中药栀子类药材资源调查和商品药材鉴定[J].中国野生植物资源,2002,21(5):23-25.
[3] 江国成.栀子花培育及病虫害防治措施[J].安徽农学通报,2005,11(5):68.
[4] 国家医药管理局中草药情报中心站.药物有效成分手册[M].北京:人民卫生出版社,1986.
[5] 刘艳清,汪洪武,陈敏燕,等.响应面法优化栀子總黄酮提取工艺研究[J].中药材,2014,37(2):333-337.
[6] 付 克,王书妍,夏 禹,等.栀子中黄酮类化合物的提取和含量测定[J].内蒙古民族大学学报(自然科学版),2012,27(5):530-532.
[7] 金春雪,薛灵芬,李珂昕,等.超声辅助提取栀子果总黄酮的工艺[J].光谱实验室,2013,30(6):3296-3298.
[8] 薛 梅,李炳奇,韦文珍,等.栀子中总黄酮和多糖的微波提取与含量测定[J].中国现代应用药学杂志,2006,23(5):402-404.
[9] PURI M,SHARMA D,BARROW C J. Enzyme-assisted extraction of bioactives from plants[J].Trends in Biotechnology,2012, 30(1):37-44.
[10] 许 冰,贾爱芳,赵文献.温度对酶活性的影响[J].临床合理用药,2010,3(7):28.
[11] 张 成,贾绍义.微波萃取技术及其应用[J].化学工业与工程,2004,21(6):444-447.

