盐胁迫下唐古特白刺叶片的扫描电镜观察
史婵,杨秀清,闫海冰
(山西农业大学 林学院,山西 太谷 030801)
盐胁迫下唐古特白刺叶片的扫描电镜观察
史婵,杨秀清,闫海冰*
(山西农业大学 林学院,山西 太谷 030801)
[目的]为研究唐古特白刺的耐盐碱性,[方法]采用扫描电子显微镜对不同盐分胁迫下一年生唐古特白刺实生幼苗叶片进行微观结构的观察。[结果]结果表明,在四组盐分胁迫下,白刺叶表面均有蜡质出现,且主要表现为各盐分高浓度胁迫下气孔周围蜡质增多,且叶片细胞褶皱明显。与对照相比,四组盐分胁迫下叶表皮气孔长度、宽度、面积下降,气孔密度增大。随盐分浓度的增加,碱性盐和中性盐在300 mmol·L-1胁迫下气孔开度即大幅降低,且碱性盐胁迫下降低值最大;混合盐碱和单盐胁迫下气孔开度先增加后降低,且单盐300 mmol·L-1时达最高值。[结论]研究结果表明碱性盐对白刺伤害较大,低浓度单盐有利于白刺生长,白刺幼苗可通过调节气孔开度、气孔密度及气孔周围蜡质的形成或泌盐表现出一定的耐盐特性。
盐分胁迫;叶表面;叶表皮气孔;唐古特白刺
唐古特白刺(Nitrariatangutorum)为蒺藜科(Zygophyllaceae)白刺属(NitrariaL.)落叶灌木类资源,是一种耐盐碱性极强的生态抗逆兼果肉经济型植物。白刺多生长在干燥、盐碱、多风、植被稀少的严酷环境中[1]。长期的生物演化和环境胁迫使其逐渐形成了自身特有的对逆境的生态防御机制,在形态构造上表现出特有的一些对环境变化的适应特征。研究白刺在逆境胁迫下的形态结构变化是白刺抗逆性研究的基础。气孔作为高等陆地植物表皮所特有的结构,是植物与环境气体交换的通道。植物叶片表皮上气孔的闭合、分布以及发育过程对外界环境的适应过程至关重要[2~5]。本研究采用扫描电子显微镜对不同盐分胁迫下唐古特白刺叶表面及叶表皮气孔特征变化进行了系统观察,为研究白刺的生理生态学特征、确定白刺的盐碱耐受性范围以及白刺在盐碱地土壤改良和植被恢复中的开发利用提供基础依据。
1 材料与方法
1.1 材料来源及实生苗培育
白刺种子采自内蒙古巴彦淖尔市磴口县境内乌兰布和沙漠东北部(海拔1 036 m, 40°32′N, 106°28′E)白刺产地的野生种。在山西农业大学实验苗圃(海拔800 m, 37°30′N,112°35′E)进行播种育苗。试验地深翻后,按10 cm以上表层壤土∶细沙∶腐熟牛粪 = 4∶2∶1的比例混合形成轻沙壤土,0.5% KMnO4溶液进行土壤消毒后,做低床开沟,将预先浸泡并消毒的种子进行条播。播沟深5 cm,沟间距30 cm,种子均匀播撒后,覆土并整平床面,进行播后常规管理。
1.2 盐胁迫处理及取材方法
待白刺幼苗出土长出6~8片真叶时,挑选长势较好且均匀一致的植株,直接将其根部浸于预先配置好胁迫处理液的三角瓶中进行胁迫处理。实验共设置4种盐分(中性盐NaCl∶Na2SO4(1∶1)、碱性盐NaHCO3∶Na2CO3(1∶1)、混合盐碱NaCl∶Na2SO4∶NaHCO3∶Na2CO3(1∶1∶1∶1)和单盐NaCl)以及每种盐分的4个浓度梯度,分别为200、300、400、500 mmol·L-1(4种浓度梯度下白刺株高增长比例及生物量均低于对照),处理植株共16株。待胁迫处理12 h后有植株叶片开始萎蔫,植株间有差异表现时取白刺幼苗中上部第2节完好叶片,切成适当的小段备用,同时取未胁迫处理的叶片作为对照。
1.3 扫描电镜样品的制备与观察
用蒸馏水将将取下的样品表面冲洗干净,迅速置于3%戊二醛固定液(0.1 mol·L-1, pH 7.2磷酸盐缓冲液配制)中,真空泵抽气使材料下沉后,0~4 ℃下固定2 d。用相同的磷酸缓冲液冲洗3次,系列乙醇30%、50%、70%、80%、90%、95%逐级脱水,每级15 min,100%乙醇脱水两次,每次20 min,然后叔丁醇置换,JEOL JFD-320冷冻干燥,干燥后的材料用电胶带粘在样品台上,用JEOL JFC-1600离子溅射镀膜仪喷镀铂金,喷镀好的材料放入JEOL JEM-6490 LV 扫描电子显微镜下进行形态观察、拍照并记录。
1.4 数据的统计分析
用Digital Micrograph软件测量气孔器大小,每枚叶片在显微镜下随机选取10个独立视野进行统计。
各项指标和图像数据等所有数据均为重复测定的平均值±标准差(重复次数>3)。
2 结果与分析
2.1 不同盐胁迫对白刺叶片表皮细胞的影响
白刺叶片下表皮气孔密度大于上表皮,这符合荒漠植物叶片气孔分布特征下多上少,此特征可以减弱植物的蒸腾作用,避免植物体内过多水分散失,这是荒漠植物对环境的一种适应[6]。不同盐分胁迫下,白刺叶片表皮细胞与对照相比发生不同程度的变化。由图1可以观察到白刺叶表皮有蜡质,气孔保卫细胞为肾形,表面平滑,气孔呈椭圆形,气孔外拱盖,并且内层明显。

图1 未胁迫下的叶表面Fig.1 Leaf surface without stress
由图2可以看出,在中性盐胁迫下,白刺叶片细胞褶皱,浓度达到300 mmol·L-1时,气孔周围蜡质明显增加,气孔微张。

图2 1、2、3、4表示中性盐200、300、400、500 mmol·L-1胁迫下的叶表面Fig.2 1, 2, 3, 4 indicate leaf surface under neutral salt stress of 200, 300, 400, 500 mmol·L-1
由图3可以观察到,碱性盐浓度达到500 mmol·L-1时,保卫细胞下陷。
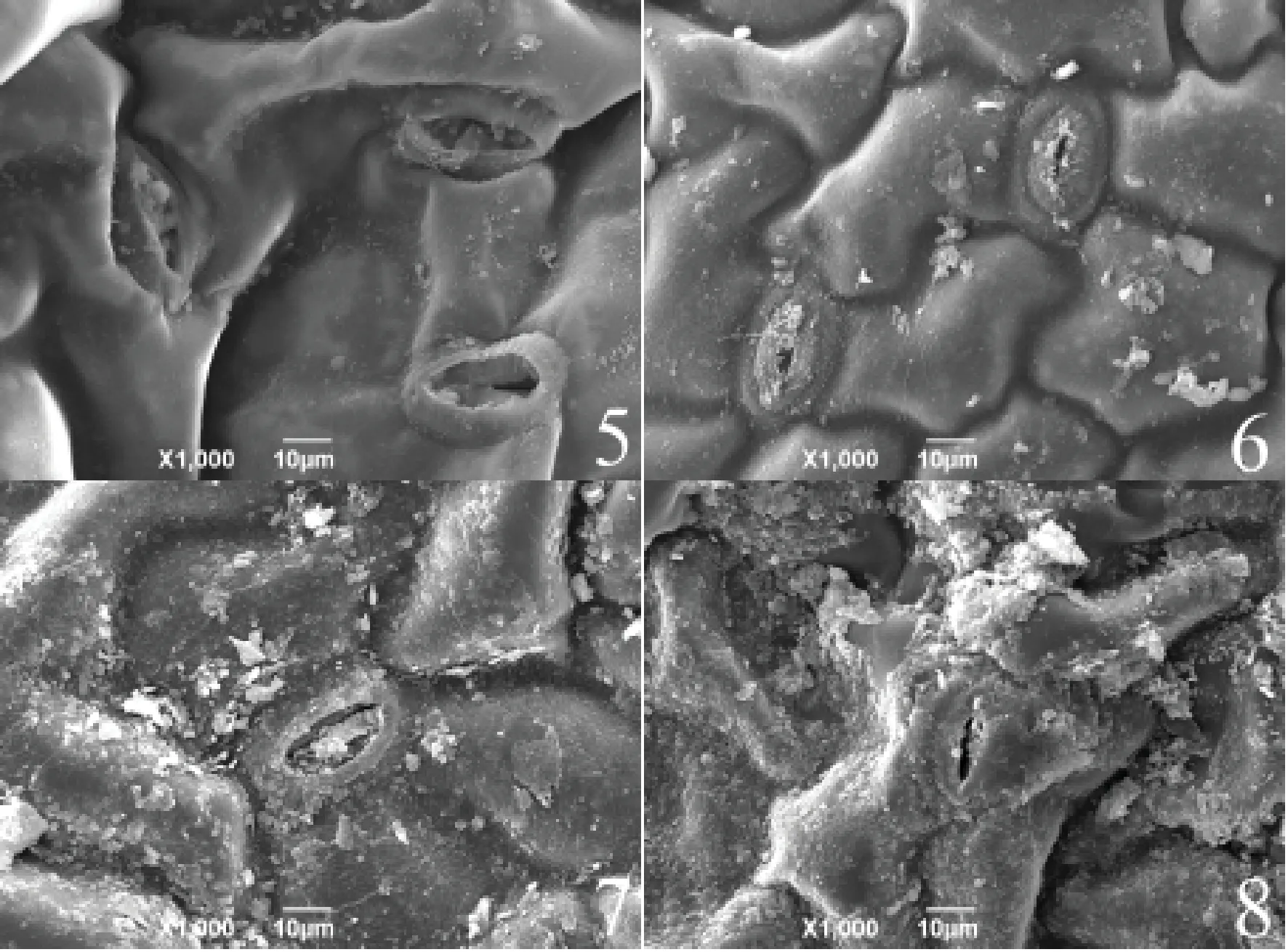
图3 5、6、7、8表示碱性盐200、300、400、500 mmol·L-1胁迫下的叶表面Fig.3 5, 6, 7, 8 indicate leaf surface under alkaline salt stress of 200, 300, 400, 500 mmol·L-1
图4可以发现,表皮细胞在混合盐碱浓度为400 mmol·L-1急剧皱缩,当浓度达到500 mmol·L-1时,气孔口被蜡质覆盖,气孔周围蜡质增多。

图4 9、10、11、12表示混合盐碱200、300、400、500 mmol·L-1胁迫下的叶表面Fig.4 9, 10, 11, 12 indicate leaf surface under mixed salt stress of 200, 300, 400, 500 mmol·L-1
在图5中可以观察到,在单盐胁迫条件下,气孔周围被蜡质覆盖,当浓度为500 mmol·L-1时,表皮细胞皱缩严重,气孔微张。
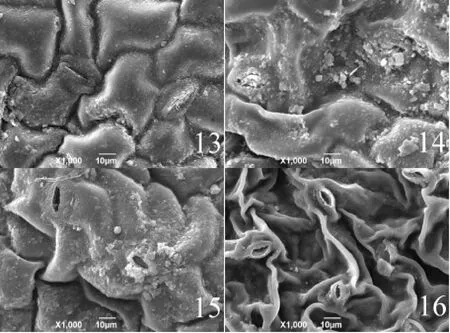
图5 13、14、15、16表示单盐200、300、400、500 mmol·L-1胁迫下的叶表面Fig.5 13, 14, 15, 16 indicate leaf surface under simple salt stress of 200, 300, 400, 500 mmol·L-1

图6 不同盐胁迫下气孔长度变化Fig.6 Stomata length change under different salt stress
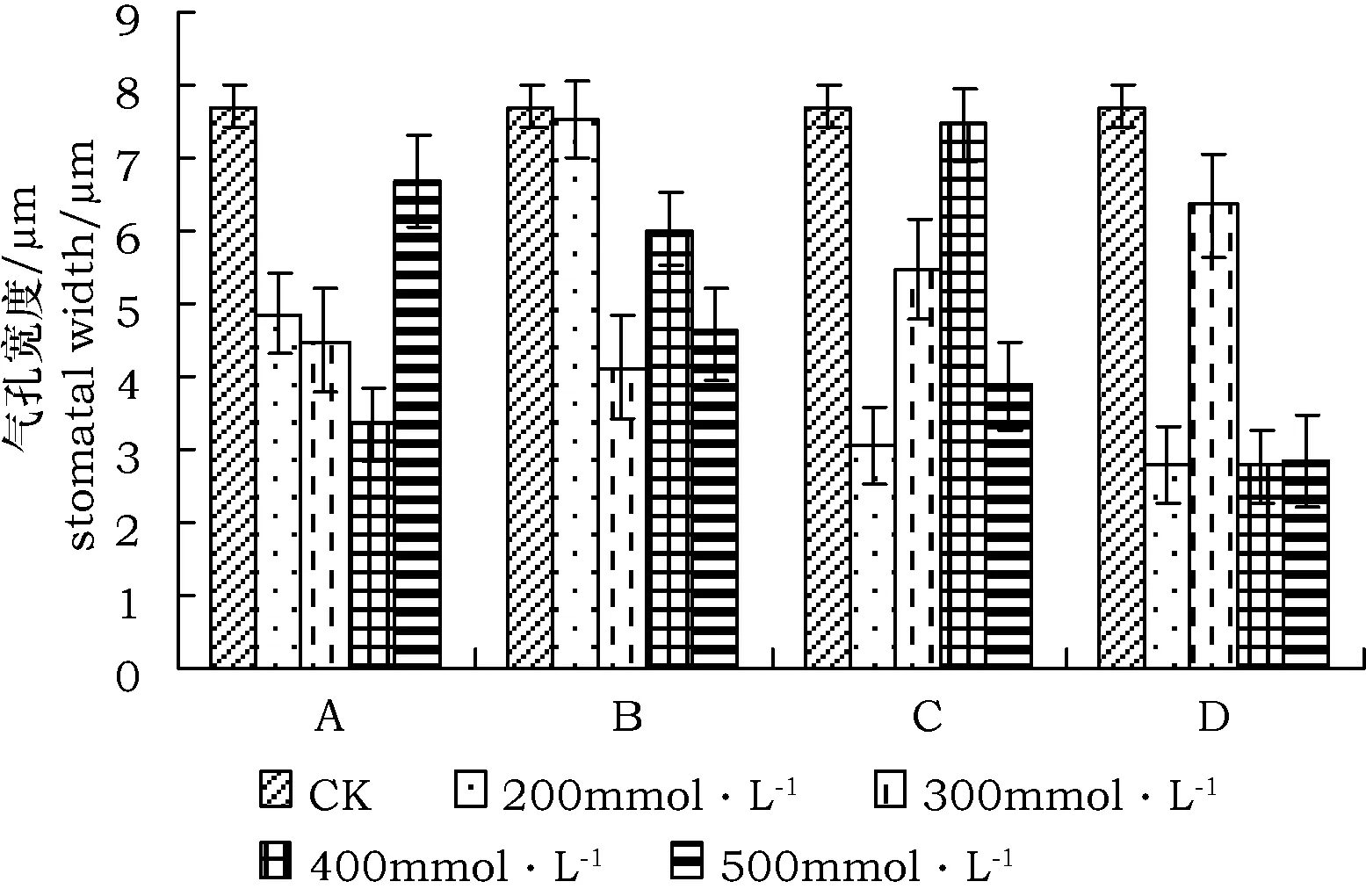
图7 不同盐胁迫下气孔宽度变化Fig.7 Stomata width change under different salt stress

图8 不同盐胁迫下气孔面积变化Fig.8 Stomatal area under the different salt stress
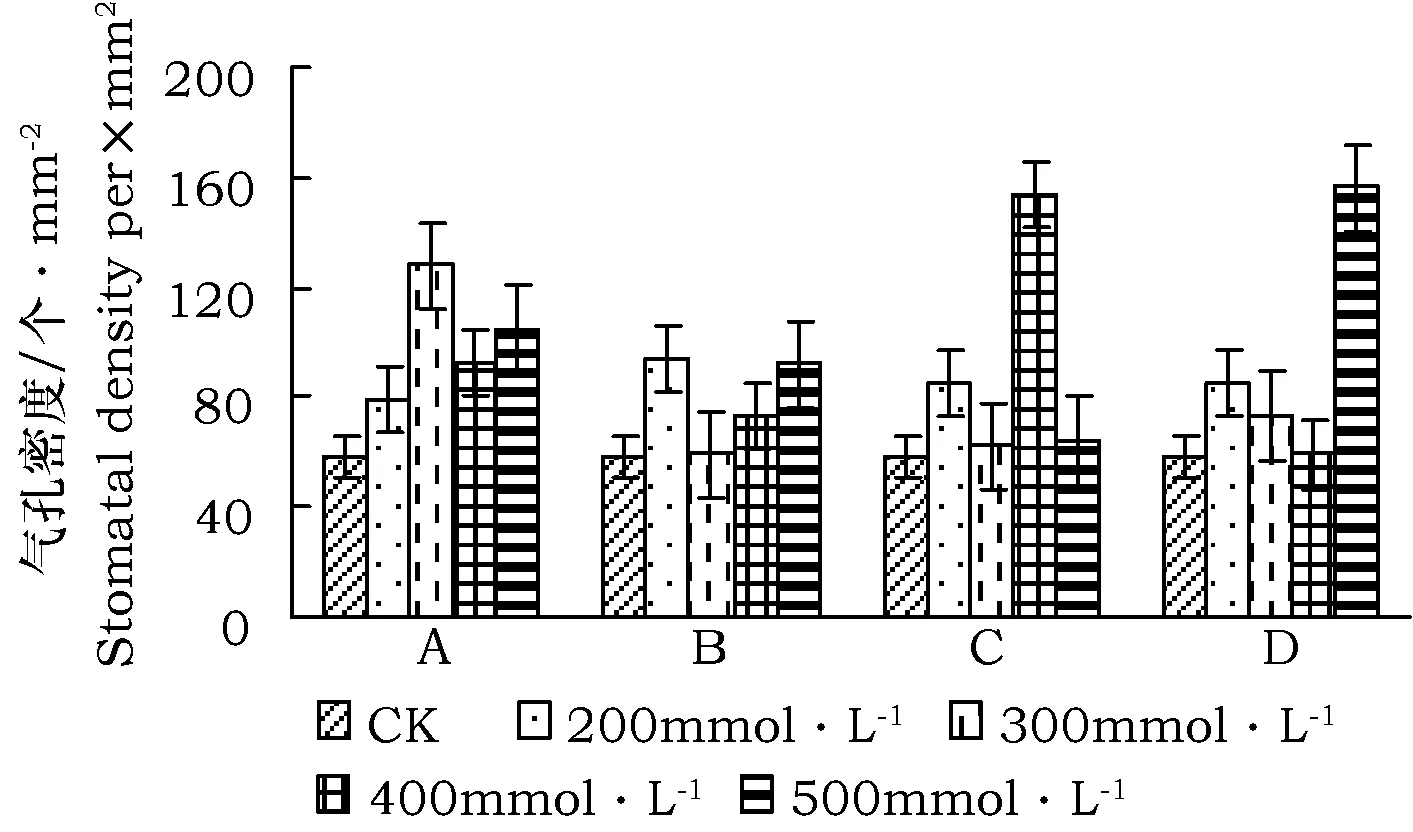
图9 不同胁迫下气孔密度变化Fig.9 Stomatal density under different stress 注:图6~图9中,A代表中性盐 NaCl∶Na2SO4(1∶1),B代表碱性盐 NaHCO3∶Na2CO3(1∶1),C代表混合盐碱 NaCl∶Na2SO4∶NaHCO3∶Na2CO3 (1∶1∶1∶1),D 代表单盐NaClNote: In Fig.6~Fig.9, A indicate neutral salt stress NaCl∶Na2SO4(1∶1), B indicates alkalic salt stress NaHCO3∶Na2CO3(1∶1),C indicates salt-alkaline mixed stress NaCl∶Na2SO4∶NaHCO3∶Na2CO3 (1∶1∶1∶1), D indicates simple salt stress NaCl
2.2 不同盐分胁迫下气孔长度、宽度及面积的变化
由图6~图8可见,白刺叶面气孔的长度、宽度、面积变化相似,均低于对照。其中,中性盐NaCl∶Na2SO4(1∶1)胁迫下,随着盐分浓度升高,白刺叶片气孔长度、宽度及气孔面积呈降低趋势,仅在500 mmol·L-1时表现出骤增;碱性盐NaHCO3∶Na2CO3(1∶1)胁迫下,上述3指标随盐分浓度升高整体呈下降趋势,且在300 mmol·L-1胁迫下即呈现最大幅度降低值;混合盐碱NaCl∶Na2SO4∶NaHCO3∶Na2CO3(1∶1∶1∶1)胁迫下,气孔长度在300 mmol·L-1时达最高值,气孔宽度和气孔面积在400 mmol·L-1达到最高值,之后各指标均呈下降趋势;单盐NaCl胁迫下,气孔长度、宽度及面积均在300 mmol·L-1时达到最高值,之后各指标呈下降趋势。
2.3 不同盐分胁迫下气孔密度的变化
图9结果表明,不同盐分胁迫下叶片气孔密度均高于对照。中性盐浓度为300 mmol·L-1时,气孔密度最大为128个·mm-2,之后密度变化趋势下降,当浓度达到400 mmol·L-1时密度变化趋势又缓慢升高。在碱性盐胁迫条件下,随盐分浓度增大气孔密度先上升后下降再上升趋势,且在300 mmol·L-1胁迫下密度呈最低值 (为57个·mm-2)。在混合碱胁迫下气孔密度先降低,在300 mmol·L-1时密度最小,在400 mmol·L-1时密度最大。单盐胁迫条件下,气孔密度在500 mmol·L-1胁迫浓度时达最大。
3 讨论
3.1 不同盐分胁迫下白刺叶表面结构特征
植物对环境的变化都有一定的响应能力和自我调节机制,能够通过自身的形态变化和生理生化反应来适应不断变化的环境[6]。白刺在不同盐分胁迫处理下,叶表面均有蜡质出现,且主要表现为各盐分高浓度胁迫下蜡质增多。叶表面上存在的蜡质这种形态结构特征可以解释为对水分需求的平衡,由于蜡质具有保水作用可减少非气孔的蒸腾作用[7],这与成铁龙的研究结果类似[8],而且有研究表明叶表面的蜡质可能具有一定的泌盐能力[9]。
3.2 逆境下白刺气孔器特征
植物叶表面的气孔是叶片与外界环境进行气体、水分交换的主要通道,对植物的光合、呼吸、蒸腾等生理活动起着重要的调节作用,盐胁迫引起气孔特性改变[10~14]。白刺叶片气孔长宽与气孔活动密切相关,保卫细胞之间距离增加,气孔开度大,反之保卫细胞距离缩短,气孔开度变小甚至关闭。在中性盐胁迫下,气孔长宽变化均为先降低后增加,这表明中性盐浓度的升高导致气孔开度降低,是植物通过降低气孔开度以减少蒸腾作用,缓解水分缺失。浓度达到500 mmol·L-1时气孔开度增大说明白刺具有耐盐性,可能通过蜡质向外泌盐或其他方式将盐分排出体外。在碱性盐胁迫下,白刺叶片气孔开度在300 mmol·L-1时即大幅下降,这表明碱性盐在低浓度即对白刺叶片细胞伤害严重,但同时也表明白刺在高浓度碱性盐胁迫下仍具有调节能力,具有缓解高浓度下植物细胞水分亏缺的能力。在混合盐碱盐胁迫下,气孔闭塞,有些气孔皱缩变形,气孔口有丝状物质出现,这可能是混合盐碱胁迫影响气孔生理功能。在单盐胁迫下,气孔开度在300 mmol·L-1时最大,这表明在单盐浓度300 mmol·L-1范围内,白刺的耐盐性最强,随着浓度的升高,叶表面严重皱缩但是气孔仍张开,这表明在单盐下虽然植物失水,但仍然具有很强的调节自身渗透势的能力。
不同盐分胁迫下气孔密度均高于对照,这可能是由于盐胁迫造成叶片萎蔫,导致所测单位气孔数量增加,密度增加,这与李伟的研究结果相同[15]。
4 结论
(1)扫描电镜下不同盐分胁迫处理后白刺叶表面特征表现为:叶表面均有蜡质出现,且主要表现为各盐分高浓度胁迫下气孔周围蜡质增多,且叶片细胞褶皱明显。
(2)与对照相比,4组盐分胁迫下叶表皮气孔长度、宽度、面积下降,气孔密度增大。随盐分浓度的增加,碱性盐和中性盐在300 mmol·L-1胁迫下气孔开度即大幅降低,且碱性盐胁迫下降低值最大;混合盐碱和单盐胁迫下气孔开度先增加后降低,且单盐300 mmol·L-1时达最高值。
(3)综合研究表明,研究中4种盐分随胁迫浓度的变化对白刺表皮细胞造成不同程度的伤害。碱性盐对白刺伤害较大,低浓度单盐有利于白刺生长,白刺幼苗可通过调节气孔开度、气孔密度及气孔周围蜡质的形成或泌盐表现出一定的耐盐特性。
[1]王彦阁,杨晓晖,于春堂,等.白刺属植物现状、生态功能及保护策略[J].水土保持研究,2007,14(3):74-79.
[2]Jeffrey Leaung,Jerome Giraudat. Abscisic Acid Signal Transduction [J].Annual Review Plant Physiology Plant Molecular Biology,1998,49:199-222.
[3]Alistair M Hetherington, Flan Woodward. The role of stomata in sensing and driving environmental change[J].Nature,2003,424:901-908.
[4]王碧霞,曾永海,王大勇,等.叶片气孔分布及生理特征对环境胁迫的响应[J].干旱地区农业研究,2010,28(2):122-126.
[5]杨慧敏,王根轩.干旱和CO2浓度升高对干旱区小麦气孔密度及分布的影响[J].植物生态学报,2001,25(3):312-316.
[6]任昱,卢琦,吴波,等.白刺叶片气孔特征对人工模拟降雨的响应[J].生态学报,2014,34(21):6101-6106.
[7]顾俊,王飞,张鹏,等.植物叶表皮蜡质的生物学功能[J].江苏农业学报,2007,23(2):144-148.
[8]成铁龙.中国白刺属微观结构与分子系统研究[D].北京:中国林业科学研究院.2010.
[9]韦存虚,王建波,陈义芳,等.盐生植物星星草叶表皮具有泌盐功能的蜡质层[J].生态学报,2004,24(11):2451-2456.
[10]赵姝丽,陈温福,马殿荣,等.盐胁迫对水稻叶片气孔特性的影响[J].垦殖与稻作,2006,6:26-29.
[11]左凤月.盐胁迫对3种白刺生长、生理生化及解剖结构的影响[D].成都:西南大学,2013.
[12]王鑫.盐胁迫下高粱新生叶片结构和光合特性的系统调控研究[D].泰安:山东农业大学.2010.
[13]唐佳红.盐碱胁迫对燕麦幼苗不同叶位叶片生长与生理代谢的影响[D].长春:东北师范大学.2014.
[14]王素平,李娟,郭世荣,等.NaCl胁迫对黄瓜幼苗植株生长和光合特性的影响[J].西北植物学报,2006,26(3):455-461.
[15]李伟.盐胁迫下拟南芥和盐芥显微及超微结构的比较研究[D].哈尔滨:东北林业大学,2014.
(编辑:梁文俊)
Microscopic structure of leaves inNitrariatangutorumunder salinity stress
Shi Chan, Yang Xiuqing, Yan Haibing*
(CollegeofForesty,ShanxiAgriculturalUniversity,Taigu030801,China)
[Objective]For the purpose to gain insight into the salinity tolerance ofNitrariatangutorum.[Methods]We used scanning electron microscope to observe microscopic structure of leaves in annualNitrariatangutorumseedlings, which were under different salt stress.[Results]The results indicated that all the leaf surface of white thorn under different salt stresses had wax, the higher salt concentration, the more wax behind stomata, and the more obviously blade cell folding. Compared with control, the length, width and area of stomata located on the leaf blade surface were decreased, but the stoma density was increased. With the increasing of salt stress concentration, stoma aperture reduces by huge amounts, even starting at 300 mmol·L-1stress of alkaline and neutral salinity, and the reduction value under alkaline salinity stress was significant. Stoma aperture increased firstly and then decreased under mixed and single salinity stress, and peaked at 300 mmol·L-1stress of single salinity.[Conclusion]Our research indicated that the alkaline salt damaged white thorn more strongly than other salt stress. The single salt with low concentration benefited the growth of white thorn. White thorn performs salinity tolerance characterized by adjusting stoma aperture and density, forming wax which surrounded the stomata or salt secretion.
Salinity stress, Leaves blade, Leaves blade stoma,Natrariatangutorum
2016-05-13
2016-09-28
史婵(1993-),女(汉),河北石家庄人,硕士研究生,研究方向:森林培育
*通信作者:闫海冰,副教授,硕士生导师。Tel: 0354-6288263;E-mail: yhb5188@126.com
国家自然科学基金项目(31470631);山西省自然科学基金项目(2013011030-3)
S718.5
A
1671-8151(2017)01-0035-05

