17β雌二醇刺激农田土壤微生物群落结构变化PCR-DGGE指纹分析
田 琳, 张 珣(沈阳大学 a. 环境学院; b. 区域污染环境生态修复教育部重点实验室, 辽宁 沈阳 110044)
17β雌二醇刺激农田土壤微生物群落结构变化PCR-DGGE指纹分析
田 琳a,b, 张 珣a,b
(沈阳大学 a. 环境学院; b. 区域污染环境生态修复教育部重点实验室, 辽宁 沈阳 110044)
采用PCR-DGGE技术分析在不同的质量分数和暴露时间下17β雌二醇刺激农田土壤微生物群落结构变化.结果表明,在暴露期间内,有部分细菌的生长受到抑制.部分细菌的数量随着雌二醇浓度或暴露时间的增加而减少,而部分细菌则在雌二醇的影响下被富集,表现在DGGE 条带由浅变深.雌二醇污染的农田土壤样品中微生物群落结构发生巨大的变化, 200 ng/kg雌二醇刺激下的农田土壤样品中微生物群落多样性指数明显大于另外两组;100 ng/kg雌二醇刺激下农田土壤的微生物多样性指数随着暴露时间的增加呈下降趋势;300 ng/kg实验组多样性指数则变现为相似的平缓增长趋势.研究发现,适宜质量分数的雌二醇能够增加农田土壤微生物群落结构的多样性.
17β雌二醇; 农田土壤; 微生物群落结构; PCR-DGGE
环境雌激素,又称为“内分泌干扰物”,由于其在环境中具有危害性、持久性、生物蓄积性和易远距离迁移的特性,在2002年签署的《关于持久性有机污染物的斯德哥尔摩公约》中,第一次颁布了关于12种持久性有机污染物的禁令,其中的环境激素类物质也明令禁止使用.雌二醇,一般是指雌二醇的17-β-异构体,类固醇基团和羟基分别位于芳香环的C18和3-β-、17-β-位置.雌二醇是天然类固醇雌激素中雌激素活性最大的物质.研究表明,17β-雌二醇是内分泌失调的一个公认的指标,废水痕量的情况下它就可以使雄鱼产生卵黄蛋白原,此雌二醇是指天然雌激素而非具有雌激素活性的化学工业合成物质[1].
环境雌二醇有两个重要的来源:污水处理厂和禽畜养殖场[2-3].雌二醇可以通过市政污泥、畜禽粪便或家禽粪便施肥转移进入农田土壤.目前已发现,垃圾中雌二醇的质量分数范围在14~904 μg/kg干重[4-5].污水处理厂中排放的雌二醇被认为负责或促进一些野生鱼类出现的女性化应答[6-7].质量浓度在10~100 ng/L的雌二醇会影响鳟鱼的正常发展[8].研究发现,河水中E2的质量浓度范围为0.1~0.57 pg/mL,人体尿液中E2的质量浓度范围为0.75~135 μg/mL[9].
中国是一个经济快速增长的国家,拥有丰富的人口和动物,每天都会有大量的天然雌激素排放到环境中,应该更加注重雌激素污染.2007年中国的天然类固醇雌激素的总排放量大约高达10.6 t[10].研究人员于2007年6月在天津地区的北塘河、大沽河和永定新河中采集水样,经检测发现水样中17β-雌二醇的质量浓度分别在2.51~21.2、0.93~32.4和最高值检测到13.6 ng/L,平均质量浓度分别为8.69、10.3和7.26 ng/L[11].
研究人员发现在E2质量浓度低至1 ng/L时雄鱼就会产生卵黄蛋白原 (VTG)[12-13].研究人员在悉尼马拉巴尔的一个大型沿海一级污水处理厂的排放点附近采集海洋表层土壤样本,经检测发现其雌二醇的质量分数在0.22~2.48 ng/g之间[14].阿肯色州喀斯特地貌覆盖下的含水层中的5个温泉水中雌二醇质量浓度在6~66 ng/L[15].研究发现雌二醇可以损害剑尾鱼的睾丸和肝组织,且暴露时间越长,损害越严重[16].
17β-雌二醇可以通过食物链在生态系统中富集,最终累积于机体内的脂肪组织中,以形成一个长期毒性作用.位于意大利北部的马焦雷湖和加尔达湖中的凤头鸊鷉 (Podiceps critatus)蛋液经检测发现含有雌二醇,且雌二醇的平均质量分数分别为 2.70和4.36 ng/g干重[17].雌二醇的代谢产物具有遗传毒性,并促进乳腺癌的发展[18].研究表明,17β-雌二醇与男性生殖系统紊乱和精子数减少、睾丸癌、 前列腺癌和乳腺癌的发病率的增加有直接关系[19].
本项实验中,从浓度和暴露时间方面探讨雌二醇对农田土壤中微生物群落结构变化的影响.PCR技术利用细菌中进化保守区域内特定引物扩增农田土壤微生物群落的目标16S rDNA 基因,DGGE指纹技术分析PCR扩增产物的多样性.
1 材料与方法
1.1 土壤前处理
土壤样本采自于沈阳农业大学水稻试验田土壤.该土壤常年种植水稻,并未施用畜禽粪便或者污水.农田土壤样本过2 mm筛子以去除石粒、植物残体和动物残骸.农田土壤样品中有机质含量和总氮含量分别用K2Cr2O4和消化蒸馏的标准方法进行测定[20].使用原子吸收分光光度计测定农田土壤样品中速效K和有效P的含量[21].农田土壤样品的pH值由PHS-3C pH计在土壤与水溶液比为1 g土壤加2.5 mL水的水悬浮液中测得.表1列出了农田土壤样品的一些物理和化学性质.

表1 农田土壤样品的主要理化性质Table 1 Main physical and chemical properties of agricultural soil samples
1.2 试验设计
本实验的主要装置为塑料盒,其长度、宽度和高度分别为490、350和160 mm.将15 kg的农田土壤装入塑料盒,500 mL不同浓度的雌二醇溶液分别加入到各塑料盒中,最后使得各装置的终质量分数分别为100、200和300 ng/kg,室温培养.通过搅拌器使各溶液与农田土壤样品混合,以确保所有的农田土壤样品充分混合.每个塑料盒每次收集20 mg再次充分混合的土壤样品,重复三次,暴露时间分别为0、5、10、15、20、25、30、35、40、45、50、55和60 d.将样品保存在-80 ℃用于分子生物学分析.
1.3 土壤中DNA提取与PCR-DGGE分析
本实验使用E.Z.N.ATM Soil DNA Kit试剂盒(美国OMEGA公司)提取农田土壤样品中的总DNA,用琼脂糖凝胶(按1 g琼脂糖粉与100 mL TAE缓冲液配制)电泳检测其提取结果[22].总DNA保存于-20 ℃冰箱中.
PCR的扩增区域是细菌16S rDNA的V3可变区,选用引物对338F和518R.选用的上游引物P1(5’端连接GC夹)为GC-338F(5’-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGGG CCT ACG GGA GGC AGC AG-3’)和下游引物P2为518R(5’-ATT ACC GCG GCT GCT GG-3’)[23],直接对总DNA进行PCR扩增.PCR反应体系为:模板DNA 0.1 μL,引物P1和P2各0.75 μL,2×GoTaq buffer25 μL, 无核酸酶水23.4 μL.PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,65 ℃退火1 min(每个循环降低1 ℃),72 ℃延伸1 min,一共10个循环;然后94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,35个循环;最后72 ℃延伸10 min.PCR扩增产物用琼脂糖凝胶(按2 g琼脂糖粉与100 mL TAE缓冲液配制)电泳进行验证.所有的PCR产物约240 bp,可进行DGGE分析.
DGGE实验按照Webster等方法进行并适当修改[24].PCR 产物分离使用 DCodeTM 通用突变检测系统(Bio-Rad,Dcode,USA.)进行DGGE电泳分析.DGGE电泳聚丙烯酰胺凝胶(按8 g聚丙烯酰胺与100 mL TAE缓冲液配制),变性剂梯度为35%~65%.电泳电压为150 V,电泳温度为60 ℃,缓冲体系是1×TAE缓冲液,电泳时间为7.5 h.电泳后,将凝胶用EB(溴化乙锭)染色30 min并在紫外光下观察.为获得清晰的图像,将使用凝胶照片系统(GelDoc,Bio-Rad,USA.)进行拍照.
1.4 DGGE图谱分析
使用Quantity one图像分析软件对DGGE图谱进行分析(4.0版本,Bio-Rad,USA.).该软件能够识别同一个凝胶不同泳道上占据相同位置的条带.两个样本的相似性可以通过戴斯系数(Cs)条带模式进行估测(式(1)):
其中,j为两条DGGE泳道中共有的条带数,a和b分别为两条DGGE泳道各自的条带数量.用非加权平均法(UPGMA)检验农田土壤样品的相似性.
基于DGGE条带数据而进行的香农-威纳指数(H′),丰富度(S)和均匀度(E)的计算比较了细菌多样性的变化.H′计算公式如下(式(2)):
pi为指i条带出现在一条泳道中的概率;S为一条凝胶泳道的总条带数;E计算方法为H′/lnS.
2 结果与讨论
2.1 雌二醇对微生物群落结构的影响
雌二醇质量分数为100、200、300 ng/ kg时各个不同的时间段的细菌的16S rDNA基因的PCR产物DGGE电泳图谱如图1,暴露时间分别为0、5、10、15、20、25、30、35、40、45、50、55和60 d.在分离图谱中,每个可以区分的条带都代表一个独立的细菌种群[25].如图1所示,雌激素刺激农田土壤样品中某些细菌种群的生长.例如,条带1到条带3在DGGE凝胶图谱中的颜色由背景色变成所有土壤样本中的深色.在雌二醇质量分数为200 ng/kg的DGGE凝胶图谱中,条带5和条带6变为农田土壤样品条带中的深色条带.然而,当雌二醇质量分数为300 ng/kg时,对微生物种群的危害性加大.条带4和条带8在暴露前期被促进生长,但随着暴露时间的增长,在暴露的后期其生长受到抑制.条带7是雌二醇质量分数为300 ng/kg的农田土壤样品暴露后期出现的.
2.2 相似性分析
图2是不同雌二醇浓度下不同暴露时间的农田土壤样本与原始土壤样本的戴斯系数.与初始农田土壤样品相比,在第一个5 d内,由于刚加入17β-雌二醇,土壤微生物群落原始平衡被破坏,雌二醇质量分数为100 ng/kg的土壤样本的戴斯系数下降了60.1%,为200 ng/kg的土壤样本的戴斯系数下降了52.8%,为300 ng/kg的土壤样本的戴斯系数下降了43.1%.为200 ng/kg的农田土壤样本在第一个5 d之后,随着暴露时间的增加,戴斯系数的变化很大.暴露时间为40 d时,雌二醇质量分数为200 ng/kg的农田土样的戴斯系数仅为32.2%.暴露时间为25 d时,雌二醇质量分数为100 ng/kg的农田土壤样品的戴斯系数与初始样品只有29.9%的相似性.随着暴露时间的增长,不同质量分数下土壤样品的戴斯系数均表现出下降趋势,200 ng/kg的农田土样其戴斯系数下降趋势最迅速.不同雌激素质量分数的农田土壤样品,其系统进化树图谱有着显著差异(图3).图中1~13号分别代表暴露时间为0~60 d.在雌二醇刺激的农田土壤样品中微生物群落结构表现出很大程度的变化,特别是雌二醇质量分数为300 ng/kg的农田土壤样品.结果表明,雌二醇质量分数越高,对微生物种群的影响越深,种群的亲缘关系也就越复杂.雌二醇质量分数为300 ng/kg农田土样的微生物群落分布呈现出一个复杂的遗传相似性,这可能与高浓度的雌激素有关,又或者受到次级代谢产物的影响.雌二醇可以在转变为雌酮、雌三醇以及在微生物作用下转变为结合态的E2-3G和E1-3G(G是葡萄糖苷酸),作为次级代谢物,这些物质对原有的土壤微生物种群可能产生不同程度的胁迫作用.在次级代谢产物的选择作用下,一些微生物种群生长受到抑制,而一些微生物种群则发生改变,进而存活下来.
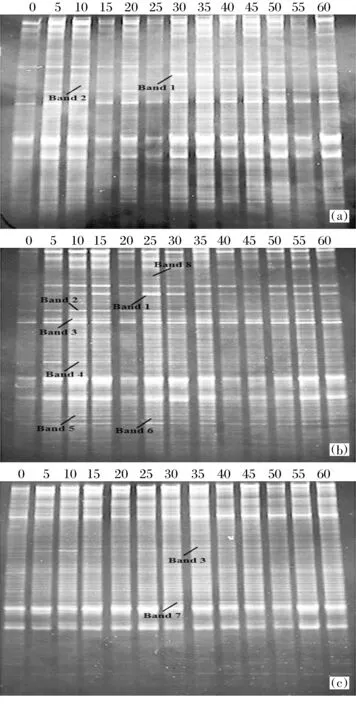
图1 农田土壤在不同雌二醇质量分数不同暴露时间细菌16S rDNA的DGGE分析Fig.1 DGGE analysis of bacterial 16S rDNA genes from agricultural soil samples with different mass fraction of estradiol at different culture times
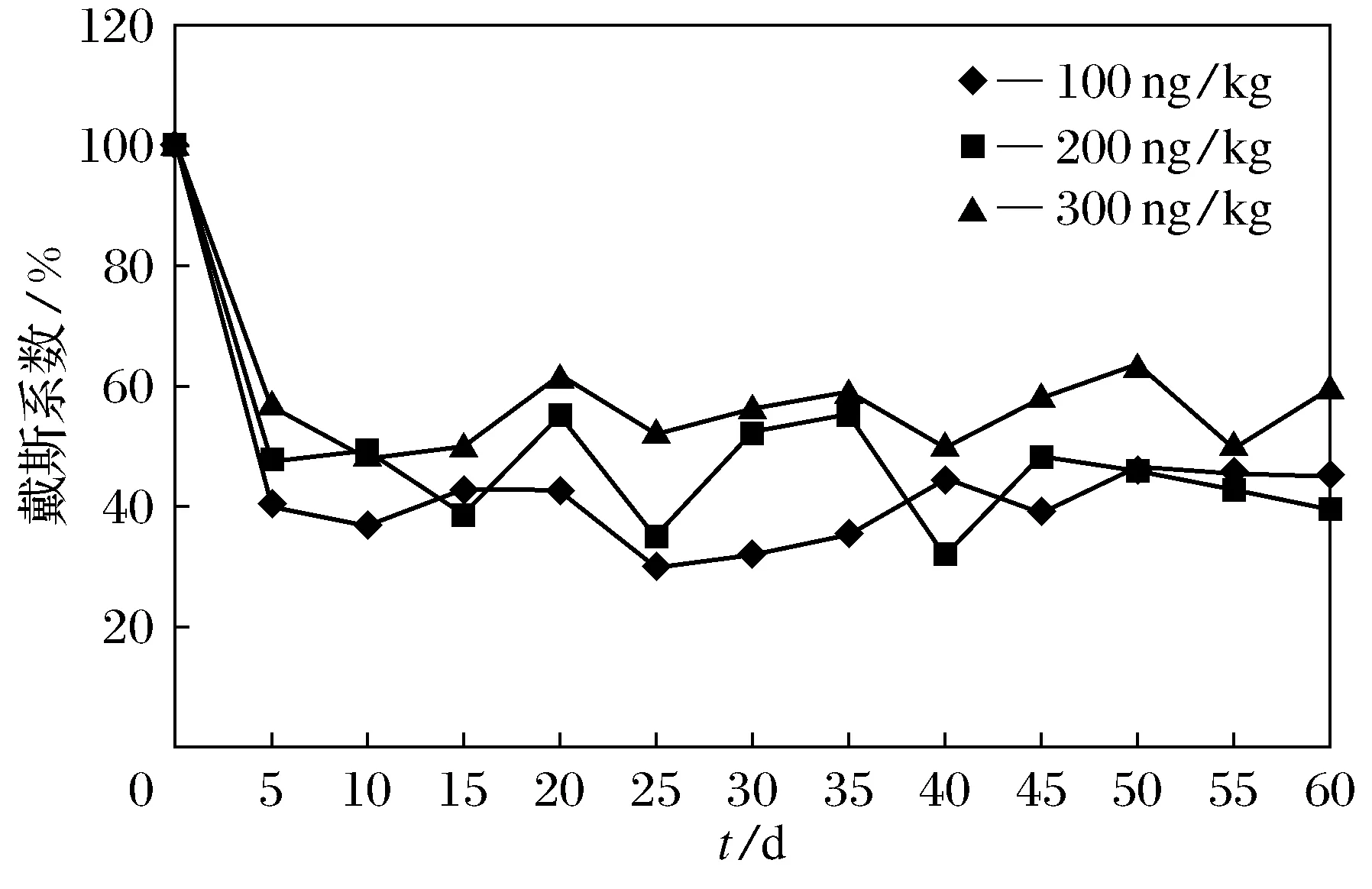
图2 不同雌二醇质量分数不同暴露时间下农田土样微生物群落的戴斯系数Fig.2 Dice coefficient of microbial communities for agricultural soil samples with different mass fraction of estradiol at different exposure duration
2.3 多样性分析
多样性指数能够有效的表征微生物群落结构的多样性.香农-维纳指数越高,微生物群落的多样性越大.除香农-维纳指数外,丰富度和均匀度也是多样性指数表征的重要参数:物种的总数即物种丰富度(S),不同物种个体数量的分布即物种均匀度(E).
雌二醇污染农田土壤样本中微生物群落的多样性指数如表2所示.在暴露前,原农田土壤的H′在3.419~3.420,S在39~40,E在0.901~0.902.在污染之前, 农田土壤系统具有稳定的微生物群落结构和活性,同时具有基本的同质性.雌二醇质量分数为100 ng/kg时农田土壤多样性在暴露前期明显高于200和300 ng/kg时的多样性,但雌二醇质量分数为100 ng/kg的农田土壤的多样性随着暴露时间的增加总体呈下降趋势.而雌二醇质量分数为200和300 ng/kg的农田土壤的多样性随着时间的推移有类似的变化趋势,总体趋势在逐步增长.纵向对比暴露时间,暴露第一个5 d后,其多样性指数都开始增加.雌二醇质量分数为200 ng/kg在第45 d时,其多样性指数、丰度、均匀度都达到最大.雌二醇质量分数为100 ng/kg时,土壤在第10 d与第35 d时其多样性指数与丰度相近,但是第35 d的均匀度高于第10 d时,说明此时微生物群落相比前期稳定.在暴露前55 d,质量分数为300 ng/kg的土壤其多样性指数、丰度、 均匀度都低于100和200 ng/kg雌二醇时的值,说明在暴露前55 d高质量分数雌二醇对微生物群落多样性的影响高于低质量分数雌二醇.暴露60 d时其多样性指数与丰富度都达到最大值,造成该现象的原因可能是,出现可以有效抗雌二醇、降解雌二醇或同时可以降解次生代谢产物的新物种,极大地丰富了雌二醇污染农田土壤的微环境.横向对比不同E2浓度发现,质量分数为200 ng/kg的农田土壤中微生物群落多样性指数明显大于另外两组.这表明,在一定范围内,微生物群落多样性随着雌二醇质量分数的增加而增大,超过一定值其多样性则会受到抑制,而随着时间的推移,新适应性物种的出现则会打破这种抑制作用.结果还表明,抗雌二醇和可以有效降解雌二醇的新物种可以在雌二醇污染土壤中富集.随着暴露时间的增加,一些微生物物种数迅速增加,同时有一些有物种被抑制.雌二醇可以在转变为雌酮、雌三醇以及在微生物作用下转变为结合态的E2-3G和E1-3G(G是葡萄糖苷酸),这种相互转变也会给微生物菌群多样性带来更加复杂的变化,原有优势种可能在这种雌激素的互相转变过程中逐渐被抑制.
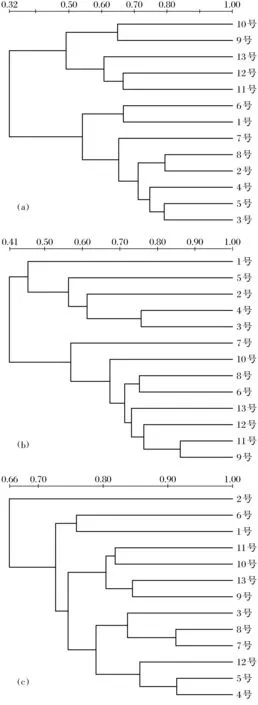
图3 不同雌二醇质量分数不同暴露时间农田土样的系统发育进化树Fig.3 System developmental evolutionary tree for agricultural soil samples with different mass fraction of estradiol at different exposure duration
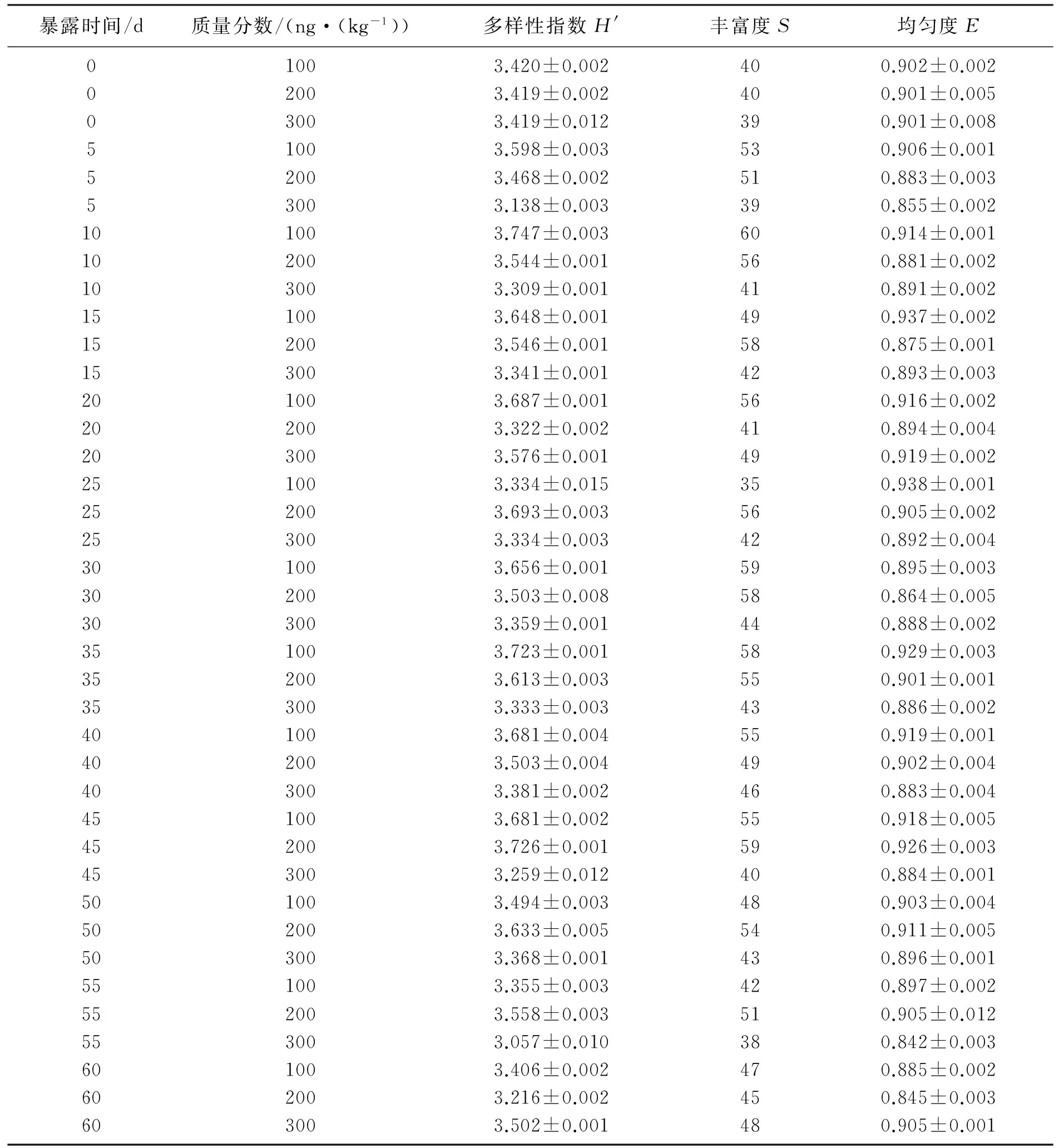
表2 不同雌二醇质量分数刺激农田土壤的微生物群落多样性指数Table 2 Diversity indices of microbial communities in groups with different mass fraction of estradiol
3 结 论
PCR-DGGE指纹技术可以有效分析雌二醇污染农田土壤样品中的微生物群落结构的动态变化.雌二醇质量分数和暴露时间的变化能够对微生物的活性和功能产生影响,进而造成微生物群落变化.
(1) 经戴斯系数与系统进化树图谱分析可知,雌二醇质量分数越高,对微生物种群的影响越深,种群的亲缘关系也就越复杂.
(2) 经不同暴露时间与不同雌二醇质量分数微生物群落多样性指数对比分析可知,在一定质量分数范围内,微生物群落多样性随着雌二醇质量分数的增加而增大,超过某一质量分数值其多样性则会受到抑制,而随着暴露时间的推移,新适应性物种的出现则会打破这种抑制作用.
(3) 雌二醇可以转变为雌酮、雌三醇以及结合态的E2-3G和E1-3G,这种相互转变也会给微生物菌群多样性带来更加复杂的变化.
[1] GEYER H J,RIMKUS G G,SCHEUNERT I,et al. Bioaccumulation and occurrence of endocrine-disrupting chemicals (EDCs), persistent organic pollutants (POPs), and other organic compounds in fish and other organisms including humans[M]∥Bioaccumulation-New Aspects and Developments. Berlin: Springer, 2000:1-166.
[2] KIRK L A,TYLER C R,LYE C M,et al. Changes in estrogenic and androgenic activities at different stages of treatment in wastewater treatment works[J]. Environmental Toxicology & Chemistry, 2002,21(5):972-979.
[3] LINTELMANN J,KATAYAMA A,KURIHARA N,et al. Endocrine disruptors in the environment (IUPAC Technical Report)[J]. Pure & Applied Chemistry, 2009,75(5):631-681.
[4] HANSELMAN T A,GRAETZ D A,WILKIE A C. Manure-borne estrogens as potential environmental contaminants:A review[J]. Environmental Science & Technology, 2004,37(24):5471-5478.
[5] SHORE L S,HAREL-MARKOWITZ E,GUREVICH M,et al. Factors affecting the concentration of testosterone in poultry litter[J]. Journal of Environmental Science & Health, Part A Environmental Science & Engineering & Toxic & Hazardous Substance Control, 1993,28(8):1737-1749.
[6] JOBLING S,NOLAN M,TYLER C R,et al. Widespread sexual disruption in wild fish[J]. Environmental Science & Technology, 1998,32(17):2498-2506.
[7] JOBLING S,BERESFORD N,NOLAN M,et al. Altered sexual maturation and gamete production in wild roach (Rutilusrutilus) living in rivers that receive treated sewage effluents[J]. Biology of Reproduction, 2002,66(2):272-281.
[8] TYLER C,ROUTLEDGE E. Oestrogenic effects in fish in English rivers with evidence of their causation[J]. Pure & Applied Chemistry, 1998,70(9):1795-1804.
[9] WEI H B,LIN J M,WU D N,et al. Detection of 17 β -estradiol in river water and human urine by highly sensitive chemiluminescence enzyme immunoassay[J]. Chinese Journal of Analytical Chemistry, 2007,35(3):319-324.
[10] 李本纲,崔司宇. 中国天然雌激素排放清单和风险评价[J]. 城市环境与城市生态, 2011,24(4):24-28. (LI B G,CUI S Y. Emission inventory and risk assessment of environmental estrogens in China[J]. Urban Environment & Urban Ecology, 2011,24(4):24-28.)
[11] LEI B L,HUANG S B,ZHOU Y Q,et al. Levels of six estrogens in water and sediment from three rivers in Tianjin area, China[J]. Chemosphere, 2009,76(1):36-42.
[12] HANSEN P D,DIZER H,HOCK B,et al. Vitellogenin: A biomarker for endocrine disruptors[J]. TrAC Trends in Analytical Chemistry, 1998,17(7):448-451.
[13] DORABAWILA N,GUPTA G. Endocrine disrupter-estradiol-in Chesapeake Bay tributaries[J]. Journal of Hazardous Materials, 2005,120(1/2/3):67-71.
[14] BRAGA O,SMYTHE G A,SCHFER A I,et al. Steroid estrogens in ocean sediments[J]. Chemosphere, 2005,61(6):827-833.
[15] PETERSON E W,DAVIS R K,ORNDORFF H A. 17 β-estradiol as an indicator of animal waste contamination in mantled karst aquifers[J]. Journal of Environmental Quality, 2000,29(3):826-834.
[16] 温茹淑,钟燕婷, 方展强,等. 17β-雌二醇对雄性剑尾鱼精巢和肝发育的影响[J]. 动物学杂志, 2013,48(2):174-181. (WEN R S,ZHONG Y T,FANG Z Q,et al. Effects of 17 β-estradiol on the development of the testis and liver in male swordtail fish (Xiphophorushelleri)[J]. Chinese Journal of Zoology, 2013,48(2),174-181.)
[17] CORTINOVIS S,GALASSI S,MELONE G,et al. Organochlorine contamination in the great crested grebe (Podicepscristatus): Effects on eggshell thickness and egg steroid levels[J]. Chemosphere, 2008,73(3):320-325.
[18] SANTEN R J,YUE W,WANG J P. Estrogen metabolites and breast cancer[J]. Steroids, 2015,99(A):61-66.
[19] RAJAPAKSE N,ONG D,KORTENKAMP A. Defining the impact of weakly estrogenic chemicals on the action of steroidal estrogens[J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2001,60(2):296-304.
[20] SCIUBBA L,CAVANI L,MARZADORI C,et al. Effect of biosolids from municipal sewage sludge composted with rice husk on soil functionality[J]. Biology & Fertility of Soils, 2013,49(5):597-608.
[21] ANGINO E E,BILLINGS G K. Atomic absorption spectrometry in geology[M]. Amsterdam:Elsevier, 2012.
[22] 贾晨曦,郭晓华,刘广纯. 不同保存方式下金龟甲虫DNA提取方法及28S rDNA序列分析[J]. 沈阳大学学报(自然科学版), 2013,25(6):436-440. (JIA C X,GUO X H,LIU G C. DNA extraction and 28S rDNA sequences analysis of scarab beetle specimens preserved under different conditions[J]. Journal of Shenyang University(Natural Science), 2013,25(6):436-440.)
[24] WEBSTER G,EMBLEY T M,PROSSER J I. Grassland management regimens reduce small-scale heterogeneity and species diversity of beta-proteobacterial ammonia pxidizer populations[J]. Applied & Environmental Microbiology, 2002,68(1):20-30.
[25] COCOLIN L,AGGIO D,MANZANO M,et al. An application of PCR-DGGE analysis to profile the yeast populations in raw milk[J]. International Dairy Journal, 2002,12(5):407-411.
【责任编辑: 胡天慧】
Analysis of Effect of Estradiol on Microbial Community Structure in Agricultural Soil Using PCR-DGGE Fingerprinting
TianLina,b,ZhangXuna,b
(a. College of Environment, b. Key Laboratory of Regional Environment and Eco-Remediation (Ministry of Education), Shenyang University, Shenyang 110044, China)
The polymerase chain reaction (PCR) and denaturing gradient gel electrophoresis (DGGE) method is used to analyze the variation of the microbial community structure in estradiol-contaminated agricultural soil samples with different mass fraction and time of exposure. The results demonstrate that the growth of some bacterial species in the estradiol-contaminated agricultural soil samples is inhibited during the exposure. The number of some bacteria decreases with the increase of estradiol concentration or time of exposure, while other bacteria are enriched under the effect of estradiol, and their DGGE bands change from undertones to deep colors. The microbial community structure, however, show a wide variation in the estradiol contaminated agricultural soil samples, especially in the agricultural soil samples treated with estradiol concentration of 200 ng/kg. The diversity indices of microbial community with concentration of 200 ng/kg are greater than those of another two groups. Diversity indices show that the contaminated group of 100 ng/kg is decreased with the increase of exposure time, while the contaminated groups of 200 ng/kg and 300 ng/kg have a similar moderate growth trend over time. It is found that suitable mass fraction of estradiol could increase the diversity of the microbial community in the agricultural soil.
17β-estradiol; agricultural soil; microbial community structure; PCR-DGGE
2016-09-21
国家自然科学基金资助项目(41472237); 辽宁省高等学校优秀人才支持计划项目(LJQ2015077); 辽宁省科学技术计划资助项目(201602530).
田 琳(1991-),女,山西长治人,沈阳大学硕士研究生.
2095-5456(2017)01-0014-07
X 172
A

