二斑叶螨为害对番茄叶片主要营养物质和防御酶活性的影响
温 娟,郅军锐,吕召云,张羽宇
(贵州大学昆虫研究所,贵州省山地农业病虫害重点实验室,贵阳 550025)
二斑叶螨为害对番茄叶片主要营养物质和防御酶活性的影响
温 娟,郅军锐*,吕召云,张羽宇
(贵州大学昆虫研究所,贵州省山地农业病虫害重点实验室,贵阳 550025)
本文研究了二斑叶螨Tetranychusurticae为害对寄主植物番茄营养物质和防御酶活性的影响。结果表明:二斑叶螨为害对番茄植株体内营养物质含量和防御酶活性均有一定影响,且为害密度和为害时间存在交互作用。二斑叶螨为害后番茄叶片可溶性糖含量下降幅度与叶螨为害密度和时间呈正比;可溶性蛋白和游离氨基酸含量在二斑叶螨高密度为害3 d时最低。二斑叶螨为害后番茄叶片防御酶活性普遍增强,过氧化物酶POD活性在5头/叶密度时与为害时间呈正比;苯丙氨酸解氨酶PAL、多酚氧化酶PPO和脂氧合酶LOX活性的变化一致,均在中密度为害时活性最高。以上结果说明番茄叶片通过调节其体内营养物质含量和各种防御酶活性的变化,对二斑叶螨的胁迫产生了应激反应。
二斑叶螨;番茄;营养物质;防御酶活性
二斑叶螨TetranychuurticaeKoch是蔬菜、花卉、果树上的重要害螨之一,由于该螨对各种化学药剂产生抗药性,近年来其分布区域和为害范围逐渐扩大,已成为部分地区的重要害螨(刘学辉等, 2007; 高新菊和沈慧敏, 2011; 耿书宝等, 2014)。利用植物自身防御抗螨是当前研究的热点领域,可以避免化学防治带来的许多问题,对促进农业措施防治害螨、抗螨育种和生物防治具有重要意义。
在植物和叶螨长期协同进化中,植物建立了非常敏感的防御机制来应对叶螨的侵害(张坤鹏等, 2013),植物在遭遇虫害后,其体内化学成分的种类及数量会发生变化,对害虫产生驱避或毒害作用,这些变化包括营养物质含量改变和次生代谢的加强(闫凤鸣, 2011),同时还可以诱导防御酶活性升高或产生防御蛋白(Constabeletal., 1996; Kranthietal., 2003)。已有研究表明,葡萄被二斑叶螨侵害后可溶性糖含量显著下降(Sivritepeetal., 2009),而二斑叶螨侵害菜豆后,受害叶片中蛋白质和氨基酸含量随着为害时间增加而逐渐上升(黎志辉和鲁亚, 2011),叶绿素和还原糖含量随着为害时间的延长和密度的增大而明显下降,总糖含量则先升高再降低(孙月华等, 2014)。二斑叶螨侵害菊花后,受害叶片氨基酸浓度降低,但随为害加重氨基酸浓度增加(Tomczyk, 2001)。叶螨的为害不仅导致寄主营养物质的改变,同时也造成寄主细胞膜系统被损坏,二斑叶螨刺吸取食能诱导白三叶体内过氧化物酶(POD)和多酚氧化酶(PPO)活性发生变化,在一定时间范围内随刺吸天数的增加,白三叶体内POD和PPO活性呈上升趋势,而且上升的幅度与虫口密度呈正相关(张廷伟等, 2013)。菜豆受二斑叶螨为害后,叶片中的过氧化氢酶(CAT)含量随着为害时间的延长而明显增加(黎志辉和鲁亚, 2011),这些变化均是植物的抗逆反应。
番茄LycopersiconesculentumMiller是我国重要的蔬菜种类之一,也是二斑叶螨喜好的寄主植株之一(贺达汉等, 2001),并且二斑叶螨取食番茄会诱导茉莉酸途径的防御基因表达(Lietal., 2002),二斑叶螨为害番茄植株后会诱导怎样的防御反应?引起什么样的生理生化变化?为此,本文研究了二斑叶螨不同虫口密度和不同为害时间下番茄叶片营养物质和防御酶活性的变化规律,探讨番茄对二斑叶螨为害的响应机制,以期为制定二斑叶螨的防治指标,并为揭示害虫与寄主植物之间的相互关系奠定基础。
1 材料与方法
1.1 供试材料
二斑叶螨采自贵州省贵阳市花溪区蔬菜基地的菜豆上,经鉴定纯化后,在人工气候室(L ∶D=14 ∶10;温度25℃±1℃;湿度70%±5%)内培养的菜豆植株上连续饲养多代。
番茄品种为合作903(上海番茄研究所),将番茄种子于2015年 4-8月播种于温室大棚(L ∶D=14 ∶10;温度25℃±1℃;湿度70%±5%)花盆中,温室保持无害虫为害状态。番茄株高约为40 cm(生长约2个月)时作为供试寄主植物,生长期间不使用任何农药。
1.2 材料处理
选取长势相同(叶片大小、数量基本一致)的健康番茄按照5、15、25头/叶3个虫口密度整株接入二斑叶螨雌成螨,均匀分布,以不接螨为对照,用凡士林油涂抹在叶柄处防止二斑叶螨逃逸。分别于接螨后的1、2、3 d取处理叶片进行营养物质含量及防御酶活性的测定。测定前先清除叶螨,然后剪取叶片。重复4次。
1.3 试验方法
1.3.1 番茄叶片营养物质含量测定
可溶性糖含量测定,采用蒽酮比色法(陈毓荃, 2002),在620 nm波长下测定吸光值。用葡萄糖绘制标准曲线;可溶性蛋白含量测定,采用考马斯亮蓝法(Bradford, 1976),在595 nm波长下测定吸光值,用牛血清蛋白绘制标准曲线;游离氨基酸含量测定,采用茚三酮法(孔祥生和易现峰, 2008),在波长570 nm下测定吸光值,用亮氨酸作标准曲线。均采用Bio Rad SmartSpec Plus分光光度计进行测定。
1.3.2 番茄叶片防御酶活性测定
过氧化物酶(POD)催化H2O2氧化特定底物,在470 nm有特征光吸收,酶活性单位定义每mg组织蛋白在每mL反应体系中每分钟A470变化0.01为一个酶活力单位。
多酚氧化酶(PPO)能够催化邻苯二酚产生醌,后者在525 nm有特征光吸收,酶活性单位定义每mg组织蛋白在每mL反应体系中每分钟525 nm 变化0.01为一个酶活力单位。
脂氧合酶(LOX)催化亚油酸氧化,氧化物在234 nm处有特征吸收峰,测定234 nm吸光度增加速率,酶活性单位定义25℃中每mg蛋白每分钟催化吸光值变化0.001个单位为一个酶活力单位。
苯丙氨酸解氨酶(PAL)催化L-苯丙氨酸裂解为反式肉桂酸和氨,反式肉桂酸在290 nm处有最大吸光值,通过测定吸光值升高速率计算PAL活性,酶活性单位定义每mg组织蛋白在每mL反应体系中每分钟290 nm变化0.1为一个酶活力单位。
酶活测定所用试剂购于苏州科铭生物技术有限公司,试验仪器为Bio Rad SmartSpec Plus分光光度计。
1.4 数据分析
采用Microsoft Excel 2010和SPSS 13.0软件对数据进行处理和制图。二斑叶螨不同时间和密度为害对番茄叶片营养物质含量和防御酶活性的影响进行双因素方法分析(Two-way ANOVA),利用Tukey法比较不同处理番茄营养物质含量、防御酶活性差异的显著性。
2 结果与分析
2.1 二斑叶螨取食为害对番茄叶片营养物质的影响
二斑叶螨不同密度不同取食时间对番茄叶片营养物质有明显的影响。不论是可溶性糖、可溶性蛋白还是游离氨基酸含量均与二斑叶螨密度和为害时间密切相关,并且还有明显的交互作用(P<0.05),即随着二斑叶螨为害密度的增大,为害时间延长对番茄营养物质含量的影响程度会增高。(表1)。

表1 二斑叶螨不同密度和时间为害对番茄叶片营养物质影响的方差分析
随着二斑叶螨刺吸时间的延长,番茄叶片可溶性糖含量明显降低(表2)。不论在何种密度下,二斑叶螨为害叶片可溶性糖含量均明显低于对照。随着取食时间的延长,可溶性糖含量的变化与密度有很大的关系。在二斑叶螨密度5头/叶为害时,可溶性糖含量在为害2 d和3 d时间不存在显著性差异,但在15头/叶和25头/叶时,可溶性糖含量在3 d时下降最多,明显低于2 d时的含量,在25头/叶为害3 d时可溶性糖含量下降了67.93%。在二斑叶螨为害相同时间下,不同密度下可溶性糖含量的变化不太相同,不论为害1 d还是3 d时,可溶性糖含量均随着为害程度而逐渐下降,但二斑叶螨刺吸2 d时,可溶性糖含量在15头/叶为害时最低,在25头/叶含量又有所上升,与 5头/叶为害株不存在显著性差异。
不论在哪一个密度下,二斑叶螨为害均造成可溶性蛋白含量的变化,但不同为害时间下可溶性蛋白含量的变化与密度有关(表3)。5头/叶胁迫时,可溶性蛋白含量均低于健康植株,刺吸2 d时可溶性蛋白含量显著高于刺吸1 d时的,而为害3 d时含量最低,明显低于为害1 d时的。二斑叶螨15头/叶为害番茄时,可溶性蛋白含量和5头/叶时近似,也是下降上升再下降,只是为害2 d时迅猛增加。25头/叶二斑叶螨胁迫时,可溶性蛋白含量均随为害时间的延长而不断降低。二斑叶螨为害相同时间下可溶性蛋白含量因密度不同变化不同。在二斑叶螨1 d为害时,所有密度下的可溶性蛋白含量均明显下降,5头/叶和15头/叶为害株可溶性蛋白含量下降最多,而在25头/叶为害时含量下降较少。二斑叶螨刺吸2 d时,可溶性蛋白含量在5头/叶和25头/叶为害时含量均低于健康植株,15头/叶为害时可溶性蛋白含量比对照还增加了4.9%。为害3 d时,可溶性蛋白含量随着密度的增大而下降,在25头/叶时下降了46.65%。

表2 二斑叶螨为害对番茄叶片可溶性糖含量的影响(mg/g)
注:表中同一行大写字母不同表示在同一时间不同为害密度下在0.05水平上差异显著,同一列小写字母不同表示在同一密度不同时间为害下在0.05水平上差异显著。下表同。Note: Different upper-case letters in the same row indicate significant difference at the same feeding time but different population density(P<0.05); different lower-case letters in the same column indicate significant difference at the same population densities but different feeding time(P<0.05). The same below.

表3 二斑叶螨为害对番茄叶片可溶性蛋白含量的影响(mg/g)
游离氨基酸含量在不同密度和时间下的变化不同,5头/叶二斑叶螨为害时,游离氨基酸含量随着为害时间的延长而明显降低。二斑叶螨15头/叶和25头/叶,游离氨基酸在不同时间下含量变化相似,均在为害2 d时最高并显著高于健康植株,为害3 d时游离氨基酸含量最低。二斑叶螨相同为害时间下,游离氨基酸含量在各处理间也不尽相同。二斑叶螨在为害1 d和3 d时,游离氨基酸含量均随螨口密度的升高而下降,但二斑叶螨为害2 d时,游离氨基酸含量在低密度为害下最低,在较高的两个密度下,其含量与对照差异不显著(表4)。
2.2 二斑叶螨取食为害对番茄防御酶活性的影响
二斑叶螨不同密度不同取食时间为害对番茄叶片POD、PPO、PAL和LOX防御酶的活性有明显的影响,并且密度和时间还有明显的交互作用(P<0.05)(表5),即二斑叶螨不同为害密度和为害时间共同作用加重对番茄防御酶活性的影响。

表5 二斑叶螨不同密度和时间为害对番茄叶片防御酶活性影响的方差分析
二斑叶螨不同密度和时间为害也对番茄叶片防御酶的活性产生明显的影响。无论在何种密度下,受害叶POD活性均高于健康植株(图1)。二斑叶螨5头/叶为害番茄时,POD活性显著增加,并随着为害时间的延长而增加。在15头/叶和25头/叶二斑叶螨胁迫时,POD活性均在为害2 d时最高,且在25头/叶时达到153 U/mg prot,为害1 d时POD活性均最低。另外,由图还可知,二斑叶螨刺吸相同时间时,POD活性在不同为害密度间同样存在差异。二斑叶螨为害1 d和2 d时,POD活性随着虫口密度的增加有所升高,但为害1 d时POD活性在15头/叶和25头/叶差异不显著,为害2 d时POD活性在25头/叶为害密度下最高。二斑叶螨为害3 d时,POD活性随着为害密度的增加先升高然后再下降。

图1 二斑叶螨为害后番茄叶片过氧化物酶活性变化Fig.1 Changes of the POD activity of tomato leaves infested by Tetranychu urticae Koch at different densities and time
同样,二斑叶螨为害也导致番茄叶片PAL活性发生变化(图2)。在二斑叶螨同一密度为害条件下,PAL活性均在刺吸2 d时达到最高,且PAL活性均显著高于健康植株,但不同密度下的变化规律不同,不论5头/叶还是15头/叶二斑叶螨为害番茄,PAL活性均在为害3 d时活性开始下降,但二斑叶螨25头/叶胁迫时,PAL活性则在为害2和3 d间不存在显著差异。二斑叶螨刺吸1 d和2 d时,PAL活性则均在15头/叶时最高,25头/叶时又显著下降,在为害1 d时,PAL活性在25头/叶时与健康植株相当,但在为害2 d时,高于健康植株;为害3 d时,PAL活性随着密度的增加不断上升。

图2 二斑叶螨为害后番茄叶片苯丙氨酸解氨酶活性变化Fig.2 Changes of the PAL activity of tomato leaves infested by Tetranychu urticae Koch at different densities and time
番茄叶片中PPO活性也因二斑叶螨的取食发生变化(图3)。不论在任何为害密度下,PPO活性均在为害2 d时最高,分别较健康植株增加了25.31%、30.81%和12.84%。在5头/叶和15头/叶下,均是叶螨为害1 d时活性最低,在25头/叶下,PPO的活性在为害1 d和3 d时没有明显差异。PPO的活性在二斑叶螨不同密度相同为害时间下的变化规律也不同,在胁迫1 d时,PPO在15头/叶为害时活性明显升高,25头/叶与健康植物不存在显著差异,5头/叶时活性低于健康植株。在二斑叶螨为害2 d和3 d时,PPO活性均在5头/叶和15头/叶最高,且两者间没有明显差异,25头/叶为害2 d时PPO活性高于健康植株,但3 d时PPO活性显著低于健康植株。
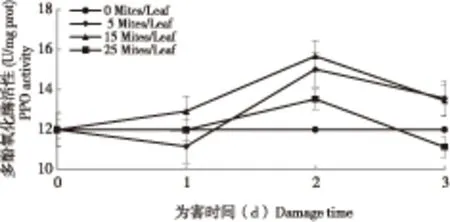
图3 二斑叶螨为害后番茄叶片多酚氧化酶活性变化Fig.3 Changes of the PPO activity of tomato leaves infested by Tetranychu urticae Koch at different densities and time
二斑叶螨取食为害后LOX活性均显著高于健康植株,仅在25头/叶为害3 d时低于健康植株,且变化特点与PAL相似(图4)。二斑叶螨在5头/叶为害番茄时,LOX活性变化与PAL一致。在15头/叶为害时,虽然LOX活性也是在为害2 d时最高,但在为害3 d时明显低于1 d时的。二斑叶螨25头/叶为害时,LOX活性则随着为害时间的延长而降低,为害3 d时活性仅为16.07 U/mg prot。不仅如此,二斑叶螨同一为害时间下,LOX活性均是随密度的增加先上升再下降,但不同为害时间下的变化不同。二斑叶螨为害1 d时,LOX活性在15头/叶为害时最高,5头/叶与25头/叶为害不存在差异。为害2 d时,LOX活性在5头/叶和15头/叶时最高,且二者间不存在差异。二斑叶螨为害3 d时,LOX活性在5头/叶时最高,随着为害密度的增加逐渐降低,在25头/叶时最低。
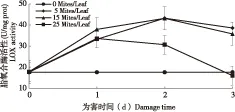
图4 二斑叶螨为害后番茄脂氧合酶活性变化Fig.4 Changes of the LOX activity of tomato leaves infested by Tetranychu urticae Koch at different densities and time
3 结论与讨论
植物为昆虫提供了基本的营养和生存环境,而植物营养物质含量将直接影响到昆虫生长代谢过程。植物营养物质本身的变化,也是植物的一种防御策略,植物通过营养物质含量的改变达到抗虫目的(杨振德等, 2003; 李新岗等, 2008; 许东等, 2009)。本文研究表明,受二斑叶螨取食为害后,番茄叶片可溶性糖、可溶性蛋白和游离氨基酸均有不同程度的变化,其变化程度和二斑叶螨的为害密度和时间有关。在为害3 d时,为害密度为25头/叶时番茄叶片可溶性糖、可溶性蛋白和游离氨基酸含量最低,说明密度最高为害时间最长,营养物质下降最多。但番茄在遭受二斑叶螨为害后,其可溶性蛋白和游离氨基酸含量分别在15头/叶为害2 d和25头/叶为害2 d时有所上升,这可能是植物本身的防御机制对害螨为害产生的一种生理补偿反应(张坤鹏等, 2013),随着二斑叶螨为害密度增加和为害时间的延长,番茄植株无法补偿二斑叶螨为害造成的损失,于是可溶性糖、可溶性蛋白和游离氨基酸含量开始降低。其他研究者也获得了相同的结果,如杨树被分月扇舟蛾ClosteraanastomosisLinnaeus取食1-3 d后,叶片总糖含量降低,而在第4天时则呈现升高趋势,之后含量又下降(钱为, 2010)。绿盲蝽ApolyguslucorumMeyer-Dür为害桃叶,导致可溶性糖和蛋白质含量均先减少后增加(苏敏等, 2015)。也有报告寄主植物受到害虫为害后,营养物质一直下降,如瓜蚜AphisgossypiiGlover为害不同寄主黄瓜、哈密瓜、南瓜、瓢葫芦和搅瓜后,寄主植物叶片可溶性糖和可溶性蛋白含量显著降低(李艳艳等, 2013)。菜豆遭受二斑叶螨为害后,还原糖的含量与二斑叶螨的为害程度关系密切,为害时间越长、受害程度越严重,还原糖降低幅度越大(孙月华等, 2014)。
昆虫取食为害植物后,通常会诱导植物某些防御酶活性的变化,以维持自身的生存(Constabeletal., 1996; 秦秋菊和高希武, 2005)。POD是植物抗逆反应过程中的关键酶之一,同时在植物的抗病虫害中起重要的作用(Tscharntkeetal., 2001; Allisonetal., 2004),POD以H2O2作为电子受体,氧化各种次生代谢过程中的物质,如POD能与部分酚类物质作用产生苯氧基和氧自由基,直接干涉植食性昆虫的取食或产生毒素降低植物的可食性,降低叶片的营养水平(Feltonetal., 1989)。本试验中,螨害后番茄POD活性随着二斑叶螨为害密度的增加逐步升高,且随着为害时间的延长其活力变化呈现一个先上升后下降的过程,在为害2 d密度为25头/叶时达到最高。可能是番茄植株对二斑叶螨为害的一种应激反应,为害初期POD活性的升高能够及时清除活性氧,但为害后期严重时活性氧代谢平衡被打破,活性氧累积量超过了POD的清除能力,致使POD活性下降。PAL是苯丙烷类代谢途径中催化反应的关键酶和限速酶(Mauch-Mani and Slusarenko, 1996),参与了植物次生抗性物质(植保素、木质素和酚类物质等)的合成和积累,因此PAL活性的升高是植物抗性的指标因子之一(Shadleetal., 2003)。本研究发现,二斑叶螨为害后番茄叶片PAL活性在15头/叶为害2 d时最高,并且存在先上升后下降的趋势,说明PAL在番茄植株对二斑叶螨的抗性过程中发挥了作用,同时二斑叶螨的为害可能在一定程度上使番茄叶片内催化合成了对二斑叶螨有害的酚类、醌类物质。PPO是植物中广泛存在的催化酚类物质氧化的酶类,它催化酚类物质氧化成醌,一方面作为抗营养因子抵御昆虫取食,另一方面还能对病原菌有抑制作用(Constabeletal., 2000)。本研究发现,二斑叶螨诱导番茄的PPO活性无论在何种密度下,均在为害2 d时活性最高,之后又下降,而二斑叶螨相同时间为害时,PPO活性在25头/叶为害3 d时最低,这可能是番茄植株在遭受二斑叶螨胁迫为害后,产生了一定的抗性物质对二斑叶螨起到取食障碍作用,但又由于这些物质含量过高对自身可能产生毒害作用(Duffeyetal., 1996)。LOX作为十八烷酸途径中的关键酶,在植物受伤信号的识别与转导中起着重要作用,LOX信号途径诱导的防御反应还能影响寄主上害虫的群体组成(Kessleretal., 2004)。二斑叶螨为害后,番茄叶片LOX酶活性发生急剧变化,在5头/叶、15头/叶为害2 d时最高,但在严重为害时,LOX活性显著降低,这可能是由于二斑叶螨刺吸造成了植株膜脂过氧化,使体内亚麻酸的含量增加,LOX的活性升高,随着底物的减少,LOX的活力也逐渐下降。同样朱砂叶螨T.cinnabarinusBoisdavl为害豇豆幼苗叶片后,POD、PPO和PAL的活性与健康植株相比均有所升高,并且还诱导产生了新的POD同工酶谱带(李玉泉等, 2003)。但张廷伟等(2013)研究发现在一定时间范围内随着二斑叶螨刺吸天数的增加,诱导白三叶体内POD和PPO活性呈上升趋势,而且上升的幅度与虫口密度呈正比。该试验与本研究结果不同,造成差异的可能原因是一方面可能是二斑叶螨为害水平不同,另一方面可能是是寄主植物不同,诱导的防御效果也可能存在差异。
以上结果说明二斑叶螨刺吸为害作为一个外界胁迫能诱导番茄体内POD、PAL、PPO和LOX活性发生变化,是植物诱导防御和自身抗性的内在表现,而且防御酶活性在二斑叶螨中等程度为害时最高,说明在螨类为害达到一定阈值时,植物自身保护机制在一定范围内相应增强。
本文只研究了二斑叶螨为害寄主番茄后,致使番茄叶片营养物质含量下降,并且诱导了番茄防御酶活性变化,但这些变化是否会影响二斑叶螨或其它植食性昆虫生长发育、取食行为等,还有待今后进一步研究。
References)
Allison SD, Schultz JC.Differential activity of peroxidase enzymes in response to wounding, gypsy moth, and plant hormones in northern red oak (QuercusrubraL.)[J].JournalofChemicalEcology,2004,30(7): 1363-1379.
Bradford MM. A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binding[J].AnalyticalBiochemistry,1976,72(9): 248-254.
Constabel CP, Bergey DR, Ryna CA. Polyphenol oxidase as a component of the inducible defense response in tomato against herbivores.In:Romeo JT, Saunders JA, Barbosa P, eds. Phytochemical Diversity and Redundancy in Ecological Interactions[M]. New York: Plenum Press,1996:231-252.
Constabel CP,Yip L,Patton JJ,etal.Polyphenol oxidase from hybid poplar.Cloning and expression in response to wounding and herbivory[J].PlantPhysiology,2000,124(1):285-296.
Chen YQ. Experiments and Technology of Biochemistry[M]. Beijing: Science Press,2002:171-174.[陈毓荃.生物化学实验方法和技术[M].北京:科学出版社,2002:171-174]
Duffey SS, Stout MJ. Antinutritive and toxic components of plant defense against insects[J].ArchivesofInsectBiochemistryandPhysiology,1996,32(1):3-37.
Felton GW, Donato K, Vecchio RJD,etal. Activation of plant foliar oxidases by insect feeding reduces nutritive quality of foliage for noctuid herbivores[J].JournalofChemicalEcology,1989,15(12):2667-2694.
Gao XJ, Shen HM. Resistance selection with fenpropathrin and the change of detoxification enzyme activities inTetranychusurticaeKoch (Acari: Tetranychidae)[J].ActaEntomologicaSinica,2011,54(1):64-69.[高新菊,沈慧敏.二斑叶螨对甲氰菊酯的抗性选育及解毒酶活力变化[J].昆虫学报, 2011, 54(1): 64-69]
Geng SB,Chen HJ,Zhang JY,etal.The observation of selectivity of the two-spotted mite,Tetranychusurticaeon several plants[J].JournalofFruitScience,2014,31(5):917-921.[耿书宝,陈汉杰,张金勇,等.二斑叶螨对几种植物的选择性观察[J].果树学报,2014,31(5): 917-921]
He DH, Zhao XP, Jin QH,etal.Dispersion of two spotted spider mites,TetranychusurticaeKoch, and its selection of host plants on farmland in Ningxia[J].ChineseJournalofAppliedandEnvironmentalBiology,2001,7(5):447-451.[贺达汉,赵晓萍,靳巧红,等.宁夏地区二斑叶螨的寄主植物选择及其季节转移[J].应用与环境生物学报,2001,7(5):447-451]
Kranthi S,Krannthi KR,Wanjari RR.Influence of semilooper damage on cotton host-plant resistance toHelicoverpaarmigera(Hüber)[J].PlantScience,2003,164(2):157-163.
Kessler A,Halitshke R,Baldwin LT.Silencing the jasmonate cascade induced plant defenses and insect populations[J].Science,2004, 305(5684):665-668.
Kong XS,Yi XF.Experiment Technology of Plant Physiology[M]. Beijing: China Agriculture Press, 2008:154-157.[孔祥生,易现峰.植物生理学实验技术[M].北京:中国农业出版社, 2008:154-157]
Li C,Williams MM,Loh YT,etal.Resistance of cultivated tomato to cell content-feeding herbivore is regulated by the octadecanoid-signaling pathway[J].PlantPhysiology,2002,130(1):494-503.
Li YQ, Song ZW, Jin ZY. Studies on activity of PPO, PAL and POD isoenzymes of cowpea seeding leaves damaged by carmine spider mite[J].JournalofNorthwestNormalUniversity(Natural Science), 2003, 39(3): 61-67.[李玉泉,宋占午,金祖荫.朱砂叶螨危害初期豇豆幼苗叶片PPO、PAL及POD的研究[J].西北师范大学学报(自然科学报), 2003, 39(3): 61-67]
Liu XH, Li ZX, Yin SY,etal. The development and fecundity ofTetranychusurticaeKoch (Acariformes Tetranychidae)on four different plants and their relationship with the chemical components of plant leaves[J].ActaEntomologicaSinica,2007,50(11): 1135-1139.[刘学辉,李中新,尹淑艳,等.四种树种上二斑叶螨生长发育及繁殖差异及其与植物叶片化学组成的关系[J].昆虫学报, 2007, 50(11): 1135-1139]
Li XG,Liu HX,Huang J.Molecular mechanisms of insect pests induced plant defense[J].ChineseJournalofAppliedEcology,2008,19(4): 893-900.[李新岗,刘惠霞,黄建.虫害诱导植物防御的分子机理研究进展[J].应用生态学报,2008,19(4):893-900]
Li ZH,Lu Y. Effect of invasion byTetranychusurticaeon some biochemical indexes of leaves of phaseolus vulgaris[J].JournalofAnhuiAgriculturalSciences,2011,40(13):7683-7684.[黎志辉,鲁亚.二斑叶螨对菜豆叶片几种生理指标的影响[J].安徽农业科技,2011, 40(13):7683-7684]
Li YY,Zhou XR,Pang BP,etal.Influences ofAphisgossypiiGover feeding on the contents of main nutrients and secondary compounds in host plants[J].JournalofEnvironmentalEntomology,2013,35(1):49-54.[李艳艳,周晓榕,庞保平,等.瓜蚜为害对寄主植物主要营养物质和次生物质的影响[J].环境昆虫学报,2013,35(1):49-54]
Mauch-Mani B,Slusarenko AJ.Production of salicylic acid precursors is a major function of phenylalanine ammonia-lyase in the resistance of Arabidopsis toPeronosporaparasitica[J].PlantCell,1996,8(2):203-212.
Qin QJ,Gao XW.Plant defense response induced by insect herbivory[J].ActaEntomologicaSinica,2005,48(1):125-134.[秦秋菊,高希武.昆虫取食诱导的植物防御反应[J].昆虫学报,2005,48(1):125-134]
Qian W.Defense Responses of Poplar Induced byClosteraanastomosis[D]. Nanjing: Nanjing Forestry University,2010,14-22.[钱为.分月扇舟蛾诱导杨树防御反应的研究[D].南京林业大学, 2010,14-22]
Shadle GL,Wesley SV, Korth KL,etal. Phenylpropanoid compounds and disease resistance in transgenic tobacco with altered expression of L-phenylalanine ammonia-lyase[J].Phytochemistry,2003,64(1):153-161.
Sivritepe N,Kumral NA,Erturk U,etal.Responses of grapevines to two-spotted spider mite mediated stress[J].JournalofBiologicalSciences,2009,9(4):311-318.
Sun YH, Zhi JR, Tian T.The damage ofTetranychusurticaeon physiological index of kidney bean[J].ChineseJournalofEcology, 2014, 33(4): 1010-1014.[孙月华,郅军锐,田甜.二斑叶螨为害对菜豆生理指标的影响[J].生态学杂志, 2014, 33(4): 1010-1014]
Su M,TanXM,Wang JQ,etal.Effects of the damage byApolyguslucorum(Meyer-Dür)on physiological indexes of peach leaves in different spatial positions[J].JournalofPlantProtection,2015,42(4):612-618.[苏敏,谭秀梅,王吉青,等.绿盲蝽为害对不同空间位置桃叶生理指标的影响[J].植物保护学报, 2015, 42(4): 612-618]
Tomczyk A.Physiological andbiochemical responses of plants to spider mite feeding. In: Halliday RB,Walter DE, Proctor HC,etal. eds. Proc. Acarology: 10thInternational Congress[C].Melbourne: CSIRO Publishing,2001:306-313.Tscharntke T,Thiessen S,Dolch R,etal.Herbivory, induced resistance, and interplant signal transfer inAlnusglutinosa[J].BiochemicalSystematicsandEcology,2001,29(10):1025-1047.
XU D,Zhang YJ,Chen Y,etal.Mechanisms of indirect defenses in plants induced by herbivores[J].PlantProtection, 2009, 35(1):13-21.[许东,张永军,陈洋,等.虫害诱导植物间接防御机制[J].植物保护,2009,35(1):13-21]
Yang ZD, Zhu L, Zhao BG.Chemical ecology of insect in plant protection[J].JournalofNanjingForestryUniversity(Natural Sciences Edition), 2003, 27(5): 93-98.[杨振德,朱麟,赵博光.昆虫化学生态学与植物保护[J].南京林业大学学报(自然科学版),2003,27(5): 93-98]
Yan FM.Chemical Ecology[M].Beijing: Science Press, 2011,67-91.[闫凤鸣.化学生态学[M].北京:科学出版社,2011,67-91]
Zhang KP,Sun RH,Yang HQ.The progress of physiological and biochemical reaction of plants to pest mites damage[J].ChineseAgriculturalScienceBulletin, 2013, 29(36): 334-337.[张坤鹏,孙瑞红,杨洪强.植物对叶螨侵害的生理生化反应的研究进展[J].中国农学通报, 2013, 29(36): 334-337]
Zhang TW, Shen HM, Qian XJ,etal.Effects ofTetranychusurticaefeeding on the chlorophyll content and two kinds of protective enzyme of white clover[J].ChineseJournalofAppliedEntomology, 2013, 50(2): 395-400.[张廷伟,沈慧敏,钱秀娟,等.二斑叶螨刺吸胁迫对白三叶叶绿素含量和两种保护酶的影响[J].应用昆虫学报, 2013, 50(2): 395-400]
Effects ofTetranychusurticaefeeding on the contents of main nutrient and defensive enzymes activities of tomato leaves
WEN Juan, ZHI Jun-Rui*, LV Zhao-Yun, ZHANG Yu-Yu
(Institute of Entomology, Guizhou University, Guizhou Provincial Key Laboratory for Agricultural Pest Management of the Mountainous Region, Guiyang 550025, China)
In order to assess the effect ofTetranychusurticaefeeding on the host plants, the changes of main nutrients content and protective enzymes activity of tomato were tested after it was infested byT.urticaeat different population densities and attacking durations. The results showed that the density and attacking duration ofT.urticaehad significant effect on contents of main nutrients and the activities of protective enzyme, and the population densities and attacking durations had interactive effect. The contents of soluble sugar deceased significantly with the increasing mite density and feeding duration. The contents of soluble protein and free amino acid were lowest at 25 mites/leaf at 3 days, but soluble protein content increased at 15 mites/leaf at 2 day, and free amino acid increased at 15 or 25 mites/leaf at 2 days. The activities of defensive enzyme generally increased after infestation ofT.urticae. The POD activities of tomato infested by 5 mites/leaf significantly increased with the feeding duration, while the activities of PAL, PPO and LOX were highest at moderate damage. The results indicated that the damage ofT.urticaeinduced tomato resistance and tomato produce response by adjusting the contents of various nutrients and activities of defensive enzyme.
Tetranychusurticae; tomato; nutrients; protective enzyme
贵州省普通高等学校系统与应用蜱螨学创新团队(黔教合人才团队字[2014]33);贵州省国际合作项目(黔科合外G字[2011]7002号);贵州大学研究生创新基金(研农2015033)
温娟,女,在读硕士,主要研究方向为有害生物防治与生物安全,E-mail:juanwen787@163.com
*通讯作者 Author for correspondence, E-mail:zhijunrui@126.com
Received: 2015-12-01;接受日期Accepted: 2016-05-23
Q965;S433
A
1674-0858(2017)01-0172-09
温娟,郅军锐,吕召云,等.二斑叶螨为害对番茄叶片主要营养物质和防御酶活性的影响[J].环境昆虫学报,2017,39(1):172-181.

