Pm52
——小麦品种良星99抗白粉病基因的有效性
邹景伟邱 丹孙艳玲郑超星李静婷吴培培武小菲王晓鸣周 阳李洪杰,*
1河北科技师范学院生命科技学院, 河北秦皇岛 066604;2中国农业科学院作物科学研究所 / 农作物基因资源与基因改良国家重大科学工程, 北京 100081;3平顶山学院化学与环境工程学院, 河南平顶山 467000;4北京师范大学生命科学学院, 北京 100875
Pm52
——小麦品种良星99抗白粉病基因的有效性
邹景伟1,2邱 丹1,2孙艳玲2郑超星4李静婷3吴培培2武小菲2王晓鸣2周 阳2李洪杰2,*
1河北科技师范学院生命科技学院, 河北秦皇岛 066604;2中国农业科学院作物科学研究所 / 农作物基因资源与基因改良国家重大科学工程, 北京 100081;3平顶山学院化学与环境工程学院, 河南平顶山 467000;4北京师范大学生命科学学院, 北京 100875
良星99是黄淮冬麦区和北部冬麦区推广的抗白粉病冬小麦品种, 其抗白粉病基因位于2BL染色体, 已被命名为Pm52。利用来自不同小麦生产区的123个小麦白粉菌菌株进行抗性鉴定, 良星99可抗80%的菌株。2012-2016年连续5个生长季抗性鉴定中, 良星99在成株期对接种的白粉菌混合菌株都表现免疫或高抗。采用Pm52基因紧密连锁分子标记Xgwm120和27个菌株对10个利用良星99培育的品系进行分子检测和抗性分析发现, 衡4568、邯农2312、中信麦99和DH51302可能携带Pm52基因, 而郑麦369和冀麦729的白粉病抗性基因可能与Pm52不同。石U09-4366、XR4429、衡10-5039和农大3486苗期和成株期都表现感病, 不含Pm52基因。这些品种的成株期抗性反应与苗期的抗性反应一致。本研究的结果有利于良星99的抗白粉病基因Pm52在育种和生产上的有效利用。
Pm52; 良星99; 小麦白粉病; 抗性
小麦白粉病(病原菌 Blumeria graminis f. sp. tritici, Bgt)是影响我国小麦生产的一种重要流行性病害。白粉病不仅降低小麦产量, 而且还影响小麦加工品质[1]。白粉病在我国的流行始于 20世纪 70年代。矮秆基因的引入使小麦种植密度大幅度提高,水肥条件的改善使田间小麦群体的湿度大大提高,这些生产条件的改变为白粉病的蔓延提供了有利的条件。目前, 在大部分冬麦区和一部分春麦区, 小麦白粉病已经成为一种常见、多发性病害。据全国农业技术推广服务中心测报, 2016年小麦白粉病发病面积高达740万公顷, 对长江中下游、江淮、黄淮、华北、西北等地区的小麦生产危害尤为严重(http:// www.natesc.org.cn/sites/cb/)。
化学防治常用来控制白粉病的发生[2]。我国小麦生产上多用三唑酮类杀菌剂防治白粉病。但是,长期使用杀菌剂会导致白粉菌产生抗药性。最近一项研究显示, 在测试的9个省129个菌株中, 99.2%的菌株具有抗药性, 其中四川、甘肃、青海、陕西、浙江、云南、山东等地的供试菌株100%具有抗药性[3]。此外, 大量使用化学农药造成的环境污染必须高度重视。因此, 种植抗病品种是降低白粉病对产量和品质的影响, 控制白粉病发生和流行的首选措施。
随着白粉病在全国的流行, 抗白粉病育种也受到广泛重视。20世纪 70年代从罗马尼亚引进的Lovrin 13等小麦–黑麦T1BL·1RS易位系携带抗白粉病基因 Pm8, 具有良好的白粉病抗性, 而且产量表现突出, 适应性广, 因而被广泛用于小麦育种。这个易位系对我国以及全世界的小麦品种选育产生了深远的影响[4]。在黄淮冬麦区该易位系的频率曾达59%[5]。近期国家审定的小麦品种中仍有43.2%含有T1BL·1RS易位系[6]。但是过度利用, 导致对Pm8基因的毒性菌株频率迅速上升, 使其在很多地区抗性不再有效。发掘新的有效抗白粉病基因是抗病育种的关键环节, 特别是从产量和农艺性状表现良好的推广品种发现抗白粉病基因, 更容易被育种利用。
良星 99是山东省德州市良星种子研究所于2001年育成的半冬性小麦, 先后通过河北省中南部(2004年)、山东省(2006年)和国家黄淮麦区北片(2006年)品种审定, 适合在黄淮冬麦区北片种植; 2012年又通过河北省中北部品种审定, 2013年获准在天津市种植, 进一步将推广区域扩大到北部冬麦区。2006年良星 99被确定为国家和山东省的主导品种。2010年和2012年, 良星99被确定为山东省和国家冬小麦区域试验黄淮冬麦区北片水地组的对照品种。良星99在生产上高抗白粉病, 其抗白粉病基因(MlLX99)被定位于 2BL染色体的 2BL2-0.35~0.50区间[7], 之后被正式命名为 Pm52[8]。除了作为推广品种广泛种植之外, 良星 99还作为优良的亲本,培育出一批小麦新品种参加国家冬小麦区域试验(表1)。
本研究的目的一是利用不同地区小麦生产田的小麦白粉菌对良星99进行抗性鉴定, 分析Pm52的白粉病抗性在我国小麦主产区的有效性和利用价值;二是通过多菌株抗性鉴定, 分析以良星99为亲本培育的小麦品系对白粉病的抗性。
1 材料与方法
1.1 植物材料
小麦品种良星99以及近年来参加国家小麦品种区域试验的10个以其为亲本选育的小麦品系的系谱和来源信息列于表1。小麦品种 Coker 747和品系2636-24R分别携带Pm6和Pm33, 用于抗谱比较。中作9504作为抗性鉴定的感病对照品种, 并用于繁殖和保存白粉菌菌种。
1.2 苗期抗白粉病鉴定
供试小麦白粉菌菌株主要来自良星 99适宜推广地区山东、河北、河南、北京、山西等地的小麦生产田, 另有少数菌株采自江苏、云南、贵州、四川等地的麦田, 有3个菌株的来源地不详(表2)。从田间采集病叶接种到中作9504幼苗上, 经3次单孢子堆分离纯化, 作为抗白粉病鉴定的菌种。所有菌种均在中作9504幼苗上保持和繁殖。
采用苗期离体叶段法进行抗性鉴定[9]。剪取第一片叶大约3 cm的叶段, 每个材料取3个不同植株的叶段作为重复, 置铺有滤纸的塑料方盒中, 用 50 mg L–1苯骈咪唑(benzimidazole)溶液湿润滤纸, 将新繁殖的待测白粉菌分生孢子均匀地抖落在小麦叶段上; 在(18±2)℃的培养箱中培养7~10 d, 采用0~4级标准调查每个叶段的反应型, 其中 0~2级为抗病反应型(R), 3~4级为感病反应型(S)[10]。
1.3 成株期抗白粉病鉴定
2012—2016年在中国农业科学院作物科学研究所北京昌平试验站进行。播种每个品种1行, 行长1 m, 行距25 cm, 每行播种30粒, 在试验区四周种植中作9504作为接种行。小麦返青后, 在接种行上接种混合菌株(毒力型V1、V3a、V3b、V3c、V3e、V3f、
V4a、V4b、V5a、V6、V7、V8、V17、V19、V23、V25、V30、V34、V35和VXBD)。在每年5月下旬小麦灌浆期, 采用0~9级标准调查病害的反应型[11]。其中0级为免疫(IM), 1~2级为高抗(HR), 3~4级为中抗(MR), 5~6级为中感(MS), 7~9级为高感(HS)。

表1 利用良星99为亲本培育的小麦品系的系谱、来源和参加国家区域试验组别Table 1 Pedigrees, origins, and the groups tested in the national yield trials of wheat lines derived from Liangxing 99
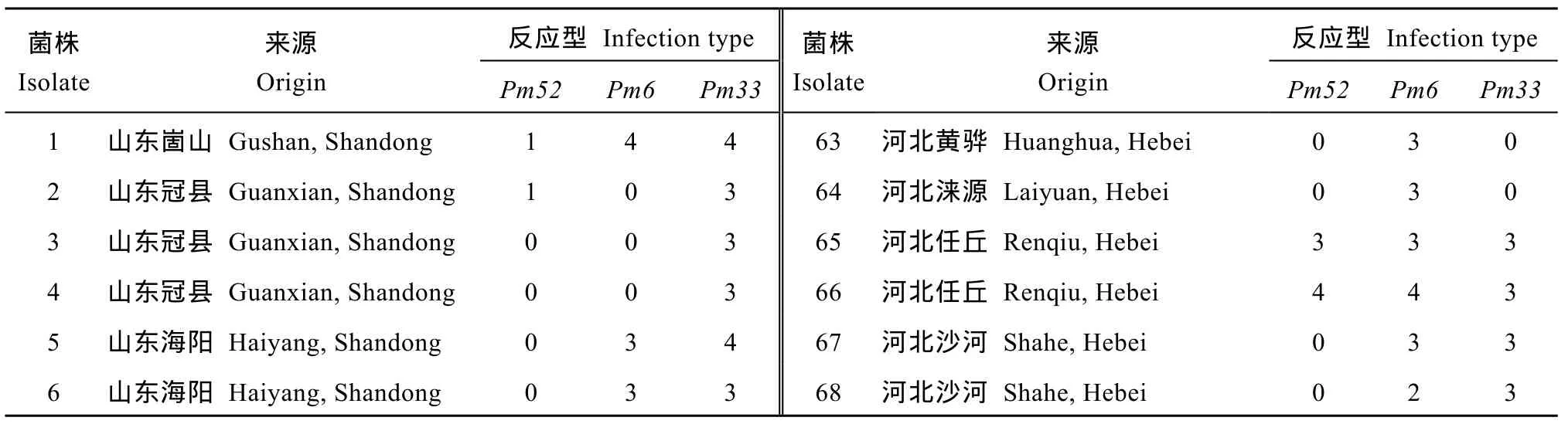
表2 Pm52 (良星99)、Pm6 (Coker 747)和Pm33 (2636-24R)苗期对123个白粉病菌株的反应型Table 2 Infection types of Pm52 (Liangxing 99), Pm6 (Coker 747), and Pm33 (2636-24R) produced by 123 Blumeria graminis f. sp.tritici isolates at the seedling stage
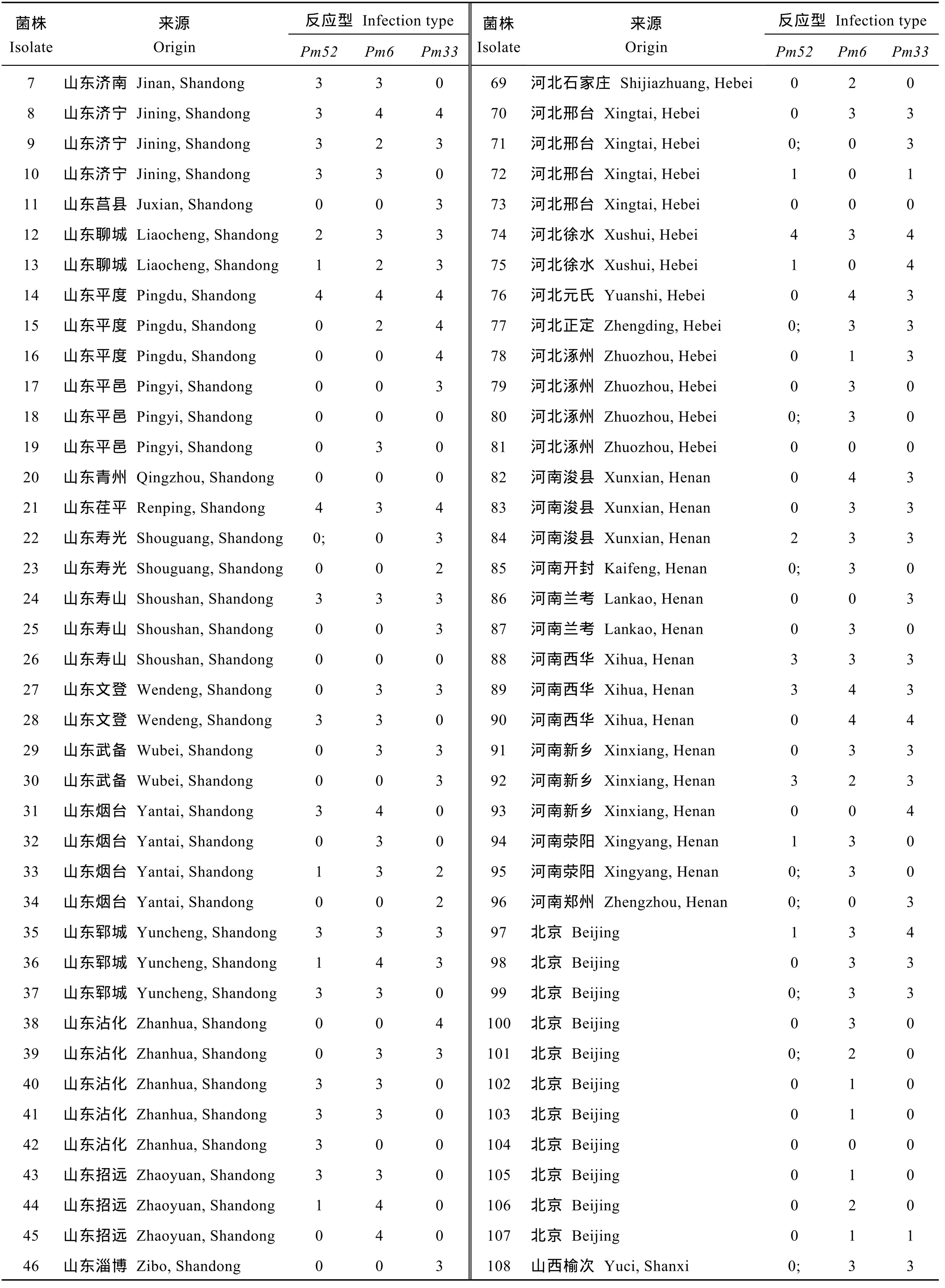
(续表2)

(续表2)
2016年, 设 3次重复, 调查小麦材料倒二叶最大严重度(maximum disease severity, MDS)和病程曲线下面积(area under the disease progress curve, AUDPC)。做法是当感病对照品种中作9504开始发病时, 开始调查发病严重度, 每个重复调查5株, 从5月4日开始, 每隔5 d调查一次, 共调查6次。6月1日最后一次调查时记录每个品种倒二叶白粉菌孢子堆面积占总叶片面积的百分数, 作为最大严重度[12]。
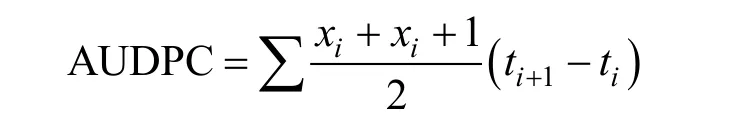
式中, xi表示第i次调查的严重度, ti表示第i次调查距接种后的天数。用 SPSS19软件对最大严重度和AUDPC进行方差分析, 采用t-测验进行显著性差异比较(P < 0.01)[13]。
1.4 抗白粉病基因Pm52的分子检测
采用DNA提取试剂盒(北京天根生化科技有限公司)提取小麦叶片的基因组 DNA。抗白粉病基因Pm52紧密连锁的分子标记为Xgwm120 (F: 5′-GAT CCACCTTCCTCTCTCTC-3′, R: 5′-GATTATACTG GTGCCGAAAC-3′)。在T3000 Thermocycler多功能扩增仪(Biometra, 德国)上进行PCR, 反应混合液10 μL, 其成分为50 ng模板DNA, 0.1 μmol L-1引物, 2× Taq PCR Master Mix 5 μL (北京天根生化科技有限公司), 其中包含Taq DNA聚合酶、dNTPs、MgCl2、反应缓冲液、PCR的增强剂和优化剂以及稳定剂。反应程序为94°C预变性4 min; 94°C变性30 s, 60°C退火40 s, 72°C延伸1 min, 38个循环; 72°C延伸10 min。采用29︰1的8%非变性聚丙烯酰胺凝胶电泳检测扩增产物。
2 结果与分析
2.1 Pm52对不同地区白粉菌的抗性
采用123个白粉菌菌株对Pm52 (良星99)与同样位于 2BL染色体上的 Pm6 (Coker 747)和 Pm33 (2636-24R)基因进行抗谱比较(表2)。Pm52对这些菌株的平均抗性频率为 81.3%, 高于 Pm6 (42.3%)和Pm33 (43.9%) (图1)。Pm52对不同地区的白粉菌抗性频率均接近或超过70%。在良星99品种的来源地山东省, Pm52的抗性频率为68.1% (图1); 对同属黄淮冬麦区的河北省和河南省菌株抗性频率分别为91.2%和80.0%。对北部冬麦区的北京市采集的菌株抗性频率为100%; 对其他省份(包括山西、江苏、云南、贵州和四川)的菌株抗性频率为87.5%。Pm6和Pm33对各地菌株的平均抗性频率为42.3% (26.7%~63.6%)和43.9% (26.7%~63.6%) (图1)。
2.2 Pm52的成株期抗性
2012—2016年连续5个生长季, 对良星99进行成株期白粉病抗性鉴定。在灌浆期, 良星99对接种的白粉菌混合菌株的病害级别分别为 0~2级, 表现免疫至高抗表现型(表3)。对照品种中作9504的病害级别为8级或9级, 表现高感白粉病。
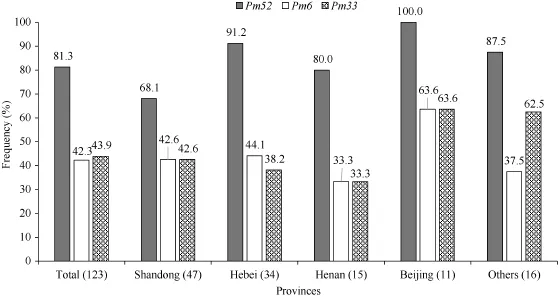
图1 良星99 (Pm52)对不同省份白粉菌菌株的苗期抗性频率Fig. 1 Frequencies of Liangxing 99 (Pm52) against the Blumeria graminis f. sp. tritici isolates from different provinces at the seedling stage括号内数字为不同省份的菌株数目。The numbers of isolates from different provinces are shown in the brackets.
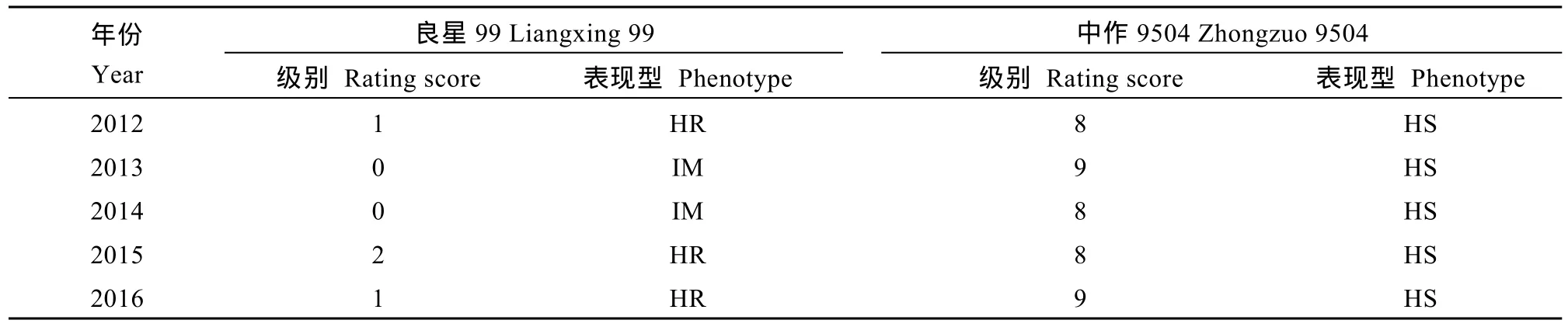
表3 2012–2016年良星99 (Pm52)成株期对白粉病的抗性反应Table 3 Rating scores of Liangxing 99 (Pm52) at the adult plant stage during 2012–2016 cropping seasons
2.3 用良星99培育的小麦品系对白粉病的抗性
采用27个小麦白粉菌菌株对10个以良星99为亲本培育的小麦品系进行苗期抗性鉴定。良星99对18个菌株表现抗病反应型, 反应型为0、0;或1, 对另外9个菌株表现感病, 反应型为3或4。衡4568、中信麦99和DH51302与良星99的反应型相似, 只有 1个菌株的反应型表现不同, 中信麦99与DH51302对这些菌株的反应型完全相同(表4)。邯农2312与良星 99对 3个菌株的反应型存在差异。根据反应型聚类分析结果, 这些品系与良星99的反应型比较接近(图2)。冀麦729和郑麦369分别对13和9个菌株表现抗病反应型, 抗谱与良星99有很大的不同。由聚类分析可知, 这些品系与良星99的距离较远。其余4个品系石U09-4366、XR-4429、衡10-5039和农大3486对所有供试菌株都表现感病反应型, 它们与感病对照中作9504聚为一类。
2016年的成株期抗性鉴定中, 衡 4568、邯农2312、中信麦99和DH51302表现中抗或高抗表型, MDS和AUDPC与良星99差异不显著(表5和图3)。表现中抗表型的冀麦 729和郑麦 369, 其 MDS和AUDPC也与良星99差异不显著。这些品系的MDS和AUDPC显著低于对照品种中作9504 (P < 0.01)。石U09-4366、XR-4429、衡10-5039和农大3486高感白粉病, MDS和AUDPC与中作9504差异不显著,但显著高于良星99和其他6个抗病品系(P < 0.01)。从病程发展趋势来看, 石 U09-4366、衡 10-5039和农大3486的AUDPC低于衡XR-4429 (图3)。
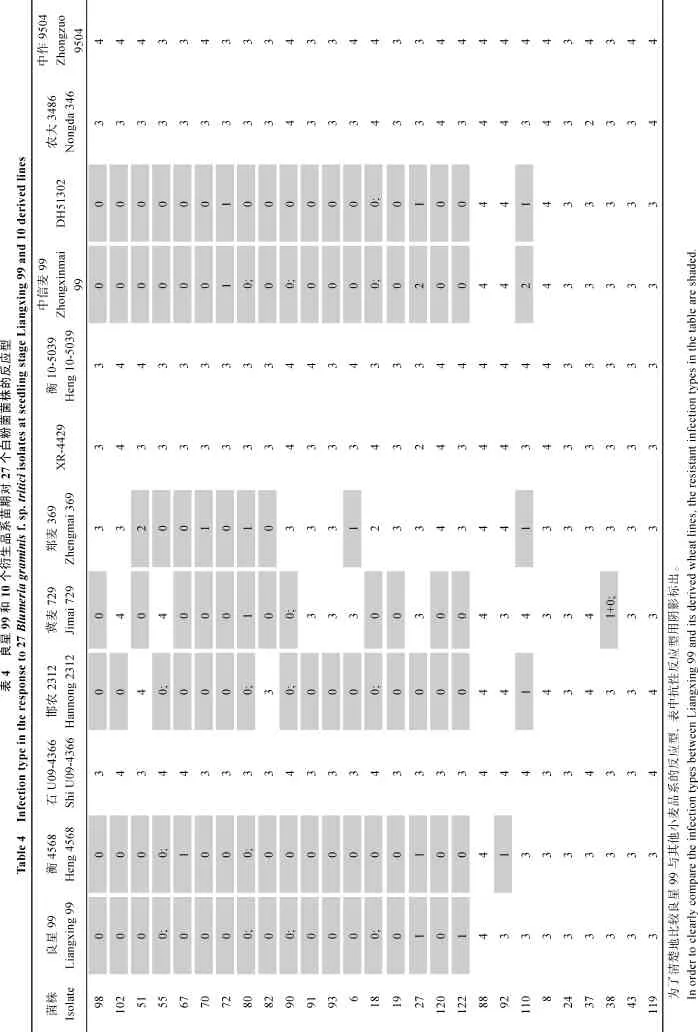
图2 良星99及10个衍生品种和感病对照品种中作9504对27个白粉菌反应型的聚类图Fig. 2 A dendrogram based on the infection types of Liangxing 99, 10 derived lines and the susceptible control cultivar Zhongzuo 9504 to 27 Blumeria graminis f. sp. tritici isolates
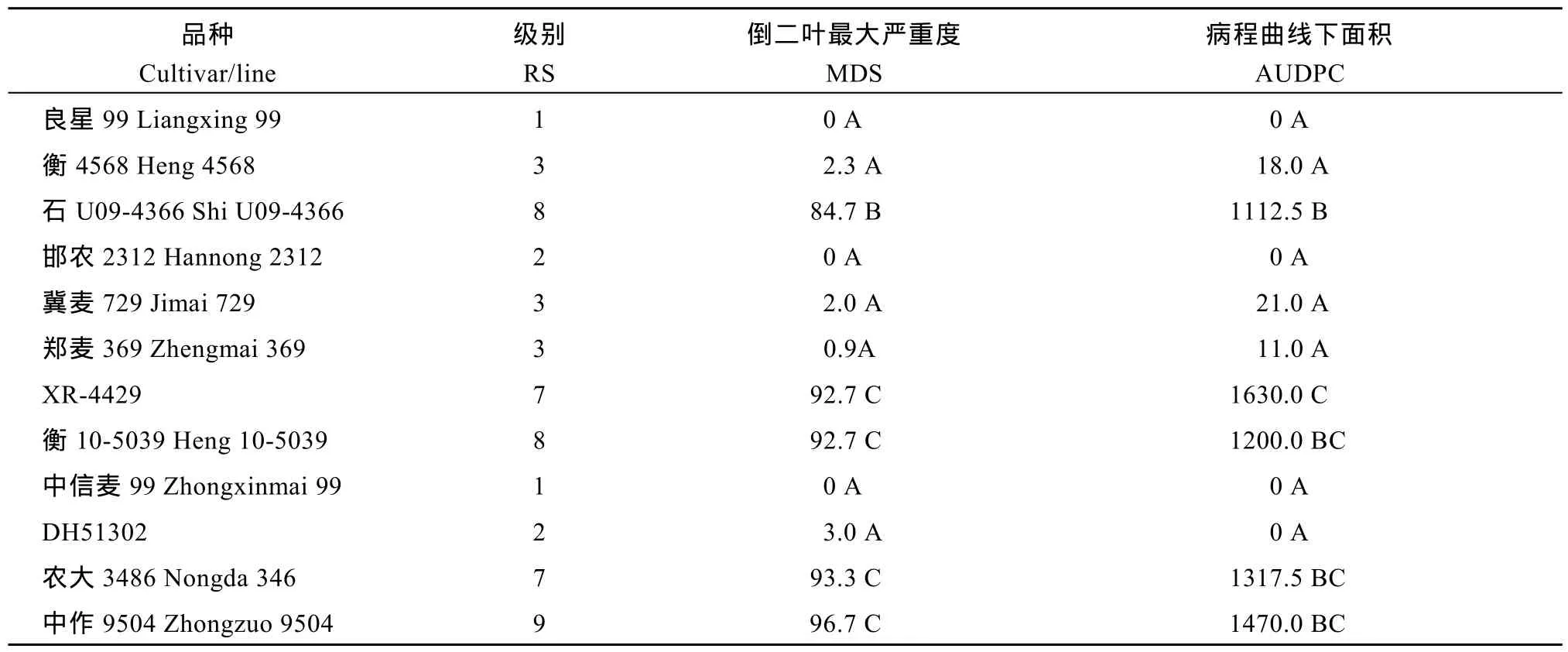
表5 良星99和10个衍生品系成株期抗性反应型、倒二叶最大严重度和病程曲线下面积Table 5 Rating score (RS) , maximum disease severity (MDS), and area under the disease progress curve (AUDPC) of Liangxing 99and 10 derived lines at the adult stage
2.4 小麦品系中抗白粉病基因Pm52的分子标记检测
利用与 Pm52紧密连锁的分子标记 Xgwm120对10个品系分析表明, 衡4568、邯农2312、中信麦99和DH51302与良星99的带型相同。石U09-4366、冀麦729、郑麦369、XR-4429、衡10-5039和农大3486的扩增片段与良星99片段不同(图4)。
3 讨论
良星99适宜推广地区包括黄淮冬麦区和北部冬麦区的山东、河北、河南、山西、陕西、安徽、北京、天津等地, 这些地区也是我国白粉病流行的地区。根据本研究的结果, 良星99的抗病基因Pm52在苗期对这些地区 80%的白粉菌菌株有效, 同时也表现很好的成株期抗性。因此, 良星99在其适宜推广地区可比较有效地防控白粉病的发生或减轻白粉病的危害程度。
在正式命名的抗白粉病基因中, 由我国发现的包括簇毛麦Pm21[14]、中间偃麦草Pm40[15]、Pm43[16]、长穗偃麦草 Pm51[17]、野生二粒小麦 Pm41[18]和Pm42[19], 以及普通小麦的 Pm45[20]、Pm47[21]、Pm24b[22]、Pm2b[23]和Pm2c[24]。这些抗病基因或者来自野生近缘种, 或者来自地方品种, 需要经过较长时间的杂交和回交, 才能转育到育种家常用或熟悉的育种亲本中, 才容易被选用。生产上的推广品种集成了很多优良的基因, 一般没有不利基因的牵连, 勿需前期改造即可投入育种和生产利用。因此, 发掘推广品种的抗白粉病基因, 既可为生产上抗病基因布局提供参考, 又可为育种提供优异的抗病亲本。
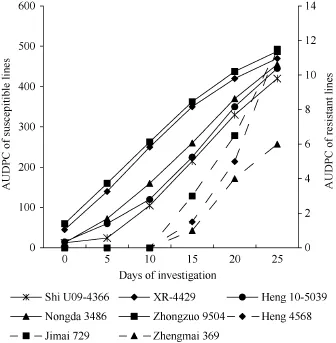
图3 良星99与其衍生品系的病程曲线下面积表现Fig. 3 Area under the disease progress curve (AUDPC) of Liangxing 99 and ten derived wheat lines图中未列出良星99、邯农2312、中信麦99和DH51302, 因其AUPDC值均为0。左侧和右侧纵坐标分别指示感病(实线)和抗病材料(虚线)的AUPDC。Liangxing 99, Hannong 2312, Zhongxinmai 99, and DH51302 are not shown in the graph because their AUDPC values are 0. Left and right ordinates indicate the AUDPC of susceptible genotypes (solid line) and resistant (dot line), respectively.
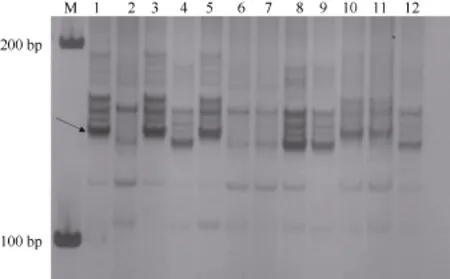
图4 Pm52紧密连锁标记Xgwm120在小麦品种(系)中的扩增结果Fig. 4 An amplification profile of the Pm52-linked marker Xgwm120 from the wheat cultivars or linesM: 100 bp分子标记; 1: 良星99 (Pm52); 2: 中作9504; 3: 衡4568; 4: 石U09-4366; 5: 邯农2312; 6: 冀麦729; 7: 郑麦369; 8: XR-4429; 9: 衡10-5039; 10: 中信麦99; 11: DH51302; 12: 农大3486。箭头示目标条带。M: 100 bp DNA ladder; 1: Liangxing 99; 2: Zhongzuo 9504; 3: Heng 4568; 4: Shi U09-4366; 5: Hannong 2312; 6: Jimai 729; 7: Zhengmai 369; 8: XR-4429; 9: Heng 10-5039; 10: Zhongxinmai 99; 11: DH51305; 12: Nongda 3486. Arrow indicates the target band.
实际上, 利用良星99已经培育出优良品系进入区域试验。本研究采用多菌株抗性鉴定和 Pm52基因连锁分子标记Xgwm120检测, 在10个以良星99为亲本培育的小麦新品系中发现, 衡 4568、邯农2312、中信麦99和DH51302等4个品系可能含有Pm52基因。另外4个品系石U09-4366、XR-4429、衡10-5039和农大3486无论在苗期, 还是在成株期都表现感病, 分子标记分析的带型也与良星 99不同,表明这些材料尽管以良星99作为亲本之一, 但不含有Pm52基因。冀麦729和郑麦369的抗谱与良星99存在差异, 也没有扩增出与良星99相同的特征条带, 表明这两个品种的白粉病抗性可能与 Pm52基因不同。据报道, 冀麦 729的亲本藁 9618, 以及郑麦369的亲本郑麦366, 均表现中抗白粉病[25-26]。采用分子标记定位可以准确地确定冀麦729和郑麦369抗白粉病基因。这些结果表明, 利用良星99有可能培育出高抗白粉病的小麦新品种。
在我国生产上一些推广品种中也含有其他抗白粉病基因。良星66[27]、农大399[28]、汶农14[29]、中麦155[30]和婴泊700[31]分别含有Pm2基因座的等位基因。小麦品种豫麦66和郑9754中的抗白粉病基因位于2AL染色体[32-33]。唐麦4号、济麦22和周麦 22的抗白粉病基因分别位于 7BL[34]、2BL[35]和 3BL[36]。这些抗病基因均具有优良的遗传背景,可以与良星99的Pm52基因聚合起来, 培育抗谱更广的抗病品种。
4 结论
良星99的抗白粉病基因 Pm52在苗期对来自不同小麦生产区80%的供试菌株(123个)表现抗性反应型, 成株期调查良星99表现高抗白粉病。在10个以良星99为亲本培育的小麦品系中, 衡4568、邯农2312、中信麦99和DH51302与良星99的抗谱相似,分子标记检测的带型与良星99相同, 这些品系的白粉病抗性可能来源于良星99的Pm52基因。根据抗谱分析和分子标记检测结果, 郑麦369和冀麦729的白粉病抗性可能来自其他亲本。石U09-4366、XR-4429、衡10-5039和农大3486在苗期和成株期都不抗白粉病。致谢: 感谢中国农业科学院植物保护研究所周益林研究员提供成株期抗性鉴定的白粉菌菌株。
[1] Cowger C, Miranda L, Griffey C, Hall M, Murphy J P, Maxwell J. Wheat powdery mildew. In: Sharma I (ed) Disease resistance in wheat. CABI, Oxfordshire, 2012. pp 84–119.
[2] Hardwick N V, Jenkins J E, Collins B, Groves S J. Powdery mildew (Erysiphe graminis) on winter wheat: control with fungicides and the effects on yield. Crop Prot, 1994, 13: 93–98
[3] 史倩倩, 范洁茹, 周益林, 邹亚飞, 段霞瑜. 2012年部分麦区小麦白粉菌群体对三唑酮敏感性及其与毒性的关系. 植物病理学报, 2015, 45: 181–187 Shi Q Q, Fan J R, Zhou Y L, Zou Y F, Duan X Y. Triadimefon sensitivity and its correlation with the virulence population of Blumeria graminis f. sp. tritici in some wheat growing areas in 2012. Acta Phytopathol Sin, 2015, 45: 181–187 (in Chinese with English abstract)
[4] Rabinovich S V. Importance of wheat-rye translocation for breeding modern cultivars of Triticum aestivum L. Euphytica, 1998, 100: 323–340
[5] 周阳, 何中虎, 张改生, 夏兰琴, 陈新民, 高永超, 井赵斌, 于广军. 1BL/1RS易位系在我国小麦育种中的应用. 作物学报, 2004, 30: 531–535 Zhou Y, He Z H, Zhang G S, Xia L Q, Chen X M, Gao Y C, Jing Z B, Yu G J. Utilization of 1BL/1RS translocation in wheat breeding in China. Acta Agron Sin, 2004, 30: 531–535 (in Chinese with English abstract)
[6] 李洪杰, 王晓鸣, 宋凤景, 伍翠平, 武小菲, 张宁, 周阳, 张学勇. 中国小麦品种对白粉病的抗性反应与抗病基因检测. 作物学报, 2011, 37: 943–954 Li H J, Wang X M, Song F J, Wu C P, Wu X F, Zhang N, Zhou Y, Zhang X Y. Response to powdery mildew and detection of resistance genes in wheat cultivars from China. Acta Agron Sin, 2011, 37: 943–954 (in Chinese with English abstract)
[7] Zhao Z H, Sun H G, Song W, Lu M, Huang J, Wu L F, Wang X M, Li H J. Genetic analysis and detection of the gene MlLX99 on chromosome 2BL conferring resistance to powdery mildew in the wheat cultivar Liangxing 99. Theor Appl Genet, 2013, 126: 3081–3089
[8] McIntosh R A, Dubcovsky J, Rogers W J, Morris C, Appels R, Xia X C. Catalogue of gene symbols for wheat: 2013–2014 supplement. http://shigen.nig.ac.jp/wheat/komugi/genes/macgene/ supplement2013.pdf
[9] 司权民, 张新心, 段霞瑜, 盛宝钦. 小麦白粉病菌生理小种鉴定. 中国农业科学, 1987, 20(5): 64–70 Si Q M, Zhang X X, Duan X Y, Sheng B Q. Identification of isolates of Erysiphe graminis f. sp. tritici. Sci Agric Sin, 1987, 20(5): 64–70 (in Chinese with English abstract)
[10] 盛宝钦. 用反应型记载小麦苗期白粉病. 植物保护, 1988, 14(1): 49 Sheng B Q. Identification of powdery mildew infection type at seedling stage. Plant Prot, 1988, 14(1): 49 (in Chinese)
[11] Saari E E, Prescott J M. A scale for appraising the foliar intensity of wheat diseases. Plant Dis Rep, 1975, 59: 377–381
[12] 刘金栋, 陈新民, 何中虎, 伍玲, 白斌, 李在峰, 夏先春. 小麦慢白粉病QTL对条锈病和叶锈病的兼抗性. 作物学报, 2014, 40: 1557–1564 Liu J D, Chen X M, He Z H, Wu L, Bai B, Li Z F, Xia X C. Resistance of slow mildewing genes to stripe rust and leaf rust in common wheat. Acta Agron Sin, 2014, 40: 1557–1564 (in Chinese with English abstract)
[13] Lin F, Chen X M. Quantitative trait loci for non-race-specific, high-temperature adult-plant resistance to stripe rust in wheat cultivar Express. Theor Appl Genet, 2009, 118: 631–642
[14] 齐莉莉, 陈佩度, 刘大钧, 周波, 张守中, 盛宝钦, 向齐君, 段霞瑜, 周益林. 小麦白粉病新抗源——基因 Pm21. 作物学报, 1995, 21: 257–262 Qi L L, Chen P D, Liu D J, Zhou B, Zhang S Z, Sheng B Q, Xiang Q J, Duan X Y, Zhou Y L. The gene Pm21: a new source for resistance to wheat powdery mildew. Acta Agron Sin, 1995, 21: 257–262 (in Chinese with English abstract)
[15] Luo P G, Luo H Y, Chang Z J, Zhang H Y, Zhang M, Ren Z L. Characterization and chromosomal location of Pm40 in common wheat: a new gene for resistance to powdery mildew derived from Elytrigia intermedium. Theor Appl Genet, 2009, 118: 1059–1064
[16] He R L, Chang Z J, Yang Z J, Yuan Z Y, Zhan H X, Zhang X J, Liu J X. Inheritance and mapping of powdery mildew resistance gene Pm43 introgressed from Thinopyrum intermedium into wheat. Theor Appl Genet, 2009, 118: 1173–1180
[17] Zhan H X, Li G R, Zhang X J, Li X, Guo H J, Gong W P, Jia J Q, Qiao L Y, Ren Y K, Yang Z J, Chang Z J. Chromosomal location and comparative genomics analysis of powdery mildew resistance gene Pm51 in a putative wheat–Thinopyrum ponticum introgression line. PLoS One, 2014, 9: e113455
[18] Li G Q, Fang T L, Zhang H T, Xie C J, Li H J, Yang T M, Nevo E, Fahima T, Sun Q X, Liu Z Y. Molecular identification of a new powdery mildew resistance gene Pm41 on chromosome 3BL derived from wild emmer (Triticum turgidum var. dicoccoides). Theor Appl Genet, 2009, 119: 531–539
[19] Hua W, Liu Z J, Zhu J, Xie C J, Yang T M, Zhou Y L, Duan X Y, Sun Q X, Liu Z Y. Identification and genetic mapping of pm42, a new recessive wheat powdery mildew resistance gene derived from wild emmer (Triticum turgidum var. dicoccoides). Theor Appl Genet, 2009, 119: 223–230
[20] Ma H Q, Kong Z G, Fu B H, Li N, Zhang L X, Jia H Y, Ma Z Q. Identification and mapping of a new powdery mildew resistance gene on chromosome 6D of common wheat. Theor Appl Genet, 2011, 123: 1099–1106
[21] Xiao M G, Song F J, Jiao J F, Wang X M, Xu H X, Li H J. Identification of the gene Pm47 on chromosome 7BS conferring resistance to powdery mildew in the Chinese wheat landrace Hongyanglazi. Theor Appl Genet, 2013, 126: 1397–1403
[22] Xue F, Wang C Y, Li C, Duan X Y, Zhou Y L, Zhao N J, Wang Y J, Ji W Q. Molecular mapping of a powdery mildew resistance gene in common wheat landrace Baihulu and its allelism with Pm24. Theor Appl Genet, 2012, 125: 1425–1432
[23] Ma P T, Xu H X, Xu Y F, Li L H, Qie Y M, Luo Q L, Zhang X T, Li X Q, Zhou Y L, An D G. Molecular mapping of a new powdery mildew resistance gene Pm2b in Chinese breeding lineKM2939. Theor Appl Genet, 2015, 128: 613–622
[24] Xu H X, Yi Y J, Ma P T, Qie Y M, Fu X Y, Xu Y F, Zhang X T, An D G. Molecular tagging of a new broad-spectrum powdery mildew resistance allele Pm2c in Chinese wheat landrace Niaomai. Theor Appl Genet, 2015, 128: 2077–2084
[25] 梁新棉, 刘玉平. 河北省优质冬小麦区域试验品种主要农艺性状分析. 河北农业科学, 2006, 10(1): 52–55 Liang X M, Liu Y P. Analysis of the major agronomical characters of wheat varieties in the Hebei provincial high quality winter wheat regional yield trial. J Hebei Agric Sci, 2006, 10(1): 52–55 (in Chinese with English abstract)
[26] 胡锐, 邢彩云, 吴营昌, 沙广乐, 李丽霞, 杨爱华. 11个优质小麦品种对小麦白粉病抗性的初步鉴定. 河南农业科学, 2011, 40(5):108–110 Hu R, Xing C Y, Wu Y C, Sha G L, Li M X, Yang A H. Primary identification of resistance of eleven high-quality wheat cultivars to wheat powdery mildew. J Henan Agric Sci, 2011, 40(5): 108–110 (in Chinese with English abstract)
[27] Huang J, Zhao Z H, Song F J, Wang X M, Xu H X, Huang Y, An D G, Li H J. Molecular detection of a gene effective against powdery mildew in the wheat cultivar Liangxing 66. Mol Breed, 2012, 30: 1737–1745
[28] 李丹, 袁成国, 吴海彬, 张栋, 梁永, 王振忠, 吴秋红, 陈永兴,杨作民, 孙其信, 刘志勇. 普通小麦品种农大399抗白粉病基因SSR和AFLP–SCAR分子标记. 植物遗传资源学报, 2013, 14: 104–108 Li D, Yuan C G, Wu H B, Zhang D, Liang Y, Wang Z Z, Wu Q H, Chen Y X, Yang Z M, Sun Q X, Liu Z Y. SSR and AFLP-derived SCAR markers associated with the powdery mildew resistance gene in common wheat cultivar ND399. J Plant Genet Resour, 2013, 14: 104–108 (in Chinese with English abstract)
[29] 宋伟, 孙会改, 孙艳玲, 赵紫慧, 王晓鸣, 武小菲, 李洪杰. 小麦品种汶农14抗白粉病基因的染色体定位. 作物学报. 2014, 40: 798–804 Song W, Sun H G, Sun Y L, Zhao Z H, Wang X M, Wu X F, Li H J. Chromosomal localization of resistance gene to powdery mildew in the wheat cultivar Wennong 14. Acta Agron Sin, 2014, 40: 798–804 (in Chinese with English abstract)
[30] Sun H G, Song W, Sun Y L, Chen X M, Liu J J, Zou J W, Wang X M, Zhou Y F, Lin X H, Li H J. Resistance to powdery mildew in the wheat cultivar Zhongmai 155: effectiveness and molecular detection of the resistance gene. Crop Sci, 2015, 55: 1017–1025
[31] Ma P T, Zhang H X, Xu H X, Xu Y F, Cao Y W, Zhang X T, An D G. The gene PmYB confers broad-spectrum powdery mildew resistance in the multi-allelic Pm2 chromosome region of the Chinese wheat cultivar Yingbo 700. Mol Breed, 2015, 35: 1–10
[32] 胡铁柱, 李洪杰, 刘子记, 谢超杰, 周益林, 段霞瑜, 贾旭, 尤明山, 杨作民, 孙其信, 刘志勇. 普通小麦品种“豫麦 66”抗白粉病基因的鉴定与分子标记. 作物学报, 2008, 34: 545–550 Hu T Z, Li H J, Liu Z J, Xie C J, Zhou Y L, Duan X Y, Jia X, You M S, Yang Z M, Sun Q X, Liu Z Y. Identification and molecular mapping of the powdery mildew resistance gene in wheat cultivar Yumai 66. Acta Agron Sin, 2008, 34: 545–550 (in Chinese with English abstract)
[33] Xu W G, Li C X, Hu L, Wang H W, Dong H B, Zhang J Z, Zan X C. Identification and molecular mapping PmHNK54: a novel powdery mildew resistance gene in common wheat. Plant Breed, 2011, 130: 603–607
[34] 胡铁柱, 李洪杰, 谢超杰, 尤明山, 杨作民, 孙其信, 刘志勇.小麦品种“唐麦 4号”抗白粉病基因的分子标记与染色体定位. 作物学报, 2008, 34: 1193–1198 Hu T Z, Li H J, Xie C J, You M S, Yang Z M, Sun Q X, Liu Z Y. Molecular mapping and chromosomal location of the powdery mildew resistance gene in wheat cultivar Tangmai 4. Acta Agron Sin, 2008, 34: 1193–1198 (in Chinese with English abstract)
[35] 殷贵鸿, 李根英, 何中虎, 刘建军, 王辉, 夏先春. 小麦新品种济麦22抗白粉病基因的分子标记定位. 作物学报, 2009, 35: 1425–1431 Yin G H, Li G Y, He Z H, Liu J J, Wang H, Xia X C. Molecular mapping of powdery mildew resistance gene in wheat cultivar Jimai 22. Acta Agron Sin, 2009, 35: 1425–1431 (in Chinese with English abstract)
[36] Xu W G, Li C X, Hu L, Zhang L, Zhang J Z, Dong H B, Wang G S. Molecular mapping of powdery mildew resistance gene PmHNK in winter wheat (Triticum aestivum L.) cultivar Zhoumai 22. Mol Breed, 2010, 26: 31–38
Pm52: Effectiveness of the Gene Conferring Resistance to Powdery Mildew in Wheat Cultivar Liangxing 99
ZOU Jing-Wei1,2, QIU Dan1,2, SUN Yan-Ling2, ZHENG Chao-Xing3, LI Jing-Ting4, WU Pei-Pei2, WU Xiao-Fei2, WANG Xiao-Ming2, ZHOU Yang2, and LI Hong-Jie2,*
1College of Life Science and Technology, Hebei Normal University of Science and Technology, Qinhuangdao 066004, China;2National Key Facility for Crop Gene Resources and Genetic Improvement / Institute of Crop Science, Chinese Academy of Agricultural Sciences, Beijing 100081, China;3College of Chemistry and Environment Engineering, Pingdingshan College, Pingdingshan 467000, China;4College of Life Science, Beijing Normal University, Beijing 100875, China
Liangxing 99 is a powdery mildew-resistant winter wheat cultivar adapted to the Yellow–Huai Rivers Valley Facultative Wheat Zone and the Northern Winter Wheat Zone. Its powdery mildew resistance is conferred by gene Pm52 on chromosome 2BL. A total of 123 isolates of Blumeria graminis f. sp. tritici collected from different wheat producing regions were used in assessment of disease resistance, and Liangxing 99 was resistant to 80% of them. During the five consecutive growing seasons from 2012 to 2016, Liangxing 99 was immune or highly resistant to the mixture of Bgt isolate inoculated at the adult plant stage. A gene-specific marker Xgwm120 closedly linked to Pm52 and 27 Bgt isolates were used to analyze ten wheat cultivars with Liangxing 99 as a parent. Heng 4568, Hannong 2312, Zhongxinmai 99, and DH51302 may inherit Pm52 from Liangxing 99, while the powdery mildew resistance genes of Zhengmai 369 and Jimai 729 may differ from Pm52. Shi U09-4366, XR4429, Heng 10-5039, and Nongda 3486 were susceptible to all the Bgt isolates examined and did not carry gene Pm52. The responses of these cultivars at the adult plant stage were consistent with those at the seedling stage. Results from this study are favorable to facilitate the effective application of Pm52 from Liangxing 99 in breeding programs and the production of wheat.
Pm52; Liangxing 99; Wheat powdery mildew; Resistance
10.3724/SP.J.1006.2017.00332
本研究由国家自然科学基金项目(31471491, 31501310), 国家转基因生物新品种培育科技重大专项(2014ZX0800906B-003)和中国农业科学院农业创新工程项目资助。
This study was supported by the National Natural Science Foundation of China (31471491 and 31501310), the National Major Project for Developing New GM Crops (2014ZX0800906B-003), and the Agricultural Science and Technology Innovation Program of CAAS.
*通讯作者(Corresponding author): 李洪杰, E-mail: lihongjie@caas.cn
联系方式: E-mail: zoujingwei2013@qq.com
稿日期): 2016-06-11; Accepted(接受日期): 2016-09-18; Published online(
日期): 2016-09-29.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160929.1451.010.html

